第一章 药理学总论
绪言
一、药理学的性质与任务
药理学(pharmacology)是研究药物的学科之一,是一门为临床合理用药防治疾病提供基本理论的医学基础学科。药理学研究药物与机体(包括病原体)相互作用的规律及其原理。药物(drug)是指用以防治及诊断疾病的物质,在理论上说,凡能影响机体器官生理功能及(或)细胞代谢活动的化学物质都属于药物范畴,也包括避孕药及保健药。药理学一方面研究在药物影响下机体细胞功能如何发生变化,另一方面研究药物本身在体内的过程,即机体如何对药物进行处理,前者称为药物效应动力学(pharmacodynamics),简称药效学;后者称为药物代谢动力学(pharmacokinetics),简称药动学。可见药理学研究的主要对象是机体,属于广义的生理科学范畴。它与主要研究药物本身的药学科学,如生药学、药物化学、药剂学、制药学等学科有明显的区别。药理学是以生理学、生化学、病理学等为基础,为指导临床各科合理用药提供理论基础的桥梁学科。药理学的学科任务是要为阐明药物作用机制、改善药物质量、提高药物疗效、开发新药、发现药物新用途并为探索细胞生理生化及病理过程提供实验资料。药理学的方法是实验性的,即在严格控制的条件下观察药物对机体或其组成部分的作用规律并分析其客观作用原理。近年来逐渐发展而设立的临床药理学是以临床病人为研究和服务对象的应用科学,其任务是将药理学基本理论转化为临床用药技术,即将药理效应转化为实际疗效,是基础药理学的后继部分。学习药理学的主要目的是要理解药物有什么作用、作用机制及如何充分发挥其临床疗效,要理论联系实际了解药物在发挥疗效过程中的因果关系。
二、药物与药理学的发展史
远古时代人们为了生存从生活经验中得知某些天然物质可以治疗疾病与伤痛,这是药物的源始。这些实践经验有不少流传至今,例如饮酒止痛、大黄导泻、楝实祛虫、柳皮退热等。以后在宗教迷信与邪恶斗争及封建君王寻求享乐与长寿中药物也有所发展。但更多的是将民间医药实践经验的累积和流传集成本草,这在我国及埃及、希腊、印度等均有记载,例如在公元一世纪前后我国的《神农本草经》及埃及的《埃伯斯医药籍》(Ebers’Papyrus)等。明朝李时珍的《本草纲目》(1596)在药物发展史上有巨大贡献,是我国传统医学的经典著作,全书共52卷,约190万字,收载药物1892种,插图1160帧,药方11000余条,是现今研究中药的必读书籍,在国际上有七种文字译本流传。在西欧文艺复兴时期(十四世纪开始)后,人们的思维开始摆脱宗教束缚,认为事各有因,只要客观观察都可以认识。瑞士医生Paracelsus(1493-1541)批判了古希腊医生Galen恶液质唯心学说,结束了医学史上1500余年的黑暗时代。后来英国解剖学家W.Harvey (1578-1657)发现了血液循环,开创了实验药理学新纪元。意大利生理学家F.Fontana (1720-1805)通过动物实验对千余种药物进行了毒性测试,得出了天然药物都有其活性成分,选择作用于机体某个部位而引起典型反应的客观结论。这一结论以后为德国化学家F.W.Serturner(1783-1841)首先从罂粟中分离提纯吗啡所证实。18世纪后期英国工业革命开始,不仅促进了工业生产也带动了自然科学的发展。其中有机化学的发展为药理学提供了物质基础,从植物药中不断提纯其活性成分,得到纯度较高的药物,如依米丁、奎宁、士的宁、可卡因等。以后还开始了人工合成新药,如德国微生物学家P.Ehrlich从近千种有机砷化合物中筛选出治疗梅毒有效的新胂凡纳明(914)。药理学作为独立的学科应从德国R.Buchheim(1820-1879)算起,他建立了第一个药理实验室,写出第一本药理教科书,也是世界上第一位药理学教授。其学生O.Schmiedeberg(1838-1921)继续发展了实验药理学,开始研究药物的作用部位,被称为器官药理学。受体原是英国生理学家J.N.Langley(1852-1925)提出的药物作用学说,现已被证实是许多特异性药物作用的关键机制此后药理学得到飞跃发展,第二次世界大战结束后出现了许多前所未有的药理新领域及新药,如抗生素、抗癌药、抗精神病药、抗高血压药、抗组胺药、抗肾上腺素药等。近年来药动学的发展使临床用药从单凭经验发展为科学计算,并促进了生物药学(biopharmaceutics)的发展。药效学方面逐渐向微观世界深入,阐明了许多药物作用的分子机制也促进了分子生物学本身的发展。展望今后,药理学将针对疾病的根本原因,发展病因特异性药物治疗,那时将能进一步收到药到病除的效果。
三、新药开发与研究
人们生活水平提高要求更多更好的新药,药物科学的发展为新药开发提供了理论基础和技术条件,市场经济竞争也促进了新药快速发展。美国食品与药物管理局(FDA)近十年来每年批准上市的新药都在20种以上。我国近年来引进新药品种很多,但需要加快创新。新药开发是一个非常严格而复杂的过程,各药虽然不尽相同,药理研究却是必不可少的关键步骤。临床有效的药物都具有相应的药理效应,但具有肯定药理效应的药物却不一定都是临床有效的药物。例如抗高血压药都能降低血压,但降压药并不都是抗高血压药,更不一定是能减少并发症、延长寿命的好药。因此新药开发研究必需有一个逐步选择与淘汰的过程。为了确保药物对病人的疗效和安全,新药开发不仅需要可靠的科学实验结果,各国政府还对新药生产上市的审批与管理制定了法规,对人民健康及工商业经济权益予以法律保障。
新药来源包括天然产物、半合成及全合成化学物质。过去选药主要方法是依靠实践经验,现在可以根据有效药物的植物分类学找寻近亲品种进行筛选或从有效药物化学结构与药理活性关系推断,定向合成系列产品,然后进行药理筛选。近年来对于机体内在抗病物质(蛋白成分)利用DNA基因重组技术,即将DNA的特异基因区段分离并植入能够迅速生长的细菌或酵母细胞,以获得大量所需蛋白药物。此外,还可对现有药物进行化学结构改造(半合成)或改变剂型,也可获得疗效更好,毒性更小或应用更方便的药物。
新药研究过程大致可分三步,即临床前研究、临床研究和售后调研。临床前研究包括用动物进行的系统药理研究及急慢性毒性观察。对于具有选择性药理效应的药物,在进行临床试验前还需要测定该药物在动物体内的吸收、分布及消除消除过程。临床前研究是要弄清新药的作用谱及可能发生的毒性反应。在经过药物管理部门的初步审批后才能进行临床试验。目的在于保证用药安全。
临床研究首先在10~30例正常成年志愿者观察新药耐受性,找出安全剂量。再选择有特异指征的病人按随机分组、设立已知有效药物及空白安慰剂双重对照(对急重病人不得采用有损病人健康的空白对照),并尽量采用双盲法(病人及医护人员均不能分辨治疗药品或对照药品)观察,然后进行治疗结果统计分析,客观地判断疗效。与其同时还需进行血药浓度监测计算药动学数据(详第三章)。受试病例数一般不应少于300例,先在一个医院以后可扩大至三个以上医疗单位进行多中心合作研究。对那些需要长期用药的新药,应有50~100例病人累积用药半年至一年的观察记录。由此制定适应证、禁忌证、剂量疗程及说明可能发生的不良反应后,再经过药政部门的审批才能生产上市。
售后调研(postmarketing surveillance)是指新药问市后进行的社会性考查与评价,在广泛的推广应用中重点了解长期使用后出现的不良反应和远期疗效(包括无效病例)。药物只能依靠广大用药者(医生及病人)才能作出正确的历史性评价。
第二章 药物效应动力学
第一节 药物的基本作用
一、药物作用与药理效应
药物作用(drug action)是指药物与机体细胞间的初始作用,是动因,是分子反应机制,有其特异性(specificity)。药理效应(pharmacological effect)是药物作用的结果,是机体反应的表现,对不同脏器有其选择性(selectivity)。因此,药理效应实际上是机体器官原有功能水平的改变,功能的提高称为兴奋(excitation)、亢进(augmentation),功能的降低称为抑制(inhibition)、麻痹(paralysis)。过度兴奋转入衰竭(failure),是另外一种性质的抑制。近年来生命科学的迅速发展,能引起细胞形态与功能发生质变的药物受到注意,例如某些物质可以引起细胞癌变,基因疗法能使机体引出遗传缺陷时或原来没有的特殊功能。药物作用特异性强的药物不一定引起选择性高的药理效应,二者不一定平行。例如阿托品特异性阻断M-胆碱受体,但药理效应选择性并不高,对心脏、血管、平滑肌、腺体及中枢神经功能都有影响,而且有的兴奋、有的抑制。作用特异性强及(或)效应选择性高的药物应用时针对性较好。反之,效应广泛的药物副反应较多。但广谱药物在多种病因或诊断未明时也有其方便之处,例如广谱抗生素、广谱抗心律失常药等。
药理效应与治疗效果,后者简称疗效(therapeutic effect)并非同义词,例如具有扩张冠脉效应的药物不一定都是抗冠心病药,抗冠心病药也不一定都会取得缓解心绞痛临床疗效,有时还会产生不良反应(adverse reaction),这就是药物效应的两重性:药物既能治病也能致病。
二、治疗效果
1.对因治疗(etiological treatment)用药目的在于消除原发致病因子,彻底治愈疾病称为对因治疗,或称治本,例如抗生素消除体内致病菌。
2.对症治疗(symptomatic treatment)用药目的在于改善症状称为对症治疗,或称治标。对症治疗未能根除病因,但在诊断未明或病因未明暂时无法根治的疾病却是必不可少的。在某些重危急症如休克、惊厥、心力衰竭、高热、剧痛时,对症治疗可能比对因治疗更为迫切。
三、不良反应
凡不符合用药目的并为病人带来不适或痛苦的反应统称为药物不良反应。多数不良反应是药物固有效应的延伸,在一般情况下是可以以预知的,但不一定是可以避免的。少数较严重的不良反应是较难恢复的,称为药原性疾病(drug induced disease),例如庆大霉素引起神经性耳聋,肼屈嗪引起红斑性狼疮等。
1.副反应(side reaction)由于药理效应选择性低,涉及多个效应器官,当某一效应用作治疗目的时,其他效应就成为副反应(通常也称副作用)。例如阿托品用于解除胃肠痉挛时,将会引起口干、心悸、便秘等副反应。副反应是在常用剂量下发生的,一般不太严重,但是难以避免的。
2.毒性反应(toxic reaction)毒性反应是指在剂量过大或蓄积过多时发生的危害性反应,一般比较严重,但是可以预知也是应该避免发生的不良反应。急性毒性多损害循环、呼吸及神经系统功能,慢性毒性多损害肝、肾、骨髓、内分泌等功能。致癌(carcinogenesis)、致畸胎(teratogenesis)、致突变(mutagenesis)三致反应也属于慢性毒性范畴。企图增加剂量或延长疗程以达到治疗目的是有限度的,过量用药是十分危险的。
3.后遗效应(residual effect)后遗效应是指停药后血药浓度已降至阈浓度以下时残存的药理效应。例如长期应用肾上腺皮质激素停药后肾上腺皮质功能低下数月内难以恢复。
4.停药反应(withdrawal reaction)突然停药后原有疾病的加剧,又称回跃反应(rebound reaction),例如长期服用可乐定降血压,停药次日血压将激烈回升。
5.变态反应(allergic reaction)变态反应是一类免疫反应。非肽类药物作为半抗原与机体蛋白结合为抗原后,经过接触10天左右敏感化过程而发生的反应,也称过敏反应(hypersensitive reaction)。常见于过敏体质病人。临床表现各药不同,各人也不同。反应性质与药物原有效应无关,用药理拮抗药解救无效。反应严重度差异很大,与剂量也无关,从轻微的皮疹、发热至造系统抑制,肝肾功能损害、休克等。可能只有一种症状,也可能多种症状同时出现。停药后反应逐渐消失,再用时可能再发。致敏物质可能是药物本身,可能是其代谢物,也可能是药剂中杂质。临床用药前常做皮肤过敏试验,但仍有少数假阳性或假阴性反应。可见这是一类非常复杂的药物反应。
6.特异质反应(idiosyncrasy)少数特异体质病人对某些药物反应特别敏感,反应性质也可能与常人不同,但与药物固有药理作用基本一致,反应严重度与剂量成比例,药理拮抗药救治可能有效。这种反应是免疫反应,故不需预先敏化过程。现在知道这是一类药理遗传异常所致的反应,例如对骨骼肌松弛药司可林特异质反应是由于先天性血浆胆碱酯酶缺乏。
第二节 药物剂量与效应关系
药理效应与剂量在一定范围内成比例,这就是剂量-效应关系(dose-effect rela-tion-ship)。由于药理效应与血药浓度的关系较为密切,故在药理学研究中更常用浓度-效应关系(concentration-effect relationship)。用效应强弱为纵座标、药物浓度为横座标作图得直方双曲线(rectangular hyperbola)。如将药物浓度改用对数值作图则呈典型的对称S型曲线,这就是通常所讲的量效曲线(图2-1)。药理效应强弱有的是连续增减的量变,称为量反应(graded response),例如血压的升降、平滑肌舒缩等,用具体数量或最大反应的百分率表示。有些药理效应只能用全或无,阳性或阴性表示称为质反应(all-or-noneresponse或quantalresponse),如死亡与生存、抽搐与不抽搐等,必需用多个动物或多个实验标本以阳性率表示。用累加阳性率对数剂量(或浓度)作图也呈典型对称S型量效曲线(图2-2)。
从上述两种量效曲线可以看出下列几个特定位点:最小有效浓度(minimumeffective concentration),即刚能引起效应的阈浓度(thresholdconcentration)。如果横座标用剂量表示,将“浓度”改为“剂量”即可,下同。半数有效量(medianeffective dose)是能引起50%阳性反应(质反应)或50%最大效应(量反应)的浓度或剂量,分别用半数有效浓度(EC50)及半数有效剂量(ED50)表示。如果效应指标为中毒或死亡则可改用半数中毒浓度(TC50)、半数中毒剂量(TD50)或半数致死浓度(LC50)、半数致死剂量(LD50)表示。继续增加浓度或剂量而效应量不再继续上升时,这在量反应中称为最大效能(maximumefficacy),反映药物的内在活性。在质反应中阳性反应率达100%,再增加药量也不过如此。如果反应指标是死亡则此时的剂量称为最小致死量(minimumlethal dose)。药物效应强度(potency)是指能引起等效反应(一般采用50%效应量)的相对浓度或剂量,反映药物与受体的亲和力,其值越小则强度越大。药物的最大效能与效应强度含意完全不同,二者并不平行。例如利尿药以每日排钠量为效应指标进行比较氢氯噻嗪的效应强度大于呋塞米,而后者的最大效能大于前者(图2-3)。药物的最大效能值有较大实际意义,不区分最大效能与效应强度只讲某药较另药强若干倍是易被误解的。量效曲线中段斜率(slope)较陡的提示药效较激烈,较平坦的提示药效较温和。但在质反应曲线,斜率较陡的曲线还提示实验个体差异较小。曲线上的每个具体数据常用标准差(standarddeviation)表示个体差异(inpidualvariation)。
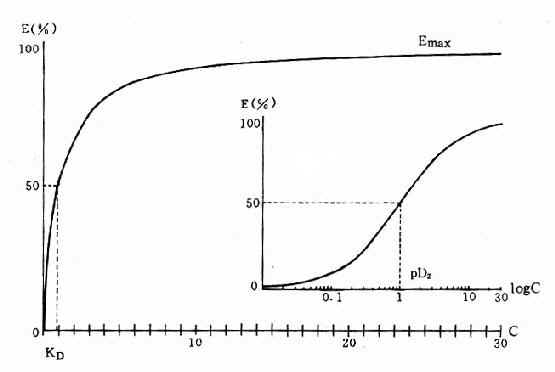
图2-1 药物作用的量效关系曲线
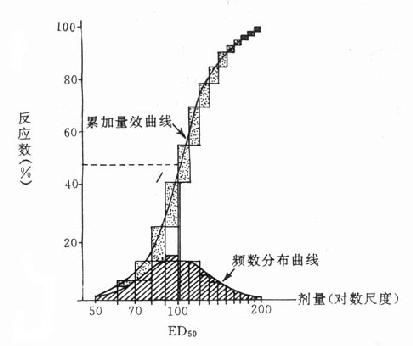
图2-2 质反应的频数分布曲线和累加量效曲线
频数分布曲线:100个人的有限剂量分布情况
(常态分布);累加量效曲线:频数分布曲线中每个长方形的累加曲线
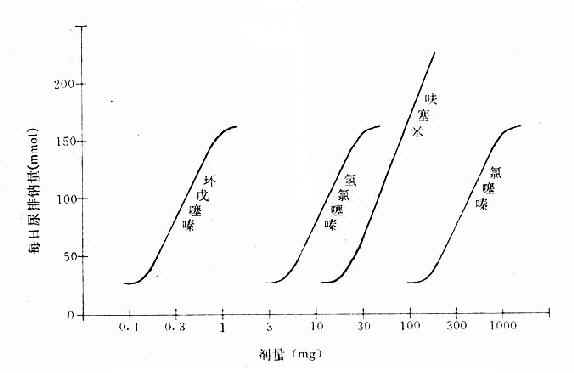
图2-3 各种利尿药的作用强度及最大效能比较
TD50/ED50或TC50/EC50的比值称为治疗指数(therapeutic index),是药物的安全性指标。治疗指数为4的药物相对较治疗指数为2的药物安全。由于TD与ED两条量曲线的首尾可能重叠,即ED95可能大于TD5,就是说在没能获得充分疗效的剂量时可能已有少数病人中毒,因此不能认为治疗指数为4的药物是安全的。还由于该指标所指的药物效应及毒性反应性质不明确,这一安全指标并不可靠。在动物实验常用LD50/ED50作为治疗指数,性质相似。较好的药物安全性指标是ED95~TD5之间的距离,称为安全范围(margin ofsafety),其值越大越安全。药物的安全性与药物剂量(或浓度)有关,因此如果将ED与TD两条量效曲线同时画出并加以比较则比较具体(图2-4)。
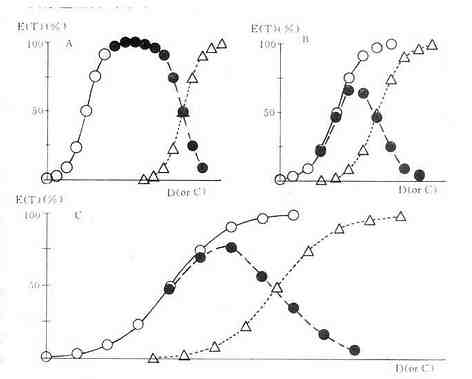
图2-4 药物的安全性指标:治疗指数及安全范围
A药的治疗指数比B药大 A药与C药的治疗指数相等,但A药的安全范围较大C药的治疗指数比B药大,而安全范围无区别
○有效量的量效关系 △中毒量的量效关系
●有效百分数减中毒百分数
关于药物剂量各国药典都制定了常用剂量范围,非药典药药厂在说明书上也有介绍。药典对于剧毒类药品还规定了极量(包括单剂量、一日量及疗程量),超限用药造成不良后果医生应负法律责任。
第三节 药物作用机制
药物效应多种多样,是不同药物分子与机体不同靶细胞间相互作用的结果。药物作用的性质首先取决于药物的化学结构,包括基本骨架、活性基团、侧链长短及立体构形等因素。这些构效关系(structure-activityrelationship)是药物化学研究的主要问题,但它有助于加强医生对药物作用的理解。药理效应是机体细胞原有功能水平的改变,从药理学角度来说,药物作用机制(mechanismof action)要从细胞功能方面去探索。
1.理化反应抗酸药中和胃酸以治疗溃疡病,甘露醇在肾小管内提升渗透压而利尿等是分别通过简单的化学反应及物理作用而产生的药理效应。
2.参与或干扰细胞代谢补充生命代谢物质以治疗相应缺乏症的药例很多,如铁盐补血、胰岛素治糖尿病等。有些药物化学结构与正常代谢物非常相似,掺入代谢过程却往往不能引起正常代谢的生理效果,实际上导致抑制或阻断代谢的后果,称为伪品掺入(counterfeitincorporation)也称抗代谢药(antimetabolite)。例如5-氟尿嘧啶结构与尿嘧啶相似,掺入癌细胞DNA及RNA中干扰蛋白合成而发挥抗癌作用。
3.影响生理物质转运很多无机离子、代谢物、神经递质、激素在体内主动转运需要载体参与。干扰这一环节可以产生明显药理效应。例如利尿药抑制肾小管Na+-K+、Na+-H+交换而发挥排钠利尿作用。
4.对酶的影响酶的品种很多,在体内分布极广,参与所有细胞生命活动,而且极易受各种因素的影响,是药物作用的一类主要对象。多数药物能抑制酶的活性,如新斯的明竞争性抑制胆碱酯酶,奥美拉唑不可逆性抑制胃粘膜H+-K+ATP酶(抑制胃酸分泌)。尿激酶激活血浆溶纤酶原,苯巴比妥诱导肝微粒体酶,解磷定能使遭受有机磷酸酯抑制的胆碱酯酶复活,而有些药本身就是酶,如胃蛋白酶。
5.作用于细胞膜的离子通道细胞膜上无机离子通道控制Na+、Ca2+、K+、Cl-等离子跨膜转运,药物可以直接对其作用,而影响细胞功能。
6.影响核酸代谢核酸(DNA及RNA)是控制蛋白质合成及细胞分裂的生命物质。许多抗癌药是通过干扰癌细胞DNA或RNA代谢过程而发挥疗效的。许多抗生素(包括喹诺酮类)也是作用于细菌核酸代谢而发挥抑菌或杀菌效应的,这将在有关章节详述。
7.影响免疫机制除免疫血清及疫苗外,免疫增强药(如左旋咪唑)及免疫抑制药(如环孢霉素)通过影响免疫机制发挥疗效。某些免疫成份也可直接入药。第50章将有专题介绍。
8.非特异性作用一些药
■[此处缺少一些内容]■
第四节 药物与受体
受体(receptor)是细胞在进化过程中形成的细胞蛋白组分,能识别周围环境中某种微量化学物质,首先与之结合,并通过中介的信息转导与放大系统,触发随后的生理反应或药理效应。自从Langley 提出受体学说100年后,受体已被证实为客观存在的实体,类型繁多,作用机制多已被阐明,现在受体已不再是一个空泛笼统的概念。受体分子在细胞中含量极微,1mg 组织一般只含10fmol左右。能与受体特异性结合的物质称为配体(ligand)。受体仅是一个“感觉器”,对相应配体有极高的识别能力。受体-配体是生命活动中的一种偶合,受体都有其内源性配体,如神经递质、激素、自身活性物(autocoid)等。能激活受体的配体称为激动药(agonist),能阻断其活性的配体称为拮抗药(antagonist)。根据受体与配体结合的高度特异性,受体被分为若干亚型,如肾上腺素受体又分为α1、α2、β1和β2等亚型,其分布及功能都有区别。受体与配体有高度亲和力,多数配体在1pmol~1nmol/L的浓度时即可引起细胞的药理效应。反应之所以如此灵敏主要是靠后续的信息转导系统,如细胞内第二信使(secondmessenger)的放大、分化及整合功能。酶、载体、离子通道及核酸也可与药物直接作用,但这些物质本身具有效应力,故严格地说不应被认为是受体。某些细胞蛋白组分可与配体结合,但没有触发效应的能力,称为结合体(acceptor)。
一、受体动力学
受体动力学一般用放射性同位素标记的配体(L)与受体(R)做结合试验研究。取一定量组织,磨成细胞匀浆,分组加入不同浓度的放射性同位素标记的配体(药物),温孵待反应达平衡后,迅速过滤或离心分出细胞,用缓冲液洗去尚未结合的放射性配体,测定标本的放射强度,这是药物与细胞结合的总量,此后用过量冷配体(未用同位素标记的配体)洗脱特异性与受体结合的放射性配体再测放射强度,这是药物非特性结合量。将总结合量减去非特性结合量就可以获得L-R结合(B)曲线。如果L只与单一R可逆性结合,以B为纵座标,[L]为横座标,L-R结合曲线为直方双曲线(图2-5)。如将横座标改用log[L]([]表示摩尔浓度)则呈典型的S形量效曲线。
按质量作用定律
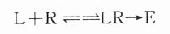
(E代表效应)
反应达到平衡时
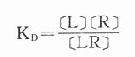
(KD是解离常数)
因为[RT]=[R]+[LR](RT为受体总量),代入上式并经推导得
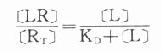
由于只有LR才发挥效应,故效应的相对强弱与LR相对结合量成比例,即
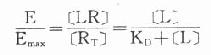
按此公式以E为纵座标,log[L]为横座标作图,结果与实验数据图形完全一致。
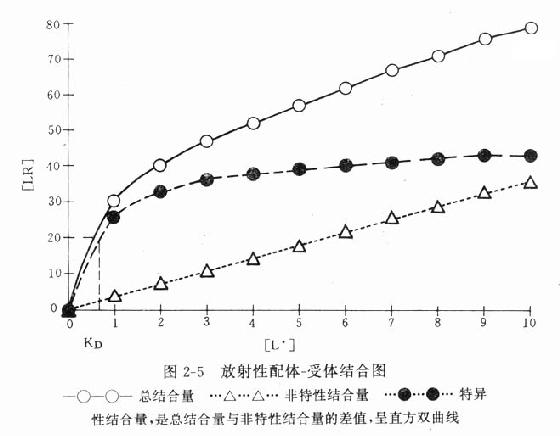
当[L]=0时,效应为0,
当[L]>>KD时,[LR]/[RT]=100%,达最大效能,即[LR]max=[RT]。
当[LR]/[RT]=50%时,即EC50时,KD=[L]。
KD表示L与R的亲和力(affinity),单位为摩尔。各药(L)与R亲和力不同,KD越大时亲和力越小,二者成反比。令pD2=-logKD则其值不必用摩尔单位、数值变小且与亲和力成正比,在半对数座标上也较易理解,故pD2较为常用。
药物与受体结合产生效应不仅要有亲和力,还要有内在活性(intrinsicactivity),后者用α表示,0≤α≤100%。故上述公式应加入这一参数:E/Emax=α[LR]/[RT]。两药亲和力相等时其效应强度取决于内在活性强弱,当内在活性相等时则取决于亲和力大小(图2-6)。
将上述受体动力学基本公式([LR]/[RT]=[L]/KD+[L])加以推导改变可将S形量效曲线改变为直线关系,使计算方便很多也准确很多:
1.双倒数图 将上述基本公式两侧取倒数后加以推导得1/[LR]=KD/[L][RT]+1/[RT]。以1/[LR]为纵座标、1/[L]为横座标作图得直线(图2-7),斜率为KD[RT],即KD/Emax,与纵座标交点为1/[RT],即1/Emax,与横座标交点为-1/KD。
2.Scatchard图 推导得公式[LR]/[L]=[RT]/KD-[LR]/KD以[LR]/[L],为纵座标,[LR]为横座标作图也呈直线(图2-8),斜率为-1/[KD],与纵座标交点为[RT]/KD,与横座标交点为[RT]。
这些直线关系图解在受体研究中有重要用途,也可加深对受体动力学的理解
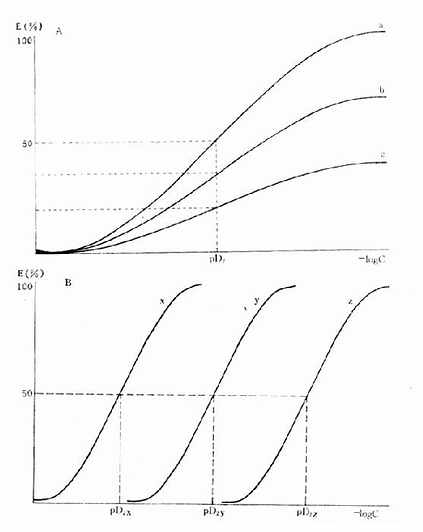
图2-6 药物与受体的亲和力及其内在活性对量效曲线的影响
A图 a,b,c三药与受体的亲和力(pD2)相等,但内在活性(Emax)不等
B图 a,b,c 三药与受体的亲和力(pD2)不等,但内在活性(Emax)相等
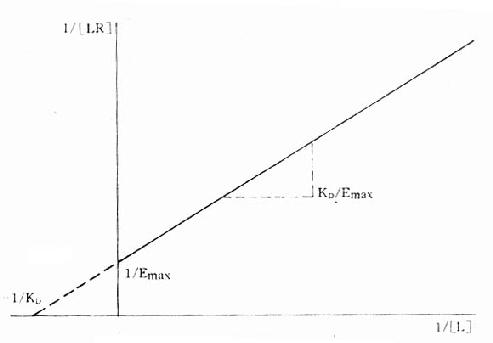
图2-7 受体结合量效关系的双倒数作图
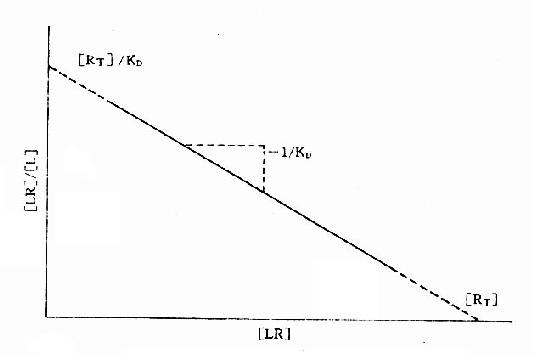
图2-8 受体结合量效关系的Scatchard作图
一些活性高的药物与相应受体结合的量效曲线 (B-log[L]曲线)并不一定与结合后产生效应的量效曲线(E-log[L]曲线)相重合。因为这类药物只需与一部分受体结合就能发挥最大效应(Emax),剩余下未结合的受体为储备受体(spare receptor)。这对理解拮抗药作用机制有重要意义,因为这类拮抗药必须在完全占领储备受体后才能发挥其拮抗效应。
受体激动药(L)对相应受体有较强的亲和力,也有较强的内在活性,α达100%。受体拮抗药(I)虽然也有较强的亲和力,但缺乏内在活性,α=0,本身不能引起效应,却占据一定量受体,拮抗激动药的作用。竞争性拮抗药(competitiveantagonist)能与激动药互相竞争与受体结合,这种结合是可逆性的。在实验中如果L与I同时存在则[RT]=[R]+[LR]+[IR],代入上述基本公式并加推导得
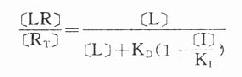
可见L和I同时存在时,如L这一因素固定不变,药理效应大小取决于[i]/K1(K1是I的解离常数)。[i]越高及(或)K1越小时效应越弱,即拮抗效果越强。当[L]>>[i]时,[LR]/[RT]→100%,这就是竞争性拮抗药使量效曲线平行右移(Emax不变)的理论解释(图2-9)。
在有一定量的竞争性拮抗药[i]存在时,增加[L]至[L’]仍可使药理效应维持在原来单用[L]时的水平。据此,
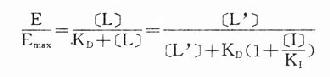
将之推导得
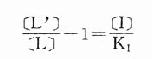
[L’]/[L]是剂量比 (dose ratio),即将[L]增加[L’]/[L]倍就能克服[i]的拮抗作用。该比值也取决于[i]/K1而与[L]绝对值或KD无关。将此公式两侧取log,并以log([L’]/[L]-1)为纵座标、以-log[i]为横座标作图,呈直线,斜率为1,与横座标交点为-logK1,即pA2此即Schild 图(图2-10)。按Schild定义,拮抗参数pAx是指剂量比为X时竞争性拮抗药浓度的负对数值。常用pA2,即[L’]/[L]=2时的数值,则pA2=-log[i]=-logK1,些参数反映拮抗药的拮抗强度,其值越大表示拮抗作用越强。
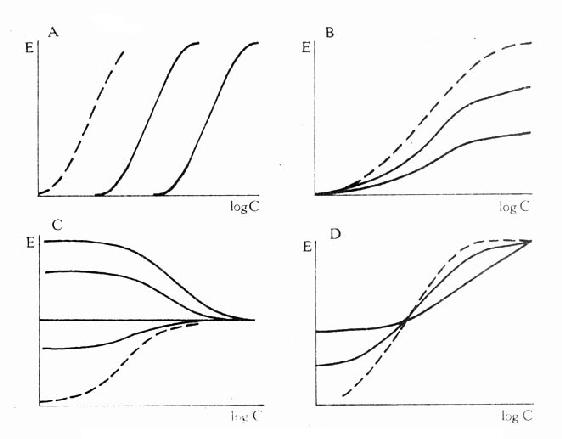
图2-9 竞争性拮抗药(A图)、非竞争性拮抗药(B图)及部分
激动药(D图)对激动药(虚线)量效的影响及激动药(C图)
对部分激动药(虚线)量效曲线的影响
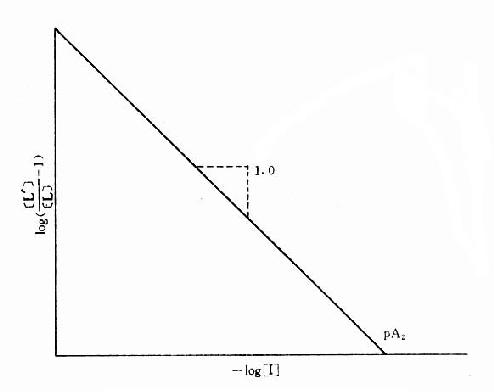
图2-10 竞争性拮抗作用的Schild作图
非竞争性拮抗药(noncompetitiveantagonist)与R结合非常牢固,分解很慢或是不可逆转,使能与L结合的R数量减少。另一类非竞争性拮抗药可阻断受体后某一中介反应环节而使受体-效应功能容量减少。二者共同特点是使量效曲线高度(Emax)下降。但L与剩余的R结合动力学不变,即KD不变。在双倒数图中更易看出这一关系(图2-11)。
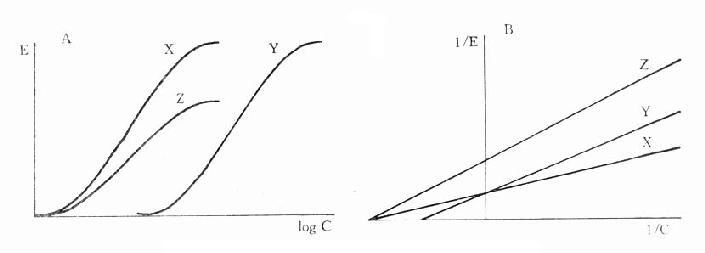
图2-11 竞争性拮抗作用与非竞争性拮抗作用比较
A图 量效曲线 B图 双倒数曲线
X 单用激动药 Y 竞争性拮抗药对激动药的拮抗作用
Z 非竞争性拮抗药对激动药的拮抗作用
还有一类药物称为部分激动药(partialagonist)和R结合的亲和力不小,但内在活性有限,α>Km时,Km可略去不计,ds/dt=Vmax,即酶以其最大速度催化。零级动力学公式与此一致,说明当体内药物过多时,机体只能以最大能力将体内药物消除。消除速度与C高低无关,因此是恒速消除。例如饮酒过量时,一般常人只能以每小时10ml乙醇恒速消除。当血药浓度下降至最大消除能力以下时,则按一级动力学消除。
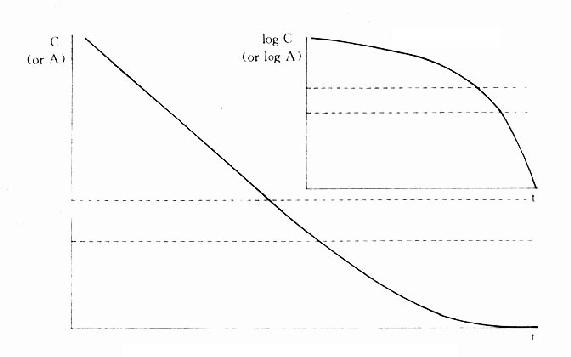
图3-6 药物在体内消除过程的时量曲线
体内药物过多,超过机体最大消除能力(虚线)时为零级动力学恒速消除
体内药物降至虚线以下时为一级动力学恒比消除。插图纵坐标为对数标尺
二、一级消除动力学
当n=1时,-dC/dt=keC1=keC,式中k用ke表示消除速率常数 (elimination rate constant)。将上式积分得

可见按一级动力学消除的药物半衰期与C高低无关,是恒定值。体内药物按瞬时血药浓度(或体内药量)以恒定的百分比消除,单位时间内实际消除的药量随时间递减。消除速率常数(ke)的单位是h-1,它不表示单位时间内消除的实际药量,而是体内药物瞬时消除的百分率。例如ke=0.5h-1不是说每小时消除50%(如果t1/2=1小时则表示每小时消除50%)。按t1/2=0.693/ke计算t1/2=1.39h,即需1.39h后才消除50%。再按 计算,1小时后体内尚存60.7%。绝大多数药物都按一级动力学消除。这些药物在体内经过t时后尚存

当n=5时,At≈3%A,即经过5个t1/2后体内药物已基本消除干净。与此相似,如果每隔一个t1/2给药一次(A),则体内药量(或血药浓度)逐渐累积,经过5个t1/2后,消除速度与给药速度相等,达到稳态(steady state):
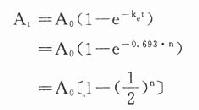
当n=5时,At≈97%A。这一时间,即5个t1/2不因给药剂量多少而改变。具体数值见表3-2。
药物自体内消除的一个重要指标是血浆清除率(plasmaclearance,Cl),是肝肾等的药物消除率的总和,即单位时间内多少容积血浆中的药物被消除干净,单位用L·h-1(也有人用ml·min-1,和肌酐消除率一致)或按体重计算 L·kg-1·h-1。按定义,CL=RE/Cp,RE是消除速率(rate of elimination),即单位时间内被机体消除的药量,Cp为当时的血浆药物浓度。由于RE非固定值也不易检测,故常用表观分布容积(apparent volume ofdistribution, Vd)计算。 Vd是指静脉注射一定量(A)药物待分布平衡后,按测得的血浆浓度计算该药应占有的血浆容积。事实上静注药物后未待分布平衡已有部分药物自尿排泄及(或)在肝转化而消除,故必需多次检测Cp,作时量曲线图,将稳定下降的消除段向O时延升至和Y轴交点以求得理论上静注药量A在体内分布平衡时的血浆浓度C,以此算出Vd=A/C(图3-7)。按RE=keA,Cp=A/Vd,故Cl=keVd。在一级动力学的药物中,Vd及Cl是两个独立的药动学指标,各有其固定的数值,互不影响,也不因剂量大小而改变其数值。Vd是表观数值,不是实际的体液间隔大小。除少数不能透出血管的大分子药物外,多数药物的Vd值均大于血浆容积。与组织亲和力大的脂溶性药物其Vd可能比实际体重的容积还大。Cl也不是药物的实际排泄量。它反映肝和(或)肾功能,在肝和(肾)功能不足时Cl值会下降,因为Cl是肝肾等消除能力的总和。肝清除率虽然难测,但有重要的理论意义。肝清除率小的药物,首关消除少,其口服生物利用度大,但易受肝功能,血浆蛋白结合力及肝药酶诱导或抑制药的影响。肝清除率大的药物,首关消除多,其口服生物利用度小。有些药物的肝清除率很高,接近肝血流量,称为灌流限制性清除,其肝清除率受肝血流量影响较大。药物以原形自肾消除的百分率比较容易测定。自肾排泄多的药物易受肾功能影响,自肾排泄少的药物易受肝功能影响。医生可以据此在肝或肾功能不足病人适当调整剂量。在零级动力学的药物中,RE以恒速消除,不随Cp下降而改变,故Cl 值不固定,与Cp成反比。
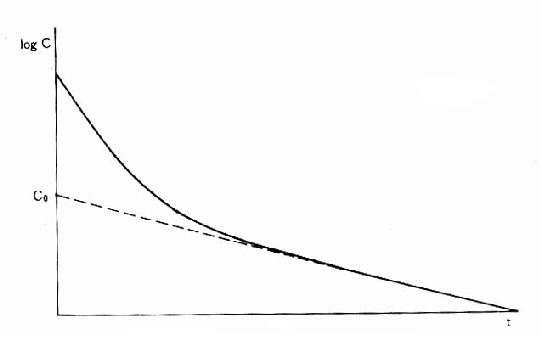
图3-7 表观分布容积计算法
C是静注药量A在0时理论上的血药浓度
Cl值实际上常用静脉或肌肉注射药物A后测定Cp,绘出时量曲线,算出AUC再按CL=A/AUC取得。因为AUC=C/ke,代入得
CL=keVd=CVd/AUC=A/AUC。
三、连续恒速给药
临床治疗常需连续给药以维持有效血药浓度。在一级动力学药物中,开始恒速给药时药物吸收快于药物消除,体内药物蓄积。按 计算约需5个t1/2达到血药稳态浓度(Css)(图3-8),此时给药速度(RA)与消除速度(RE)相等。
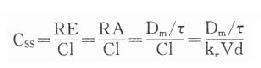 (τ为给药间隔时间)可见Css随给药速度(RA=Dm/τ)快慢而升降,到达Css时间不因给药速度加快而提前,它取决于药物的ke或t1/2。据此,可以用药物的keVd或Cl计算给药速度以达到所需的有效药物浓度。静脉恒速滴注时血药浓度可以平稳地到达Css。分次给药虽然平均血药浓度上升与静脉滴注相同,但实际上血药浓度上下波动(图3-8)。分药间隔时间越长波动越大,其峰值浓度
(τ为给药间隔时间)可见Css随给药速度(RA=Dm/τ)快慢而升降,到达Css时间不因给药速度加快而提前,它取决于药物的ke或t1/2。据此,可以用药物的keVd或Cl计算给药速度以达到所需的有效药物浓度。静脉恒速滴注时血药浓度可以平稳地到达Css。分次给药虽然平均血药浓度上升与静脉滴注相同,但实际上血药浓度上下波动(图3-8)。分药间隔时间越长波动越大,其峰值浓度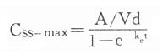 ,谷值浓度 Css-min=Css- maxe 。如果实际Css过高或过低,可以按已达到的Css与需要达到的Css比值调整给药速度,即Css(已达到的)/Css(需要的)=RA(现用的)/RA(将调整的)
,谷值浓度 Css-min=Css- maxe 。如果实际Css过高或过低,可以按已达到的Css与需要达到的Css比值调整给药速度,即Css(已达到的)/Css(需要的)=RA(现用的)/RA(将调整的)
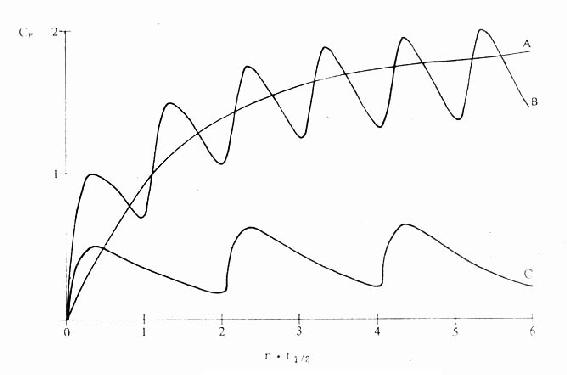
图3-8 连续恒速给药时的时量曲线
约经5个半衰期血药浓度达到稳态。给药间隔越短,
血药浓度波动越小。给药剂量越大,血药浓度越高
A.静脉滴注,Dm/t1/2B.肌肉注射,Dm/t1/2C.肌肉注射,1/2Dm/2t1/2。Dm维持剂量
但从调整剂量时开始需再经过5个t1/2方能达到需要的Css。
在病情危重需要立即达到有效血药浓度时,可于开始给药时采用负荷剂量(loading dose,D1),因为
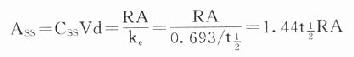
Ass就是负荷剂量。可将第一个t1/2内静脉滴注量的1.44倍在静脉滴注开始时推注入静脉即可立即达到并维持Css。在分次恒速给药达到Css时,体内Ass是维持剂量(maintenance dose, Dm)与体内上一剂量残留药物的和,即

当给药间隔时间τ=t1/2时,

即每隔一个t1/2给药一次时采用首剂加倍剂量的D1可使血药浓度迅速达到Css。
理想的给药方案应该是使CSS- max略小于最小中毒血浆浓度(MTC)而CSS-min略大于最小有效血浆浓度(MEC),即血药浓度波动于MTC与MEC之间治疗窗,这一Dm可按下列公式计算:
Dm=(MTC - MEC)Vd
负荷剂量计算法与上同,即D1=ASS=1.44t1/2 RA=1.44t1/2 Dm/τ,τ为给药间隔时间。τ可按一级消除动力学公式推算得
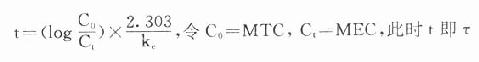
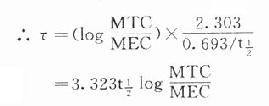
因此可以根据药物的MTC及MEC利用这些公式计算出D1,Dm及τ。注意此时τ≠t1/2,D1≠2Dm(图3-9)。
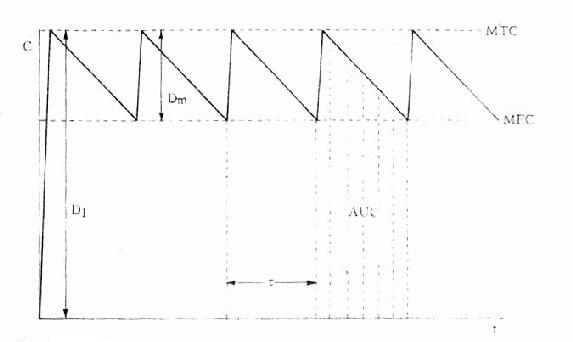
图3-9 负荷剂量、维持剂量、给药间隔与血药浓度关系
Dm维持剂量所形成的C D1负荷剂量所形成的C
在零级动力学药物中,体内药量超过机体最大消除能力。如果连续恒速给药,RA>RE,体内药量蓄积,血药浓度将无限增高。停药后消除时间也较长,超过5个t1/2。因为t1/2=0.5C0/K,达到C0越高t1/2越长。
临床用药可根据药动学参数如Vd、Cl、ke、t1/2及AUC等按以上各公式计算剂量及设计给药方案以达到并维持有效血药浓度。除了少数t1/2特长或特短的药物,或零级动力学药物外,一般可采用每一个半衰期给于半个有效量(half dose athalf life interval)并将首次剂量加倍是有效、安全、快速的给药方法。
有些药在体内转化为活性产物则需注意此活性产物的药动学,如果活性产物的消除是药物消除的限速步骤的话,则应按该产物的药动学参数计算剂量及设计给药方案。
四、一级药动学指标间的相互关系
1.F=A/D×100%口服剂量(D)由于不能100%吸收及存在首关消除效应,能进入体循环的药量(A)只占D的一部分,这就是生物利用度(F)。药动学计算时应采用绝对生物利用度,相对生物利用度作为评比药物制剂质量的指标。生物利用度还包括吸收速度问题,达峰时间(Tpeak)是一个参考指标。
2.A=C·Vd或C=A/Vd体内药量(A)与血药浓度(C)比值固定,在许多药动学公式中,A与C可以通用,如At=也可用Ct=。
3.Cp=[D]+[DP] 血浆中药物有游离型(D)与血浆蛋白结合型(DP),定量测定时需将血浆蛋白沉淀除去,故通常所说的血浆药物浓度(Cp)是指[D]与[DP]的总和。只有透析法或超离心法才可能将二者分离以计算药物的血浆蛋白结合率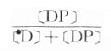 ×100% 。
×100% 。
4.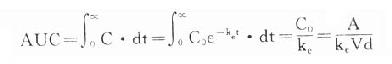 曲线下面积(AUC)是一个可用实验方法测定的药动学指标。它反映进入体循环药量的多少。时量曲线某一时间区段下的AUC反映该时间内的体内药量。AUC是独立于房室模型的药动学参数,常用于估算血浆清除率(Cl)。
曲线下面积(AUC)是一个可用实验方法测定的药动学指标。它反映进入体循环药量的多少。时量曲线某一时间区段下的AUC反映该时间内的体内药量。AUC是独立于房室模型的药动学参数,常用于估算血浆清除率(Cl)。
5.ke=0.693/t1/2=RE/A=CL/Vd消除速率常数是药物瞬时消除的百分率而不是单位时间药物消除速率(RE),是决定t1/2的参数,但其本身又取决于Cl及Vd,故不是独立的药动学指标。
6.Vd=A/C0=A/AUC ke 表现分布容积(Vd)是独立的药动学指标,不是实际的体液容积,取决于药物在体液的分布。Vd大的药物与组织蛋白结合多,主要分布于细胞内液及组织间液。Vd小的药物与血浆蛋白结合多,较集中于血浆。Vd不因A多少而变化。
7.CL=keVd=RE/Cp=A/AUC 血浆清除率(Cl)是肝肾等清除率的总和,也不是实际的药物消除速率(RE),是另一个独立于A的重要药动学指标,但受肝肾功能的影响。
8.t1/2=0.693/ke=0.693Vd/CL 血浆药物消除半衰期(t1/2)是一个非常实用的药动学指标,虽然独立于A,但受Cl及Vd双重制约,Cl大时t1/2短,Vd大时t1/2长。例如庆大霉素Cl小(60ml·min-1),Vd也小(0.25L·kg-1),其t1/2不长(2~3h)。氯喹Cl大(700ml·min-1),Vd也大(185L·kg-1),其t1/2并不短(8天)。药物在吸收及分布过程中也有半衰期,分别用t1/2a及t1/2α表示。
9.稳态时RA=RE=CSS·Cl=CSS·Vd·ke
故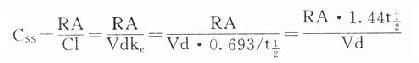 CSS是恒速连续给药达到稳态时平均血药浓度,应该和预期的有效浓度相等。必要时可以按达到的CSS与预期的CSS比值调整剂量或给药速度(RA)。
CSS是恒速连续给药达到稳态时平均血药浓度,应该和预期的有效浓度相等。必要时可以按达到的CSS与预期的CSS比值调整剂量或给药速度(RA)。
10. 分次定时定量给药时,CSS上下波动。当每t1/2给药一次时,其峰值(CSS- max)与谷值(CSS- min)的比值为2,缩短给药间隔可以减少CSS波动。
分次定时定量给药时,CSS上下波动。当每t1/2给药一次时,其峰值(CSS- max)与谷值(CSS- min)的比值为2,缩短给药间隔可以减少CSS波动。
11.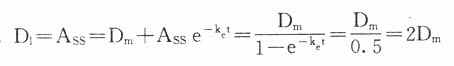 每t1/2给药一次时,首次给予加倍剂量,即负荷剂量(D1)可以立即达到CSS。
每t1/2给药一次时,首次给予加倍剂量,即负荷剂量(D1)可以立即达到CSS。
五、房室模型
以上所述各种药动学公式都是将机体视为一个整体空间,假设药物在其中转运迅速,瞬时达到分布平衡的条件下推导而得的。实际上机体绝非如此简单,不仅有血浆、细胞外液及细胞内液等间隔,而且各组织细胞间存在着无数的区间。静脉注射药物的时量(对数标尺)关系并非直线,而是一条由无数区段组成的连续弧线。粗略地看可见早期一段快速下降,后来才逐渐稳定缓慢下降。这是因为药物进入血液循环后快速向组织分布,首先进入血注量大的肺、肾、心、脑等器官,然后再向其他组织分布,最后达到平衡(假平衡)。因此设想机体由几个互相连通的房室(compartment)组成。这个房室不是解剖学上分隔体液的房室,而是按药物分布速度以数学方法划分的药动学概念。多数药物按二房室模型转运(少数单房室或多房室),中央室大致包括血浆及那些血流量多的器官,周边室包括机体其余部分,界限并不明确。时量曲线因此也只能大致分为分布相及消除相两个指数衰减区段(图3-10)。其药动学规律与单房室不同,如C=Ae-αt +Be-βt,α及β分别为分布相(A)及消除相(B)的消除速率常数。而且在分布相中Vd逐渐增大,ke(α)逐渐减少,t1/2逐渐延长,因此药动学计算需要特殊处理。即使在消除相,血药浓度稳定线性下降,各组织浓度及其下降速度也不尽相等,故称假平衡。可见问题非常复杂。
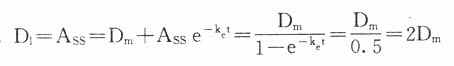
图3-10 二房室模型时量曲线
A.分布相(实线)及分布曲线(虚线)
B.消除相(实线)与消除曲线(虚线)
正由于问题过于复杂,临床应用诸多不便,实际运算也存在诸多困难。房室模型并非药物固有的药动学指标,机体也无此解剖学间隔,即使运用电子计算机拟合也不一定获得明确的划分。用同一药物试验,在某些人呈二室模型,另些人可能呈一室或三室模型。同一药物静脉注射时呈二室模型而口服则呈单一房室模型。在分布相时药物实际上已开始消除,到达消除相时可能已有相当分量的药物已被消除。如果用血管外给药(口服、肌注等)分布相常被吸收相掩盖。这些时相的划分仅靠血药浓度的测定。如果早期(此时血药浓度变化较快)取样间隔过疏,很难据此准确划分时相,因此,越来越多的临床家及研究者逐渐放弃房室模型而转向采用适用于所有药物的无房室方法(noncompartmentalmedtod)来解决实际问题,对此,有待今后深入学习。
从另一方面看,时量曲线在达到假平衡后已呈单一指数衰减的直线,此时房室划分已无需要,可以按β值计算t1/2及其他实用的药动学指标。
AUC是与房室无关的药动学指标,可用实验方法测定。AUC(0-∞)=C/ke,或AUC(T-∞)=CT/β,T是消除相开始的时间。再用AUC算出Vd及Cl:
Vd=A/AUCβ,CL=A/AUC
第四章 影响药物效应的因素及合理用药原则
同样剂量的某一药物在不同病人不一定都能达到相等的血药浓度,相等的血药浓度也不一定都能达到等同的药效。差异可能很大,甚至出现质的差异,即一般病人不会出现的异常危害性反应。这种随人而异的药物反应称为个体差异(inpidual variation)。产生个体差异的原因可以存在于药物产生效应的任何一个环节,包括药物剂型、药动学、药效学及临床病理等许多因素。如果不了解这些因素,不结合病人具体情况,不考虑如何加以调整,就难以达到最大疗效和最小反应的治疗目的。
第一节 药物方面的因素
一、药物剂型
同一药物可有不同剂型适用于不同给药途径。不同给药途径药物的吸收速度不同,一般规律是静脉注射>(快于)吸入>肌肉注射>皮下注射>口服>经肛>贴皮。不同药剂所含的药量虽然相等,即药剂当量(pharmaceutical equivalance) 相同,药效强度不尽相等。因此需要用生物当量(bioequivalance),即药物不同制剂能达到相同血药浓度的剂量比值,作为比较标准。不同药物剂型,其中药物剂量不同,应用时亦应注意区分选择。硝酸甘油静脉注射5~10μg,舌下含锭0.2~0.4mg,口服2.5~5mg,贴皮10mg,剂量相差更大。近年来生物药学随着药动学的发展,为临床用药提供了许多新的剂型。缓释制剂(slow release preparation)利用无药理活性的基质或包衣阻止药物迅速溶出以达到比较稳定而持久的疗效。口服缓释片剂或胶囊每日一次可维持有效血药浓度一天。肠外给药除一般油溶长效注射剂外还有控释制剂(controlled release preparation)可以控制药物按零级动力学恒速释放,恒速吸收。例如硝酸甘油贴皮剂每日贴一次。匹鲁卡品眼片置结膜囊内每周一次。子宫内避孕剂每年放置一次。不仅保证长期疗效,也大大方便了病人。
二、联合用药及药物相互作用
临床常联合应用两种或两种以上药物,除达到多种治疗目的外都是利用药物间的协同作用(synergism)以增加疗效或利用拮抗作用(antagonism)以减少不良反应。不恰当的联合用药往往由于药物间相互作用(interaction)而使疗效降低或出现意外的毒性反应。固定剂量比例的复方制剂虽然应用方便,但针对性不强,较难解决个体差异问题。
1.配伍禁忌(incompatibility)
药物在体外配伍直接发生物理性的或化学性的相互作用而影响药物疗效或毒性反应称为配伍禁忌。在静脉滴注时尤应注意配伍禁忌。
2.影响药动学的相互作用
⑴吸收:空腹服药吸收较快,饭后服药吸收较平稳。促进胃排空的药如甲氧氯普胺能加速药物吸收,抑制胃排空药如各种具有抗M胆碱作用药物能延缓药物吸收。对于吸收缓慢的灰黄霉素加快胃排空反而减少其吸收,而在胃中易被破坏的左旋多巴减慢胃排空反而使吸收减少。食物对药物吸收总的来说影响不大,因此基本上没有特异性禁忌。药物间相互作用影响吸收却不少见,如四环素Fe2+,Ca2+等因络合互相影响吸收。
⑵血浆蛋白结合:对于那些与血浆蛋白结合率高的、分布容积小的、安全范围窄的及消除半衰期较长的药物易受其他药物置换与血浆蛋白结合而致作用加强,如香豆素类抗凝药及口服降血糖药易受阿司匹林等解热止痛药置换而分别产生出血及低血糖反应。
⑶肝脏生物转化:肝药酶诱导药如苯巴比妥、利福平、苯妥英及香烟、酒等能增加在肝转化药物的消除而使药效减弱。肝药酶抑制药如异烟肼、氯霉素、西米替丁等能减慢在肝转化药物的消除而使药效加强。
⑷肾排泄:利用离子障原理,碱化尿液可加速酸性药物自肾排泄,减慢碱性药物自肾排泄。反之,酸化尿液可加速碱性药物排泄,减慢酸性药物排泄已如前述(第三章第一节,四)。水杨酸盐竞争性抑制甲氨蝶呤自肾小管排泄而增加后者的毒性反应。
3.影响药效学的相互作用
⑴生理性拮抗或协同:服用催眠镇静药后饮酒或喝浓茶或咖啡会加重或减轻中枢抑制作用,影响疗效。抗凝血药华法林和抗血小板药阿司匹林合用可能导致出血反应。
⑵受体水平的协同与拮抗:许多抗组胺药,酚噻嗪类,三环抗抑郁药类都有抗M胆碱作用,如与阿托品合用可能引起精神错乱,记忆紊乱等不良反应,β-受体阻断药与肾上腺素合用可能导致高血压危象等,都是非常危险的反应。
⑶干扰神经递质的转运:三环类抗抑郁药抑制儿茶酚胺再摄取,可增加肾上腺素及其拟似药如酪胺等的升压反应,而抑制可乐定及甲基多巴的中枢降压作用。由于药物相互作用而影响药物效应的实例不胜枚举,已有多本专著出版,在国外还有电脑检索系统,在此仅举例说明相互作用机制,目的在于引起警惕。
第二节 机体方面的因素
一、年龄
1.小儿特别是新生儿与早产儿,各种生理功能,包括自身调节功能尚未充分发育,与成年人有巨大差别,对药物的反应一般比较敏感。新药批准上市不需要小儿临床治疗资料,缺少小儿的药动学数据,这是主要困难。新生儿体液占体重比例较大,水盐转换率较快;血浆蛋白总量较少,药物血浆蛋白结合率较低;肝肾功能尚未充分发育,药物清除率低,在半岁以内与成人相差很多;小儿的体力与智力都处于迅速发育阶段,易受药物影响等都应引起用药注意,予以充分考虑。例如新生儿肝脏葡萄糖醛酸结合能力尚未发育,应用氯霉素或吗啡将分别导致灰婴综合征及呼吸抑制。新生儿肾功能只有成人的20%,庆大霉素的血浆半衰期长达18h,为成人(2h)的9倍。中枢兴奋药安非他明在小儿科却用于治疗学龄儿童多动症,作用性质也有所改变,儿童服用同化激素影响长骨发育,服用四环素可使牙齿变灰褐色。
2.老人老人实际年龄与其生理年龄并不一致,即老人生理功能衰退的迟早快慢各人不同,因此没有按老人年龄计算用药剂量的公式,也没有绝对的年龄划分界线,在医学方面一般以65岁以上为老人。老人对药物的吸收变化不大。老人血浆蛋白量较低,体水较少、脂肪较多、故药物血浆蛋白结合率偏低,水溶性药物分布容积较小而脂溶性药物分布容积较大。肝肾功能随年龄增长而自然衰退,故药物清除率逐年下降,各种药物血浆半衰期都有程度不同的延长,例如在肝灭活的地西泮可自常人的20~24h延长4倍。又如自肾排泄的氨基甙类抗生素可延长2倍以上。以药效学方面,老人对许多药物反应特别敏感,例如中枢神经药物易致精神错乱,心血管药易致血压下降及心律失常,非甾体抗炎药易致胃肠出血,抗M胆碱药易致尿潴留、大便秘结及青光眼发作等。
二、性别
除大白鼠外,一般动物对药物反应的性别差异不大,男人对醋氨酚及阿司匹林的清除率分别高于妇女40%及60%。妇女月经期不宜服用峻泻药和抗凝药以免盆腔充血月经增多。50年代末期在西欧因孕妇服用反应停(沙利度胺,催眠镇静药)而生产了一万余例海豹畸形婴儿的悲惨结果引起了对孕妇用药的警惕。对于已知的致畸药物如锂盐、酒精、华法林、苯妥英及性激素等在妊娠第一期胎儿器官发育期内应严格禁用。此后,在妊娠晚期及授乳期间还应考虑药物通过胎盘及乳汁对胎儿及婴儿发育的影响,因为胎盘及乳腺对药物都没有屏障作用。孕妇本身对药反应也有其特殊情况需要注意,例如抗癫痫药物产前宜适当增量,产前还应禁用阿司匹林及影响子宫肌肉收缩的药物。
三、遗传异常
先天性遗传异常(geneticpolymorphism) 对药物效应的影响近年来日益受到重视,至少已有一百余种与药物效应有关遗传异常基因被发现。过去所谓的特异体质(idiosyncrasy)药物反应多数已从遗传异常表型获得解释,现在已形成一个独立的药理学分支──遗传药理学(geneticpharmacology) 。遗传异常主要表现在对药物体内转化的异常,可分为快代谢型(extensivemetabolizer, EM) 及慢代谢型(poormetabolizer, PM) 。前者使药物快速灭活,后者使药物灭活较缓慢,因此影响药物血浆浓度及效应强弱久暂。又如6-磷酸葡萄糖脱氢酶(G6PD)缺乏者对伯氨喹,磺胺药、砜类等药物易发生溶血反应。这两种遗传异常的人在我国都不鲜见,这些遗传异常只有在受到药物激发时方出现异常,故不是遗传性疾病。
四、病理情况
疾病的严重度固然与药物疗效有关,同时存在的其他疾病也会影响药物的疗效。肝肾功能不足时分别影响在肝转化及自肾排泄药物的清除率,可以适当延长给药间隔及(或)减少剂量加以解决。神经功能抑制时,如巴比妥类中毒时能耐受较大剂量中枢兴奋药而不致惊厥,惊厥时却能耐受较大剂量苯巴比妥。此外要注意患者有无潜在性疾病影响药物疗效,例如氯丙嗪诱发癫痫,非甾体抗炎药激活溃疡病,氢氯噻嗪加重糖尿病,抗M胆碱药诱发青光眼等。在抗菌治疗时白细胞缺乏、未引流的脓疡、糖尿病等都会影响疗效。
五、心理因素
患者的精神状态与药物疗效关系密切,安慰剂(placebo)是不具药理活性的剂型(如含乳糖或淀粉的片剂或含盐水的注射剂),对于头痛、心绞痛、手术后痛、感冒咳嗽、神经官能症等能获得30%~50%的疗效就是通过心理因素取得的。安慰剂对心理因素控制的自主神经系统功能影响较大,如血压、心率、胃分泌、呕吐、性功能等。它在病人信心不足时还会引起不良反应。安慰剂在新药临床研究时双盲对照中极其重要,可用以排除假阳性疗效或假阳性不良反应。安慰剂对任何病人都可能取得阳性效果,因此医生不可能单用安慰剂作出真病或假病(心理病)的鉴别诊断。医生的任何医疗活动,包括一言一行等服务态度都可能发挥安慰剂作用,要充分利用这一效应。但医生不应利用安慰剂去敷衍或欺骗病人,因为这样会延误疾病的诊治并可能破坏病人对医生的信心。对于情绪不佳的病人尤应多加注意,氯丙嗪,利血平,肾上腺皮质激素及一些中枢抑制性药物在抑郁病人可能引发悲观厌世倾向,用药时应慎重。
六、机体对药物反应的变化
■[此处缺少一些内容]■
(addiction)。由于习惯及成瘾性都有主观需要连续用药,故统称依赖性(dependence) 。药物滥用(drugabuse) 是指无病情根据的大量长期的自我用药,是造成依赖性的原因。麻醉药品的滥用不仅对用药者危害极大,对社会危害也大。吗啡,可卡因,印度大麻及其同类药都属于麻醉药品。苯丙胺类、巴比妥类,苯二氮 类等亦被列入国际管制的成瘾性精神药物。
类等亦被列入国际管制的成瘾性精神药物。
4.耐药性 病原体及肿瘤细胞等对化学治疗药物敏感性降低称为耐药性(drugresistance),也称抗药性。有些细菌还可对某些抗生素产生依药性(dependence)。在抗癌化学治疗中也有类似的抗药性问题。
第三节 合理用药原则
怎样才算合理用药现尚缺一具体标准,对某一疾病也没有统一的治疗方案。由于药物的有限性,即品种有限及疗效有限,和疾病的无限性,即疾病种类无限及严重度无限,因此不能简单以疾病是否治愈作为判断用药是否合理的标准。从理论上说合理用药是要求充分发挥药物的疗效而避免或减少可能发生的不良反应。当然这也不够具体,因此只能提几条原则供临床用药参考。
1.明确诊断选药不仅要针对适应证还要排除禁忌证。
2.而且容易发生相互作用。
3.了解并掌握各种影响药效的因素用药必须个体化,不能单纯公式化。
4.祛邪扶正并举在采用对因治疗的同时要采用对症支持疗法。这在细菌感染及癌肿化学治疗中尤其不应忽视。
5.对病人始终负责开出处方仅是治疗的开始,必需严密观察病情反应,及时调整剂量或更换治疗药物。要认真分析每一病例的成功及失败的关键因素,总结经验教训,不断提高医疗质量,使用药技术更趋合理化。
第五章 传出神经系统药理概论
传出神经系统包括植物神经系统和运动神经系统。植物神经系统(vegetativenervous system)也称自主神经系统(autonomicnervous system),主要支配心肌、平滑肌和腺体等效应器;运动神经系统则支配骨骼肌。
自主神经系统排除传出神经外,尚包括内脏传入感觉神经,然对后者的生理和药理研究不多。国外文献沿用自主神经药理一词,实际上主要指传出而不包括传入神经药理。此外,自主神经系统不应包括运动神经,但运动神经系统的递质和受体与植物神经系统同属一个体系,而传出神经系统药理一词自可将这两类都概括进来。因此,我国沿用传出神经系统药理一词较为合理。
植物神经自中枢神经系统发出后,都要经过神经节中的突触,更换神经元,然后才达到效应器(effector)。因此,植物神经有节前纤维和节后纤维之分(图5-1,5-2)。
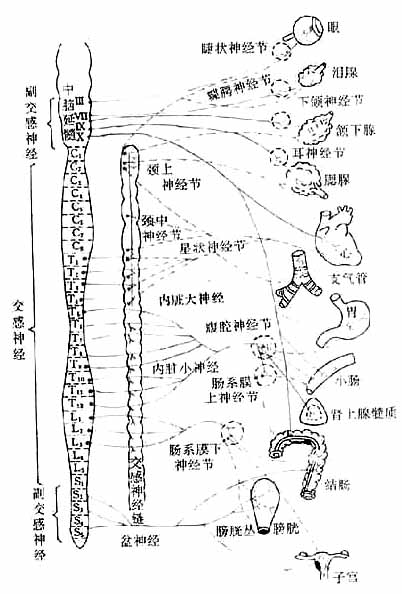
图5-1 植物神经系统分布示意图
神经纤维:蓝色:胆碱能神经 实线:节前纤维
红色:去甲肾上腺素能神经 虚线:节后纤维
运动神经自中枢发出后,中途不更换神经元,直接达到骨骼肌,因此无节前和节后纤维之分。
一、传出神经系统的递质及受体
当神经冲动达到神经末梢时,在突触部位从末梢释放出化学传递物,称为递质(transmitter)。通过递质作用于次一级神经元或效应器的受体(receptor),发生效应,从而完成神经冲动的传递过程。作用于传出神经系统的药物主要是在突触部位影响递质或受体而发挥作用。
(一)传出神经系统的递质
1.递质学说的发展 1921年Loewi通过动物实验证明递质的存在。实验是用两个离体蛙心进行,当刺激甲蛙心的迷走交感神经干以引起迷走神经兴奋时,甲蛙心受到抑制,这时将甲蛙心的灌注液注入乙蛙心,则乙蛙心也表现出抑制。这就说明甲蛙心迷走神经兴奋时,必定释出一种抑制性物质,才能使乙蛙心也受到抑制。后来证明这种物质就是乙酰胆碱。此后相继发现神经节中的节前纤维末梢和运动神经末梢兴奋时,都能释放乙酰胆碱。本世纪四十年代,通过von Euler的工作证明交感神经节后纤维的神经递质是去甲肾上腺素。至此,传出神经系统的化学传递学说才臻完善。
2.传出神经突触的超微结构突触中神经末梢与效应器细胞或次一级神经元间有一定的间隙,称突触间隙。传出神经末梢邻近间隙的细胞膜称为突触前膜;效应器或次一级神经元邻近间隙的细胞膜称为突触后膜。在运动神经与骨骼肌的接头(也称终板),这个间隙约为15~20nm;终板的突触后膜有许多皱褶,其中聚集着胆碱酯酶,能迅速水解已释放的乙酰胆碱。在神经末梢内靠近突触前膜处,聚集着很多直径为20~50nm的囊泡(vesicle),囊泡内含有大量递质乙酰胆碱。
交感神经末梢分成许多细微的神经纤维,分布于平滑肌细胞之间。这些细微神经纤维都有稀疏串珠状的膨胀部分,称为膨体(varicosity)。膨体中含有线粒体和囊泡等亚细胞结构,一个膨体内囊泡的数目约在1000个左右。囊泡内含有高浓度的去甲肾上腺素。
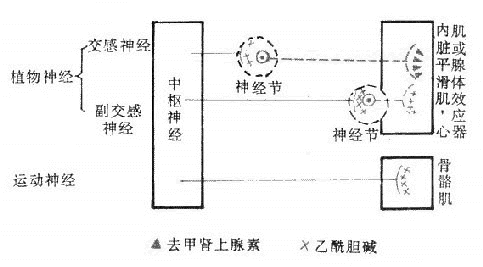
图5-2 传出神经分类模式图
蓝色:胆碱能神经 实线:节前纤维
红色:去甲肾上腺素能神经 虚线:节后纤维
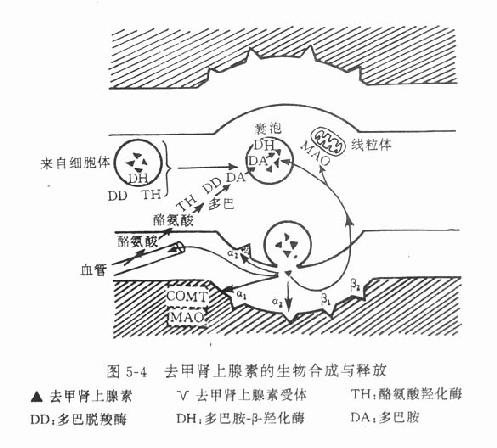
去甲肾上腺素能神经内的囊泡有大小之分,大囊泡在神经节细胞内形成,以每小时数mm的速度沿轴突向末梢运行;小囊泡主要在神经末梢形成。运行到末梢的还有合成去甲肾上腺素所必需的酶,如酪氨酸羟化酶、多巴脱羧酶和多巴胺β-羟化酶等,后者存在于囊泡内;前二者存在于胞质液中。
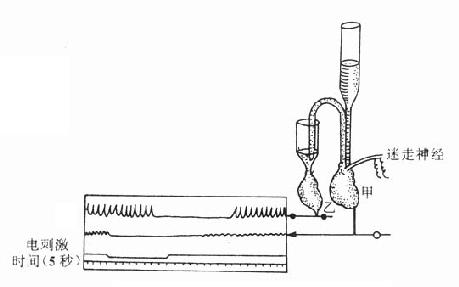
图5-3 证明迷走神经兴奋时释放递质的双蛙心实验
3.递质的生物合成与贮存 去甲肾上腺素的生物合成在去甲肾上腺素能神经细胞体内和轴突中即开始进行,不过在此含量较少,愈到神经末梢,含量愈多,末梢内的含量约为细胞体内的3~300倍。酪氨酸从血液进入神经元后,在酪氨酸羟化酶催化下生成多巴(dopa)再经多巴脱羧酶的催化,脱羧后生成多巴胺(dopamine),后者进入囊泡中,经多巴胺β-羟化酶的催化,转变为去甲肾上腺素。酪氨酸羟化酶的活性较低,反应速度慢,底物要求专一,当胞浆中多巴胺或游离的去甲肾上腺素浓度增高时,对该酶有反馈性抑制作用,反之,当胞浆中多巴胺或去甲肾上腺素浓度降低时,对该酶的抑制作用减弱,催化反应则加速,故这一步骤是去甲肾上腺素生物合成过程的限速因素,是调节去甲肾上腺素生物合成的重要环节。去甲肾上腺素形成后,与ATP的嗜铬颗粒蛋白结合,贮存于囊泡中(图5-4),并可避免被胞质液中的单胺氧化酶(MAO)所破坏。
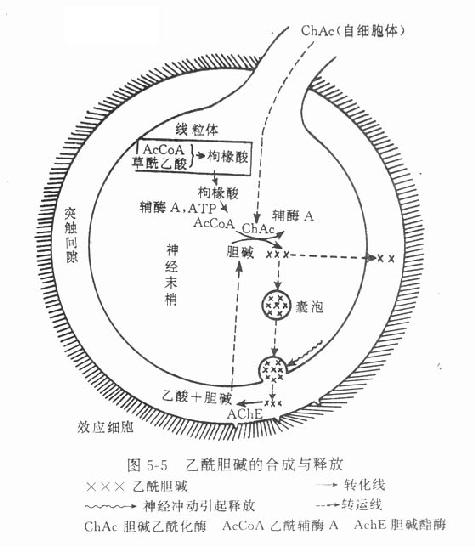
乙酰胆碱主要在胆碱能神经末梢形成,与其合成有关的酶和辅酶有胆碱乙酰化酶(cholineacetylase)和乙酰辅酶A(acetyl coenzyme A)。前者在细胞体内形成并沿轴突转运至末梢,后者则在末梢线粒体内合成,须先与草酰乙酸缩合成枸橼酸盐,才能穿过线粒体膜进入胞质液中,然后在枸橼酸裂酶的催化下再形成乙酰辅酶A。胆碱乙酰化酶和乙酰辅酶A在胞质液内促进胆碱形成乙酰胆碱。乙酰胆碱形成后,即进入囊泡并与ATP和囊泡蛋白共同贮存于囊泡中(图5-5)。
4.递质的释放 现认为当神经冲动到达末梢时,产生除极化,引起Ca2+内流促使靠近突触前膜的一些囊泡的囊泡膜与突触前膜融合,形成裂孔,通过裂孔将囊泡内的递质、ATP和蛋白质等排出至突触间隙,这称为胞裂外排(exocytosis)。每一囊泡约含有1000~50000分子乙酰胆碱或约10000分子去甲肾上腺素。骨骼肌或平滑肌细胞有自发性小终板电位(miniatuse endplate potential)或接头电位,其电位幅度有分极现象;因此提出递质的量子化释放(quantalrelease)概念。每一量子相当于一个囊泡的释放量。由于这种电位幅度很小(0.3~3.0mv),故不会引起动作电位和效应。冲动到达时,可有上百个囊泡同时外排,才引起动作电位和效应。近知嗜铬细胞胞浆中的会合素(synexin),在有Ca2+时,能融合嗜铬颗粒(相当于神经末梢的囊泡)膜与细胞膜。
5.递质作用的消失 乙酰胆碱作用的消失主要是被神经突触部位的胆碱酯酶水解,一般在释放后一至数毫秒之内即被此酶水解而失效。去甲肾上腺素主要靠突触前膜将其摄取入神经末梢内而使作用消失;这种摄取称为摄取1(uptake1)。摄取1是一种主动的转运机制,也称胺泵(amine pump),能逆浓度梯度而摄取内及外源性去甲肾上腺素。其摄取量为释放量的75%~95%,摄取入神经末梢的去甲肾上腺素尚可进一步被摄取入囊泡,贮存起来以供下次的释放。部分未进入囊泡的去甲肾上腺素可被胞质液中线粒体膜上的单胺氧化酶(mono-amineoxidase,MAO)破坏。非神经组织如心肌、平滑肌等也能摄取去甲肾上腺素,称为摄取2。此种摄取之后,即被细胞内的儿茶酚氧位甲基转移酶(catechol-O-methyltransferase,COMT)和MAO所破坏;因此摄取1可称为摄取-贮存型,摄取2可称为摄取-代谢型。此外,尚有小部分去甲肾上腺素释放后从突触间隙扩散到血液中,最后被肝、肾等的COMT和MAO所破坏。
(二)传出神经系统的受体
1.受体的命名 受体的命名常根据能与之选择性地相结合的递质或药物而定。能与乙酰胆碱结合的受体,称为胆碱受体(cholinoceptor)。由于在早期的研究中,发现位于副产感神经节后纤维所支配的效应器细胞膜的胆碱受体对以毒蕈碱为代表的拟胆碱药较为敏感,故这部分受体称为毒蕈碱(muscarine)型胆碱受体(M胆碱受体)。位于神经节细胞膜和骨骼肌细胞膜的胆碱受体对烟碱比较敏感,故这些部位的受体称为烟碱(nicotine)型胆碱受体(N胆碱受体),也可将前者称为N1受体,后者称为N2受体。近年发现M胆碱受体也有M1受体、M2受体和M3受体之分。M1受体主要分布于神经节细胞和腺体细胞,哌仑西平能选择性地阻断之;M2受体似主要分布于心脏;M3受体似主要分布于平滑肌和腺体细胞。哌仑西平对M2和M3受体的亲和力较低,阿托品对三种M受体都能阻断。
能与去甲肾上腺素或肾上腺素结合的受体称为肾上腺素受体(adrenoceptor)。肾上腺素受体又可分为α肾上腺素受体(α受体)和β肾上腺素受体(β受体)。β受体又分为β1受体和β2受体两种亚型,例如心脏的β受体主要为β1受体,支气管和血管平滑肌的β受体主要为β2受体。
70年代发现外源去甲肾上腺素可抑制去甲肾上腺素能神经内[3H]标记去甲肾上腺素的释放(图5-6)。因此认为突触前膜也有α受体,激动时可使递质释放减少,这是一种递质释放的自身调节机制。当时将突触后膜α受体命名为α1受体,突触前膜受体命名为α2受体。后来在许多血管组织突触后膜都发现有不受α1受体阻断药哌唑嗪阻断的α2受体。血管平滑肌突触后膜的α1和α2受体的共存似为普遍现象,可见以突触前、后膜的解剖部位进行α受体分类是不妥的。而以特异的阻断剂和激动剂来区分受体亚型更为合适。
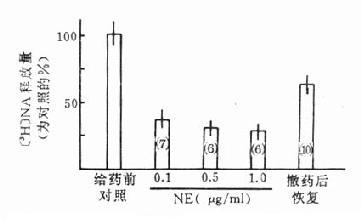
图5-6 NA对电刺激所致[3H]NA释放的影响
猫脾脏灌流,每次刺激共200脉冲,30Hz,
括号内数字为实验次数,竖线为SE(自Bevan,1978)
2.受体按偶联和结构的分类根据第二章对受体的叙述,肾上腺素受体和M胆碱受体属于G-蛋白偶联受体,N胆碱受体属于配体门控通道型受体。近年由于单克隆抗体和DNA重组等技术的应用,许多受体的一级结构得以阐明。现已知G-蛋白偶联受体一级结构的特点是都有7个跨膜区段,以β2受体为例,自图5-7可见,每个跨膜区段有20余个氨基酸残基组成的亲脂性螺旋结构。其伸出细胞膜外的N端较短,伸入细胞内的C端较长。处于β受体第3跨膜区细胞膜内深1.1nm的门冬氨酸似为与配体的主要结合点。
N胆碱受体是由两个单体形成的二聚体。每个单体由5个亚基组成,包括两个α亚基(分子量为40000),一个β亚基(50000),一个γ基(57000)和一个δ亚基(64000)。每个亚基都有4个跨膜区段。5个亚基围绕成环状而形成离子通道(图5-8)。
二、传出神经按递质的分类
一般都根据所释放递质的不同,将传出神经分为胆碱能神经和去甲肾上腺素能神经两大类。
(一)胆碱能神经(cholinergicnerve)能合成Ach,兴奋时从末梢释放Ach。
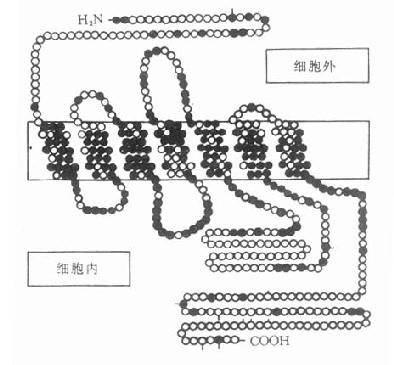
图5-7 人体β1-肾上腺受体
含477氨基酸,肽链跨膜7次,N端在细胞外,C端在
细胞内,胞内带短线的是丝氨酸,能被磷酸化。黑实心
圆是人体β1、β2受体所共有的氨基酸,在跨膜区较多。
(自TINS 11,321,1988)
1.全部交感神经和副交感神经的节前纤维;
2.运动神经;
3.全部副交感神经的节后纤维;
4.极少数交感神经节后纤维,如支配汗腺的分泌神经和骨骼肌的血管舒张神经。
(二)去甲肾上腺素能神经(noradrenergic nerve)能合成NA,兴奋时能释放NA。
几乎全部交感神经节后纤维都属此类。
传统认为一类神经元只释放一种递质,现知情况远较复杂。实际上许多神经元都贮有二或三种递质可供释放,例如颌下腺胆碱能神经元除有能促分泌的乙酰胆碱外,还随同释放血管活性肠肽(VIP),它能扩张血管,阿托品能抑制分泌,却不能拮抗血管扩张。大脑皮质神经元同此。肠壁神经元能共同释放VIP、强啡肽和甘丙肽。许多去甲肾上腺素能神经元也共同释放NA、ATP和神经肽Y。上述现象现称共同传递(cotransmission)。
三、传出神经系统效应产生的生化过程
神经递质或激动药受体结合后,触发一系列瀑布式的生化过程,通过一级一级地放大,最终导致效应,这一过程称为受体-效应偶联(receptor-effect coupling)。现介绍有关传出神经系统的两种受体反应偶联如下:
(一)受体与离子通道的偶联
神经递质或激动药与受体间相互作用可使受体操纵性离子通道(receptor-operatedclannel)开放,从而产生效应。例如β受体激动使钙离子通道开放,Ca2+进入细胞而产生各种生理效应。
有些受体含有离子通道,如上述N胆碱受体,与配体结合就能直接使通道开放。故称这种受体为门控通道型受体。
(二)受体与酶的偶联
传出神经系统的G蛋白偶联受体是通过腺苷酸环化酶(adenyl cyclase,AC)或磷脂酶C(phospholipase C, PLC)而产生效应的(图5-9)。
四、传出神经系统的生理功能
传出神经系统药物种类繁多,但它们药理作用的共性不外是影响传出神经系统的功能,或是拟似药,或是拮抗药。因此,如果熟悉两大类传出神经即去甲肾上腺素能神经和胆碱能神经的生理功能,再结合各药的特性,自易掌握每个药物的药理作用。
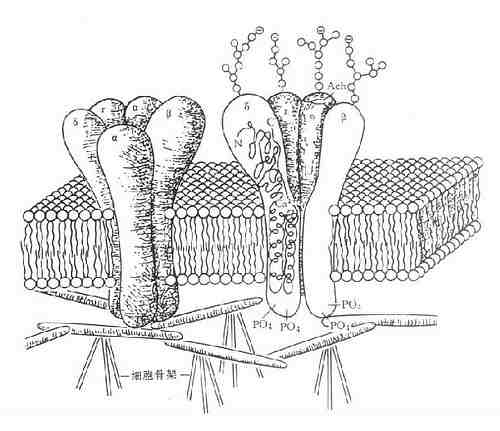
图5-8 N2烟碱受体
5个亚基各含约450个氨基酸,此5个肽链形成一个跨膜的环,在细胞内固定于细胞骨架上,每一肽链跨膜4次,N端和C端都位于胞外部(如δ亚单位剖面所示)。肽链在胞外被糖基化。在胞内被磷酸化,导致受体脱敏,2个α单位各有1个Ach结合位点,二者都结合1分子Ach后,钠通道开放,细胞除极兴奋。(引自F.Hucho)
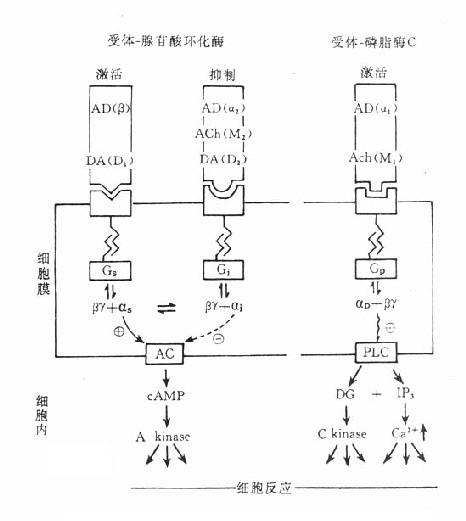
图5-9 受体-腺苷酸环化酶偶联和受体-磷脂酶偶联示意图
多数器官都接受上述两大类传出神经的双重支配。去甲肾上腺素能神经兴奋时(相当于递质去甲肾上腺素的作用),可见心脏兴奋、皮肤粘膜和内脏血管收缩、血压升高、支气管和胃肠道平滑肌抑制、瞳孔扩大等。这些功能变化,有利于机体适应环境的急聚变化。胆碱能神经兴奋时(相当于递质乙酰胆碱作用),节前与节后纤维的功能有所不同,当节后纤维兴奋时,基本上表现与上述相反的作用,有利于机体进行休整和积蓄能量。当节前纤维兴奋时,可引起神经节兴奋和肾上腺髓质分泌的增加,细节见表5-1。
表5-1 传出神经的受体-效应表*
| 效应器 | 肾上腺素能神经兴奋 | 胆碱能神经兴奋 | |||||
| 效 应 | 受 体 | 效应 | 受体 | ||||
| 心脏 | 心肌 窦房结 传导系统 | 收缩力加强⑧ 心率加快 传导加快 | β1① | 收缩力减弱 心率减慢 传导减慢 | M M | ||
| 平 滑 肌 | 血 管 | 皮肤、粘膜 腹腔内脏② 骨骼肌 冠状动脉 | 收缩 收缩 舒张 收缩 舒张 舒张 | α α β2 α β2 β2 | 舒张④ 舒张(交感神经) | ||
| 支气管,气管 胃肠壁⑤ 膀胱逼尿肌 胃肠和膀胱括约肌 胆囊与胆道 | 舒张 舒张 舒张 收缩 舒张 | β2 α、β2 β2 α β2 | 收缩 收缩 收缩 舒张 收缩 | ||||
| 子宫 | 收缩⑥ 抑制 | α β2 | 不定 | ||||
| 眼 | 虹膜 睫状肌 | 瞳孔扩大肌收缩(扩瞳) 舒张(远视) | α β2 | 瞳孔括约肌收缩(缩瞳) 收缩(近视) | |||
| 腺 体 | 汗腺 唾液腺 胃肠道及呼吸道腺体 | 手心脚心分泌 分泌K+及H2O 分泌淀粉酶 | α′ α β2 | 全身分泌(交感神经) 分泌K+及H2O 分泌 | |||
| 代谢 | 肝脏糖代谢 骨骼肌糖代谢 脂肪代谢 | 肝糖原分解及异生 肌糖原分解 脂肪分解 | α、β2 β2 α、β2⑦ | ||||
| 植物神经节 肾上腺髓质 | 兴奋 分泌(交感神经节前纤维) | N1 | |||||
| 骨骼肌 | 收缩 | β2 | 收缩(运动神经) | N2 | |||
①心肌也具α和β2受体;人的心肌β1受体与β2受体之比约为80:20。
②肾脏和肠系膜血管尚有多巴胺受体,激动时血管舒张。
③虽也有α受体,但在整体动物,由于自身调节机制而表现为舒张。
④无生理意义。
⑤消化道神经丛副交感神经节前纤维末梢可能有α受体,激动时抑制乙酰胆碱的释放,产生抑制效应。
⑥雌激素占优势时,可致收缩。
⑦不同动物,受体亚型各异。
⑧黑体字表示占优势。
*许多组织都有不同型的受体共存,本表所列是在各组织中占多数的主要受体。
人体内的生理调节是在对立统一规律下进行的。在同一器官上,胆碱能神经和去甲肾上腺素能神经的作用大多是互相对抗的,但在中枢神经系统的调节下,它们的功能既是对立的,又是统一的。
近年来,在受体水平的研究中,也发现胆碱能神经和去甲肾上腺素能神经的功能并非截然分割,而是互相调节和互相制约的。例如有此去甲肾上腺素能神经和胆碱能神经突触前膜可能兼具抑制性的α受体和M受体,即受其本身所释放递质的反馈性调节,也受其生理拮抗性神经元所释放的递质的控制。
五、传出神经系统药物的基本作用
(一)直接作用于受体
许多传出神经系统药物能直接与胆碱受体或肾上腺素受体结合。结合后,如果产生与递质相似的作用,就称激动药。如果结合后不产生或较少产生拟似递质的作用,相反,却能妨碍递质与受体的结合,从而阻断了冲动的传递,产生与递质相反的作用,就称为阻断药(blocker);对激动药而言,可称拮抗药。
这类药物品种很多,也较常用。由于胆碱受体分为M和N两型,肾上腺素受体也有α和β两型。因此,选择性地作用于不同型受体的激动药和阻断药也具有相应的分类。
(二)影响递质
1.影响递质的生物合成直接影响递质生物合成的药物较少,且无临床应用价值,仅作药理学研究的工具药。
2.影响递质的转化如乙酰胆碱的灭活主要是被胆碱酯酶水解。因此,抗胆碱酯酶药就能妨碍乙酰胆碱的水解,提高其浓度,产生效应。
表5-2常用传出神经系统药物的分类
| 拟 似 药 | 拮 抗 药 |
| 1.M,N受体激动药(氨甲酰胆碱) 2.M受体激动药(毛果云香碱) 3.N受体激动药(烟碱) (二)抗胆碱酯酶药(新斯的明) (三)肾上腺素受体激动药 1.α受体激动药 (1)α1,α2受体激动药(去甲肾上腺素) (2)α1受体激动药(去氧肾上腺素) (3)α2受体激动药(可乐定) 2.α、β受体激动药(肾上腺素) 3.β受体激动药 (1)β1,β2受体激动药(异丙肾上腺素) (2)β1受体激动药(多巴酚丁胺) (3)β2受体激动药(沙丁胺醇) | (一)胆碱受体阻断药 1.M受体阻断药 (1)非选择性M受体阻断药(阿托品) (2)M1受体阻断药(哌仑西平) 2.N受体阻断药 (1)N1受体阻断药(六甲双铵) (2)N2受体阻断药(琥珀胆碱) (二)胆碱酯酶复活药(碘解磷定) (三)肾上腺素受体阻断药 1.α受体阻断药 (1)α1,α2受体阻断药 ①短效类(酚妥拉明) ②长效类(酚苄明) (2)α1受体阻断药(哌唑嗪) (3)α2受体阻断药(育亨宾) 2.β受体阻断药 1A类(普萘洛尔) 1B类(吲哚洛尔) 2A类(阿替洛尔) 2B类(艾司洛尔,esmolol,短效) 3类(拉贝洛尔) |
去甲肾上腺素作用的消失与乙酰胆碱不同,它主要靠突触前膜的摄取,因此现有的MAO抑制药或COMT抑制药并不能成为理想的外周拟肾上腺素药。
3.影响递质的转运和贮存药物可通过促进递质的释放而发挥递质样作用。例如麻黄碱促进去甲肾上腺素的释放、氨甲酰胆碱促进乙酰胆碱的释放而发挥作用,虽然它们同时尚有直接与受体结合的作用。
药物也可通过影响递质在神经末梢的贮存而发挥作用。例如利血平抑制神经末梢囊泡对去甲肾上腺素的摄取,使囊泡内去甲肾上腺素逐渐减少以至耗竭,从而表现为拮抗去甲肾上腺素能神经的作用。
六、传出神经系统药物的分类
传出神经系统药物可按其作用性质(激动受体或阻断受体)和对不同类型受体的选择性进行分类如表5-2。也可将影响胆碱酯酶的药单列一类。
(上海医科大学 杨藻宸)
第六章 胆碱受体激动药
胆碱受体激动药(cholinoceptor agonists)与胆碱受体结合,激动受体,产生与递质乙酰胆碱相似的作用。按其对不同胆碱受体亚型的选择性,可分为:①M,N胆碱受体激动药;②M胆碱受体激动药;③N胆碱受体激动药。
第一节 M,N胆碱受体激动药
本类药物既用于节后胆碱能神经支配的效应器内的M胆碱受体,也作用于神经节和骨骼肌的N胆碱受体。
乙酰胆碱
乙酰胆碱(acetylcholine, Ach)是胆碱能神经递质,化学性质不稳定,遇水易分解。由于作用十分广泛,且在体内为胆碱酯酶迅速破坏,故除作为药理学研究的工具药外,无临床实用价值。但如了解其生理、药理作用,将便于学习和掌握胆碱受体激动药和胆碱受体阻断药的药理。
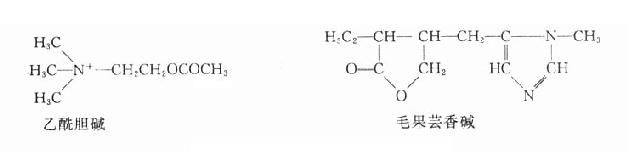
乙酰胆碱和毛果芸香碱的化学结构
【药理作用】
1.M样作用 静脉注射小剂量Ach即能激动M胆碱受体,产生与兴奋胆碱能神经节后纤维相似的作用,引起心率减慢、血管舒张、血压下降,支气管和胃肠道平滑肌兴奋,瞳孔括约肌和睫状肌收缩以及腺体分泌增加等。舒张血管可能是激动血管内皮细胞的M受体使内皮细胞释放依赖性舒张因子(endothelium-dependentrelaxing factor,EDRF,现多认为EDRF即是一氧化氮(NO))所致。
2.N样作用 剂量稍大时,Ach也能激动N胆碱受体,产生与兴奋全部植物神经节和运动神经相似的作用。还能兴奋肾上腺髓质的嗜铬组织(此组织在胚胎发育中与交感神经节的来源相同,受交感神经节前纤维支配),使之释放肾上腺素。许多器官是由胆碱能和去甲肾上腺素能神经双重支配的,通常是其中一种占优势。例如,在胃肠道、膀胱平滑肌和腺体是以胆碱能神经占优势,而心肌收缩和小血管方面则以去甲肾上腺素能神经占优势。故在大剂量Ach作用下,全部神经节(具N1胆碱受体)兴奋的结果是胃肠道、膀胱等器官的平滑肌兴奋,腺体分泌增加,心肌收缩力加强,小血管收缩,血压升高。Ach还激动运动神经终板上的N2胆碱受体,表现为骨骼肌兴奋。过大剂量的Ach很易使神经节从兴奋转入抑制。
氨甲酰胆碱
氨甲酰胆碱(carbamylcholine,carbachol)的化学结构和作用都与Ach相似,能直接激动M和N受体,也可能促进胆碱能神经末梢释放Ach而发挥间接作用。可用于手术后腹气胀和尿潴留。副作用较多,加以阿托品对它的解毒效果差,故目前主要局部滴眼用于治疗青光眼,引起缩瞳以降低眼内压。
第二节 M胆碱受体激动药
毛果芸香碱
又名匹鲁卡品(pilocarpine)是从毛果芸香属(pilocarpus属)植物中提出的生物碱,基水溶液稳定,也能人工合成。
【药理作用】 能选择性地激动M胆碱受体,产生M样作用。对眼和腺体的作用最明显。
1.眼 滴眼后能引起缩瞳、降低眼内压和调节痉挛等作用:
(1)缩瞳虹膜内有两种平滑肌,一种是瞳孔括约肌,受动眼神经的副交感神经纤维(胆碱能神经)支配,兴奋时瞳孔括约肌收缩,瞳孔缩小;另一种是瞳孔开大肌,受去甲肾上腺素能神经支配,兴奋时瞳孔开大肌向外周收缩,瞳孔扩大。用毛果芸香碱后,可激动瞳孔活约肌的M胆碱受体,表现为瞳孔缩小。
(2)降低眼内压房水是从睫状体上皮细胞分泌及血管渗出而产生,经瞳孔流入前房,到达前房角间隙,主要经小梁网(滤帘)流入巩膜静脉窦,最后进入血流(图6-1,6-2)。毛果芸香碱可通过缩瞳作用使虹膜向中心拉紧,虹膜根部变薄,从而使处在虹膜周围部分的前房角间隙扩大,房水易于通过小梁网及巩膜静脉窦而进入循环,结果使眼内压下降。
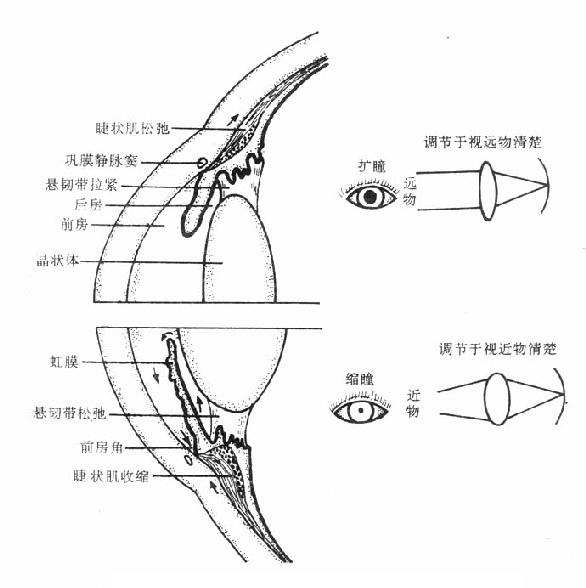
图6-1 M胆碱受体激动药和阻断药对眼的作用
上:胆碱受体阻断药的作用 下:胆碱受体激动药的
作用,箭头表示房水流通及睫状肌收缩或松弛的方向
(3)调节痉挛使晶状体聚焦,适合于视近物的过程,称为调节。眼睛的调节主要取决于晶状体的曲度变化。晶状体囊富有弹性,使晶状体有略呈球形的倾向,但由于睫状小带(悬韧带)向外缘的牵拉,通常使晶状体维持于比较扁平的状态。睫状小带又受睫状肌控制,睫状肌由环状和辐射状两种平滑肌纤维组成,其中以胆碱能神经(动眼神经)支配的环状肌纤维为主。动眼神经兴奋时或用拟胆碱药如毛果芸香碱时使环状肌向瞳孔中心方向收缩,结果使睫状小带放松,晶状体变凸,屈光度增加,只适合于视近物,而看远物则难以使其清晰地成像于视网膜上;故看近物清楚,看远物模糊。拟胆碱药的这种作用称为调节痉挛。
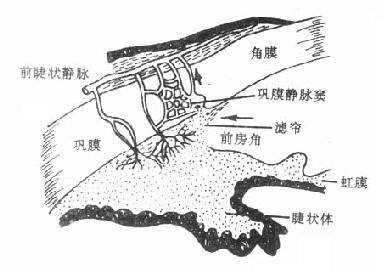
图6-2 房水出路(箭头示房水回流方向)
睫状肌的辐射状肌纤维受去甲肾上腺素能神经支配,但这在眼睛调节中不占重要地位,故拟肾上腺素药一般不影响调节。
2.腺体 吸收后能激动腺体的M胆碱受体,汗腺和唾液腺分泌增加最明显。
【临床应用】其吸收作用除用作抗胆碱药阿托品等中毒的抢救外,其它应用价值不大。临床上主要局部用于治疗青光眼。滴眼后易透过角膜进入眼房,作用迅速,10分钟后出现作用,半小时达高峰。与毒扁豆碱比较,毛果芸香碱作用温和而短暂,故用药间隔时间宜短,水溶液比较稳定。吸收后的不良反应主要由其M胆碱作用所致,可用阿托品对抗。
1,青光眼眼内压增高是青光眼的主要特征,可引起头痛、视力减退等症状,严重时可致失明。闭角型青光眼(急性或慢性充血性青光眼)患者前房角狭窄,眼内压增高。毛果芸香碱能使眼内压迅速降低,从而缓解或消除青光眼症状。
毛果芸香碱也适用于开角青光眼(慢性单纯性青光眼)的治疗。这种青光眼无前房角狭窄和闭塞情况,而是由于小梁网本身及巩膜静脉窦发生变性或硬化,阻碍了房水循环,引起眼内压升高。毛果芸香碱可能的通过扩张巩膜静脉窦周围的小血管以及收缩睫状肌后,小梁网结构发生改变而使眼内压下降。
常用1%~2%溶液滴眼,用后30~40分钟缩瞳作用达高峰,降低眼内压作用可维持4~8小时,调节痉挛作用在2小时左右消失。滴眼时应压迫内眦,避免药液流入鼻腔,因吸收而产生副作用。
2.虹膜炎 与扩瞳药交替应用,可防止虹膜与晶状体粘连。
氨甲酰甲胆碱
氨甲酰胆碱(carbamylmethylcholine)又名乌拉胆碱(urecholine)为M受体激动药,对胃肠道及膀胱平滑肌作用的选择性最高。用于手术后腹气胀和尿潴留。
第三节 N胆碱受体激动药
烟碱(nicotine)是N胆碱受体激动药的代表,它是烟叶(tobacco)的重要成分。作用很复杂,既作用于N1受体,也作用于N2受体,此外,尚可作用于中枢神经系统,而且具有小剂量激动,大剂量阻断N受体的双相作用。因此无临床治疗应用价值,但为烟草制品所含毒物之一,在吸烟的毒理中具有重要意义。
胆碱受体激动药 制剂及用法
氯化氨甲酰胆碱(carbamylcholine chloride) 皮下注射,0.25~0.5mg/次,0.5%~1.5%溶液滴眼。
硝酸毛果芸香碱(pilocarpine nitrate)滴眼液或眼膏,1%~2%,滴眼次数按需要决定,晚上或需要时涂眼膏。
第七章 抗胆碱酯酶药和胆碱酯酶复活药
第一节 胆碱酯酶
胆碱酯酶(cholinesterase)是一类糖蛋白,以多种同功酶形式存在于体内。一般可分为真性胆碱酯酶和假性胆碱脂酶。真性胆碱酯酶也称乙酰胆碱酯酶(acetylcholinesterase),主要存在于胆碱能神经末梢突触间隙,特别是运动神经终板突触后膜的皱折中聚集较多;也存在于胆碱能神经元内和红细胞中。此酶对于生理浓度的Ach作用最强,特异性也较高。一个酶分子可水解3×105分子Ach,一般常简称为胆碱酯酶。假性胆碱酯酶广泛存在于神经胶质细胞、血浆、肝、肾、肠中。对Ach的特异性较低,假性胆碱酯酶可水解其他胆碱酯类,如琥珀胆碱。
胆碱酯酶蛋白分子表面的活性中心有两个能与乙酰胆碱结合的部位,即带负电荷的阴离子部位和酯解部位。酯解部位含有一个由丝氨酸的羟基构成的酸性作用点和一个由组氨酸咪唑环构成的碱性作用点,两者通过氢键结合,增强了丝氨酸羟基的亲核活性,使之易于与乙酰胆碱结合(图7-1)。
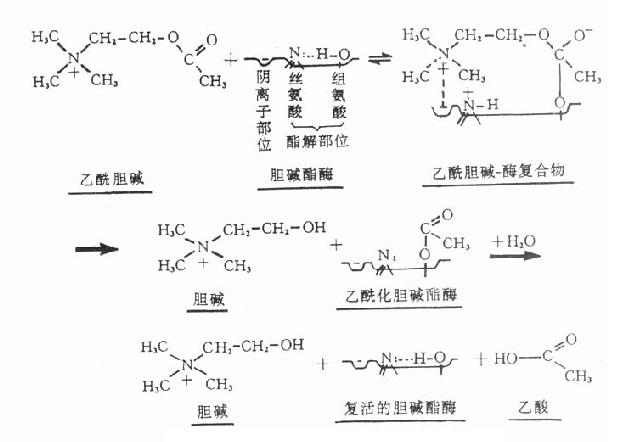
图7-1 胆碱酯酶水解乙酰胆碱碱过程的示意图
胆碱酯酶水解乙酰胆碱的过程可分为三个步骤:①乙酰胆碱分子结构中带正电荷的季铵阳离子头,以静电引力与胆碱酯酶的阴离子部位相结合;同时乙酰胆碱分子中的羰基碳与胆碱酯酶酯解部位的丝氨酸的羟基以共价键形式结合,形成乙酰胆碱和胆碱酯酶的复合物。②乙酰胆碱与胆碱酯酶复合物裂解成胆碱和乙酰化胆碱酯酶。③乙酰化胆碱酯酶迅速水解,分离出乙酸,酶的活性恢复。
第二节 抗胆碱酯酶药
抗胆碱酯酶药和乙酰胆碱一样,也能与胆碱酯酶结合,但结合较牢固,水解较慢,使酶失去活性,胆碱能神经末梢释放的乙酰胆碱便大量堆积,表现M及N样作用。
抗胆碱酯酶药可分为两类:一类是易逆性抗胆碱酯酶药,如新斯的明等;另一类为持久性抗胆碱酯酶药,如有机磷酸酯类。
一、易逆性抗胆碱酯酶药
新斯的明
新斯的明(neostigmine,prostigmine)是人工合成品。
化学结构中具有季铵基因,故口服吸收少而不规则。一般口服剂量为皮下注射量的10倍以上。不易透过血脑屏障,无明显的中枢作用。溶液滴眼时,不易透过角膜进入前房,故对眼的作用也较弱。
【作用机制】新斯的明能可逆地抑制胆碱酯酶,表现乙酰胆碱的M和N样作用。其结构中的季铵阳离头以静电引力与胆碱酯酶的阴离子部位结合,同时其分子中的羰基碳与酶的酯解部位丝氨酸羟基形成共价键结合,生成胆碱酯酶和新斯的明复合物。由复合物进而裂解成的二甲胺基甲酰化胆碱酯酶的水解速度较乙酰化胆碱酯酶的水解速度为慢,故酶被抑制的时间较长,但较有机磷酸酯类为短,故属易逆性类。二甲胺基甲酰化胆碱酯酶水解后,形成二甲胺基甲酸和复活的胆碱酯酶,酶的活性才得以恢复(图7-2)。
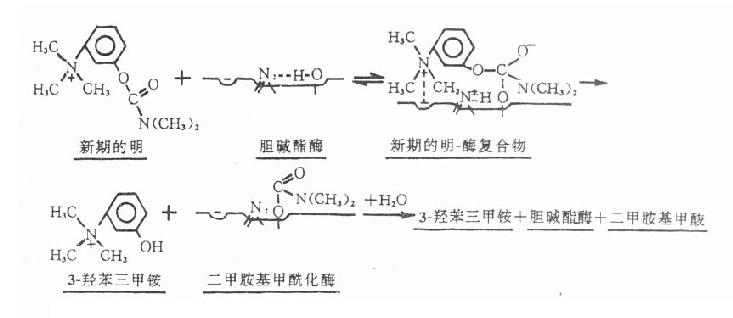
图7-2 新斯的明抑制胆碱酯酶过程的示意图
【药理作用】新斯的明对心血管、腺体、眼和支气管平滑肌作用较弱,对胃肠道和膀胱平滑肌有较强的兴奋作用;而对骨骼肌的兴奋作用最强,因为它除通过抑制胆碱酯酶而发挥作用外,还能直接激动骨骼肌运动终板上的N2胆碱受体以及促进运动神经末梢释放乙酰胆碱。
【临床应用】
1.重症肌无力其主要特征是肌肉经过短暂重复的活动后,出现肌无力症状。这是一种自身免疫性疾病。多数患者血清中有抗胆碱受体的抗体,其终板电位的胆碱受体数量减少70%~90%。皮下或肌内注射新斯的明后,约经15分钟左右即可使症状减轻,约维持2~4小时左右。除严重和紧急情况外,一般采用口服给药,因需经常给药,故要掌握好剂量,以免因过量转入抑制,引起“胆碱能危象”使肌无力症状加重。如疗效不够满意时,可并用糖皮质激素制剂或硫唑嘌呤等免疫抑制药。
2.腹气胀和尿潴留新斯的明能兴奋胃肠道平滑肌及膀胱逼尿肌,促进排气和排尿,适用于手术后腹气胀和尿潴留。
3.阵发性室上性心动过速在压迫眼球或颈动脉窦等兴奋迷走神经措施无效时,可用新斯的明,通过拟胆碱作用使心室频率减慢。
4.可用于非去极化型骨骼肌松弛药如筒箭毒碱过量时的解毒(见第九章)。
【不良反应】副作用较小,过量可产生恶心、呕吐、腹痛、肌肉颤动等,其M样作可用阿托品对抗。禁用于机械性肠梗阻、尿路梗塞和支气管哮喘患者。
其他易逆性抗胆碱酯酶药
吡啶斯的明(pyridostigmine)作用较新斯的明稍弱。主要用于治疗重症肌无力,因肌力改善作用维持较久,故适于晚上用药。也可用于手术后腹气胀和尿潴留。过量中毒的危险较少。禁忌证同新斯的明。
安贝氯铵(ambenonium,酶抑宁mytelase)的抗胆碱酯酶作用和兴奋骨骼肌作用都较新斯的明强,作用持续时间也较长,可口服给药。主要用于重症肌无力,不良反应和应用时注意事项与新斯的明相似。
毒扁豆碱(physostigmine)又名依色林(eserine),是从非洲出产的毒扁豆(Phsostigmavenenosum)种子中提出的生物碱,现已能人工合成。水溶液不稳定,滴眼剂应以pH4~5的缓冲液配制,否则易氧化成红色,疗效减弱,刺激性增大,应保存在棕色瓶内。为叔胺类化合物。易通过粘膜吸收。口服及注射都易吸收,也易于透过血脑屏障。具有与新斯的明相似的可逆性抑制胆碱酯酶的作用,吸收后在外周可出现拟胆碱作用。对中枢神经系统,小剂量兴奋,大剂量抑制,中毒时可引起呼吸麻痹。现主要局部用于治疗青光眼,能缩小瞳孔,降低眼内压,收缩睫状肌而引起调节痉挛等。常用0.005%溶液滴眼,作用较毛果芸香碱强而持久,但刺激性较大。又由于收缩睫状肌的作用较强,可引起头痛。滴眼后5分钟即出现缩瞳,眼内压下降作用可维持1~2天,调节痉挛现象消失较快。滴眼时应压迫内眦,避免药液流入鼻腔后吸收,引起中毒。
加兰他敏(galanthamine)也是可逆性抗胆碱酯酶药,体外抗胆碱酯酶效价约为毒扁豆碱的1/10。可用于重症肌无力,但疗效较差,也用于脊髓前角灰白质炎(小儿麻痹症)后遗症的治疗。
二、难逆性抗胆碱酯酶药一有机磷酸酯类
有机磷酸脂类(organophosphate)与胆碱酯酶结合后,时间稍久,胆碱酯酶即难以恢复,故称难逆性抗胆碱酯酶药,毒性很强。主要用作农业杀虫剂,有的可用作环境卫生杀虫剂,如敌百虫(dipterex)、乐果(rogor)、马拉硫磷(malathion)、敌敌畏(DDVP)和内吸磷(E1059)等。只有少数可医用作为滴眼剂如异氟磷(isoflurophate)等发挥缩瞳作用。
【化学】 有机磷酸酯类的基本化学结构见图7-3,R和R′多是烷基,如CH3、C2H5、C3H7等;O一般是氧或硫;X是烷氧基、烷硫基或卤素等。
【毒性作用机制】有机磷酸酯类的作用机制与可逆性抗胆碱酯酶相似,只是与胆碱酯酶的结合更为牢固。结合点也在胆碱酯酶的酯解部位丝氨酸的羟基。此羟基的氧原子具有亲核性,而有机磷酸酯类分子中的磷原子是亲电子性的,因此磷、氧二原子间易于形成共价键结合,生成难以水解的磷酰化胆碱酯酶(见图7-3)。结果使胆碱酯酶失去水解乙酰胆碱的能力,造成乙酰胆碱在体内大量积聚,引起一系列中毒症状。若不及时抢救,酶在几分钟或几小时内就“老化”。“老化”过程可能是磷酰化胆碱酯酶的磷酰化基团上的一个烷氧基断裂,生成更稳定的单烷氧基磷酰化胆碱酯酶。此时即使用胆碱酯酶复活药,也不能恢复酶的活性,必须等特新生的胆碱酯酶出现,才有水解乙酰胆碱的能力,此一恢复过程需15~30天。因此一旦中毒,必须迅速抢救,而且要持续进行。
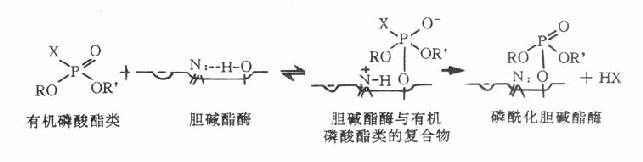
图7-3 有机磷酸酯类抗胆碱酯酶作用示意图
【体内过程及中毒途径】有机磷酸酯类在胃肠道、呼吸道、皮肤和粘膜都可吸收。经胃肠道吸收中毒的多由误食农药而引起。许多有机磷酸酯类容易挥发,因此也易吸入中毒。皮肤沾染了一定量的有机磷酸酯类时,也可引起全身性中毒。吸收后可分布全身,以肝浓度最高,大部分经肾排泄,一般不易蓄积。
【急性毒性】本类药物阻扰乙酰胆碱的消除,而乙酰胆碱的作用又极其广泛,故有机磷酸酯类的中毒症状表现多样化。轻者以M样症状为主,中度者可同时有M样症状和N样症状,严重中毒者除外周M样和N样症状外,还出现中枢神经系统症状。
1.M样症状
(1)眼瞳孔缩小,严重中毒者几乎全部出现,但中毒早期可能并不出现。因此,缩瞳不宜作为早期诊断的依据。此外,可出现视力模糊或因睫状肌痉挛而感觉眼痛者。
(2)腺体分泌增多,引起流涎和出汗。重者可口吐白沫,大汗淋漓。
(3)呼吸系统支气管平滑肌收缩和腺体分泌增加,引起呼吸困难甚至肺水肿。
(4)胃肠道由于胃肠道平滑肌的兴奋和有机磷酸酯类对胃肠道粘膜的刺激作用,可引起恶心、呕吐、腹痛和腹泻等。
(5)泌尿系统严重病倒可由于膀胱逼尿肌收缩而引起小便失禁。
(6)心血管系统 M样作用可引起心率减慢和血压下降,但由于同时有N样作用,故有时也可引起血压升高。
2.N样症状 交感和副交感神经节的N1受体和骨骼肌运动终板的N2受体都被激动。其神经节兴奋症状在胃肠道、腺体、眼等方面,是胆碱能神经占优势;因此结果和M样作用一致。在心血管,则去甲肾上腺素能神经占优势,故常表现为心收缩力加强、血压上升。N2受体激动则表现为肌束颤动,常先自小肌肉如眼睑、颜面和舌肌开始,逐渐发展至全身;严重者可因呼吸肌麻痹而死亡。
3.中枢症状有机磷酸类可使脑内乙酰胆碱含量升高,从而影响神经冲动在中枢突触的传递。表现为先兴奋、不安、谵语以及全身肌肉抽搐;进而由过度兴奋转入抑制,出现昏迷,并因血管运动中枢抑制而血压下降及呼吸中枢麻痹而呼吸停止。
【慢性毒性】多发生在生产农药的工人或长期接触农药的人员中。突出表现为血中胆碱酯酶活性显著而持久地下降,但与临床症状并不平行。主要症状有神经衰弱征候群和腹胀、多汗、偶有肌束颤动及瞳孔缩小。在慢性中毒的基础上,一次稍大剂量的吸收,也可能引起急性毒性发作。
第三节 胆碱酯酶复活药
胆碱酯酶复活药(cholinedterasereactivators)是一类能使已被有机磷酸酯类抑制的胆碱酯酶恢复活性的药物,其出现使有机磷酸酯类中毒的治疗获得了新的发展,它不但使单用阿托品所不能控制的严重中毒病倒得到解救,而且显着地缩短了一般中毒的病程。常用的有碘解磷定和氯磷定,二者均为肟类(oxime)化合物。
碘解磷定
碘解磷定(pyraloximemethoiodide)简称派姆(PAM),为最早应用的胆碱酯酶复活药。水溶性较低,水溶液不稳定,久置可释放出碘。
【药理作用】碘解磷定进入有机磷酸酯类中毒者体内,其带正电荷的季铵氮即与被磷酰化的胆碱酯酶的阴离子部位以静电引力相结合,结合后使其肟基趋向磷酰化胆碱酯酶的磷原子,进而与磷酰基形成共价键结合,生成磷酰化胆碱酯酶和碘解磷定复合物,后者进一步裂解成为磷酰化碘解磷定。同时使胆碱酯酶游离出来,恢复其水解乙酰胆碱的活性(见图7-4)。
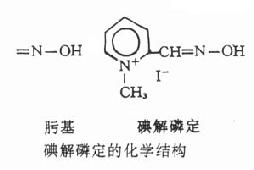
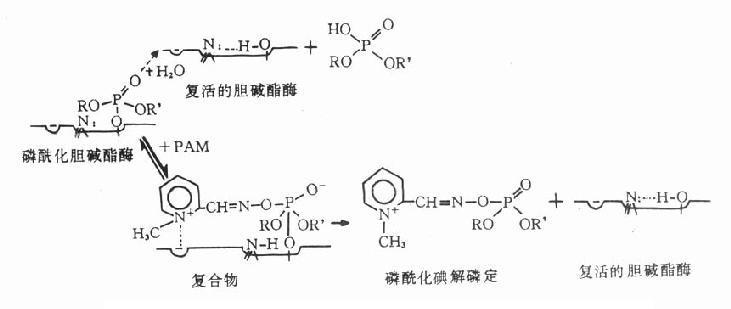
图7-4 碘解磷定复活胆碱酯酶过程示意图
磷酰化胆碱酯酶水解率很低(用┄ →表示),与PAM作用后产生复合物,
后者进一步裂解成胆碱酯酶和磷酰化解磷定,胆碱酯酶因而复活
此外,碘解磷定也能与体内游离的有机磷酸酯类直接接合,成为无毒的磷酰化碘解磷定,由尿排出,从而阻止游离的有机磷酸脂类继续抑制胆碱酯酶。
【解毒疗效】碘解磷定使酶复活的效果因不同有机磷酸酯类而异,例如对内吸磷、马拉硫磷和对硫磷中毒的疗效较好,对敌百虫、敌敌畏中毒的疗效稍差,而对乐果中毒则无效。因乐果中毒时所形成的磷酰化胆碱酯酶比较稳定,几乎是不可逆的,加以乐果乳剂含有苯,可能同时有苯中毒。
碘解磷定类恢复酶活性作用对骨骼肌最为明显,能迅速制止肌束颤动;对植物神经系统功能的恢复较差。对中枢神经系统的中毒症状(如昏迷)似也有疗效。
由于碘解磷定不能直接对抗体内积聚的乙酰胆碱的作用,故应与阿托品合用,以便及时控制症状。动物实验证明;单用碘解磷定仅能提高对氧磷(为内吸磷在体内的活性体)对小鼠致死量至2~4倍;单用阿托品时,也只提高2倍;两者合用时可提高128倍。
【体内过程】静脉注射后在肝、肾、脾、心等器官的念量较多,肺、骨骼肌和血中次之。从临床对中枢症状有效来看,似有少量进入脑内的可能。本药由肾脏排泄,部分在肝代谢。静脉注射碘解磷定后,30分钟内即有原形药物由尿中排出,6小时内约排出80%,故治疗中毒时需足量和反复给药。
【不良反应】一般治疗量时,毒性不大,但如静脉注射过快和剂量超过2g时,可产生轻度乏力、视力模糊、眩晕,有时出现恶心、呕吐和心动过速等。偶有咽痛和其它碘反应。剂量过大,碘解磷定本身也可抑制胆碱酯酶,加重有机磷酸酯类的中毒程度。
氯磷定
氯磷定(pyraloximemethylchloride, PAM-CI)的药理作用和用途与碘解磷定相似,但水溶性高,溶液较稳定,可肌内注射或静脉给药。特别适用于农村基层使用和初步急救。氯磷定经肾排泄也较快,生物t1/2约1.5小时。副作用较碘解磷定小,偶见轻度头痛、头晕、恶心、呕吐等。
由于氯磷定给药方便,不良反应较小,现已逐渐取代了碘解磷定。
第四节 有机磷酸酯类中毒的防治
1.预防按照预防为主的方针,如能严格执行农药的管理制度,加强生产及使用农药的劳动保护措施,有机磷酸酯类农药中毒是可以预防的。
2.急性中毒的治疗
(1)迅速消除毒物以免继续吸收发现中毒时,应立即将患者移出有毒场所。对经皮肤侵入的中毒者,应清洗皮肤,最好用温水和肥皂彻底清洗。经口中毒时,应首先抽出胃液和毒物,并立即以微温的2%碳酸氢钠溶液或1%食盐水反复洗胃,直至洗出液不再有有机磷农药的特殊气味为止。然后再给硫酸镁导泻。敌百虫口服中毒时不能用碱性溶液洗胃,因它在碱性溶液中可转化成敌敌畏而增加毒性。眼部染毒,可用2%碳酸氢钠溶液或0.9%盐水冲洗数分钟。
(2)积极使用解毒药须及早、足量、反复地注射阿托品,能迅速解除有机磷酸酯类中毒时的M样症状,缓解呼吸道和胃肠道平滑肌的兴奋性;也能解除一部分中枢神经系统中毒症状,使昏迷病人苏醒。此外,大剂量阿托品还具阻断神经节作用,从而对抗有机磷酸酯类的兴奋神经节的作用。但阿托品对N2受体无效,因此不能制止骨骼肌震颤,对中毒晚期的呼吸肌麻痹也无效,也无复活胆碱酯酶作用,疗效不易巩固。因此须与胆碱酯酶复活药合用,对中度和重度中毒病例,更须如此。但在两药合用的患者,当胆碱酯酶复活后,机体可恢复对阿托品的敏感性,易发生阿托品中毒。因此,两药合用时,应适当减少阿托品的剂量。
3,慢性中毒的治疗对慢性中毒,目前尚无特殊治疗方法,使用阿托品和解磷定类药物,疗效并不理想。对生产工人,或经常接触者,当血中胆碱酯酶活性下降至50%以下时,应暂时脱离与有机磷酸酯类的接触,以免中毒。
胆碱酯酶药和胆碱酯酶复活药 制剂及用法
水杨酸毒扁豆碱(physostigmine salicylate) 滴眼液或眼膏, 0.25%,每4小时一次,或按需要决定滴眼次数,溶液变红色后不可用。
溴化新斯的明(neostigmine bromide)口服,15mg/次,3次/日或按需要而定。极量:30mg/次,100mg/日。
甲基硫酸新斯的明(neostigmine methylsulfate) 皮下或肌内注射,0.25~0.5mg/次,极量,1mg/次。
溴吡斯的明(phyridostigmine bromide)口服,60mg/次,3次/日,极量,120mg/次,360mg/日。
氢溴酸加兰他敏(galanthamine hydrobromide)肌内注射,2.5~10mg/次,1次/日。
碘解磷定(pyraloxime methoiodide)0.5~1g/次,缓慢静脉注射。
氯磷定(pyraloxime methylchloride)0.25~0.75g/次,肌内注射。0.5~0.75g/次,加于等渗盐水500ml中,静脉滴注。
第八章 胆碱受体阻断药(Ⅰ)M胆碱受体阻断药
第一节 阿托品和阿托品类生物碱
胆碱受体阻断药(cholinoceptorblocking drugs)能与胆碱受体结合而不产生或极少产生拟胆碱作用,却能妨碍乙酰胆碱或胆碱受体激动药与胆碱受体的结合,从而拮抗拟胆碱作用。按其对M和N受体选择性的不同,可分为M1,M2,M3胆碱受体阻断药和N1,N2胆碱受体阻断药。按用途的不同,可分为平滑肌解痉药,神经节阻断药,骨骼肌松弛药和中枢性抗胆碱药。本章先讨论以阿托品为代表的M胆碱受体阻断药。
【来源与化学】 从植物中提取的M胆碱受体阻断药有阿托品、东莨菪碱和山莨菪碱等,其植物来源如表8-1。天然存在于植物的是左旋莨菪碱,在提取过程中,得到比较稳定的消旋莨菪碱,即阿托品。东莨菪碱是左旋品。左旋体较其右旋体作用强许多倍。
表8-1 阿托品类生物碱及其来源
| 植物名称 | 主要生物碱 |
| 颠茄(Atropa belladonna) | 莨菪碱 |
| 曼陀罗(Datura stramonium) | 莨菪碱 |
| 洋金花(Datura sp) | 东莨菪碱 |
| 莨菪(Hyoscyamus niger) | 莨菪碱 |
| 唐古特莨菪(Scopolia tangutica) | 山莨菪碱 |
阿托品及东莨菪碱的化学结构
阿托品
【药理作用】阿托品(atropine)的作用机制为竞争性拮抗乙酰胆碱或胆碱受体激动药对M胆碱受体的激动作用。阿托品与M胆碱受体结合,因内在活性很小,一般不产生激动作用,却能阻断乙酰胆碱或胆碱受体激动药与受体结合,结果拮抗了它们的作用。阿托品对M受体有相当高的选择性,但很大剂量或中毒剂量也有阻断神经节N1受体的作用。阿托品对各种M受体亚型的选择性较低,对M1,M2,M3受体都有阻断作用。
阿托品的作用非常广泛,各器官对阿托品敏感性不同。随剂量的增加可依次出现下列现象:腺体分泌减少,瞳孔扩大和调节麻痹,膀胱和胃肠道平滑肌的兴奋性下降,心率加快,中毒剂量则出现中枢作用。现依次叙述如下:
1.腺体 阿托品因阻断M胆碱受体而抑制腺体分泌;唾液腺和汗腺最敏感,在用0.5mg阿托品时,就显著受抑制,引起口干和皮肤干燥,同时泪腺和呼吸道分泌也大为减少。较大剂量可减少胃液分泌,但对胃酸浓度影响较小,因胃酸分泌还受体液因素如胃泌素的调节,同时又因胃中HCO3-的分泌也受到抑制。
2.眼 阿托品阻断M胆碱受体,因而使瞳孔括约肌和睫状肌松弛,出现扩瞳、眼内压升高和调节麻痹(图6-1),导致畏光。这些作用在局部滴眼和全身给药时,都可出现,需要注意。
(1)扩瞳阿托品松弛瞳孔括约肌,故使去甲肾上腺素能神经支配的瞳孔扩大肌的功能占优势,从而扩瞳。
(2)眼内压升高由于瞳孔扩大,使虹膜退向四周边缘,因而前房角间隙变窄,阻碍房水回流入巩膜静脉窦,造成眼内压升高。因此阿托品禁用于青光眼或有眼内压升高倾向者。
(3)调节麻痹阿托品能使睫状肌松弛而退向外缘,从而使悬韧带拉紧,使晶状体变为扁平,其折光度减低,只适于看远物,而不能将近物清晰地成像于视网膜上,故看近物模糊不清,这一作用称为调节麻痹。
3.平滑肌阿托品能松弛许多内脏平滑肌,对过度活动或痉挛的内脏平滑肌,松弛作用较显著。它可抑制胃肠道平滑肌的强烈痉挛,降低蠕动的幅度和频率,缓解胃肠绞痛;对膀胱逼尿肌也有解痉作用;但对胆管、输尿管和支气管的解痉作用较弱。胃肠道括约肌的反应主要取决于括约肌的机能状态。例如胃幽门括约肌痉挛时,阿托品具有松弛作用,但作用不显著和不恒定。阿托品对子宫平滑肌影响较小。
4.心脏
(1)心率 治疗剂量阿托品(0.5mg)在一部分病人可使心率轻度短暂地减慢,一般每分钟减少4~8次,这可能是阿托品阻断突触前膜M1受体,从而减少突触中Ach对递质释放的抑制作用所致。较大剂量(1~2mg)则阻断窦房结起搏点的M2受体,解除迷走神经对心脏的抑制作用,使心率加速,加速程度取决于迷走神经张力;在迷走神经张力高的青壮年,心率加速作用显著,如肌内注射2mg阿托品,心率可增加35~40次/分。
(2)房室传导阿托品能拮抗迷走神经过度兴奋所致的传导阻滞和心律失常。但在心肌梗塞时,要慎用阿托品,由于其加速心率,加重心肌缺血缺氧,可能会激发室颤。
5.血管与血压治疗量阿托品对血管与血压无显著影响,这可能因许多血管缺少胆碱能神经支配。大量阿托品有解除小血管痉挛的作用,尤其以皮肤血管扩张为显著,可产生潮红温热。扩血管作用的机制未明,但与抗M胆碱作用无关,可能机体对阿托品所引起的体温升高的代偿性散热反应,也可能是阿托品的直接扩张血管的作用。
6.中枢神经系统 较大剂量1~2mg可较度兴奋延髓和大脑,2~5mg时兴奋加强,出现焦虑不安、多言、谵安;中毒剂量(如10mg以上)常致幻觉、定向障碍、运动失调和惊厥等,也可由兴奋转入抑制,出现昏迷及呼吸麻痹。
【体内过程】口服吸收迅速,1小时后血药浓度即达峰值,生物处用度为50%,t1/2为4小时,作用可维持约3~4小时。吸收后很快离开血液而分布于全身组织,可透过血脑屏障,也能通过胎盘进入胎儿循环。阿托品从其它粘膜也可吸收。肌内注射后12小时内有85%~88%经尿排出,其中原形阿托品约占1/3,其余为水解和与葡萄糖醛酸结合的代谢物,在粪及其它分泌物包括乳汁中仅发现少量阿托品。
【临床应用】阿托品在临床上有广泛的用途。
1.解除平滑肌痉挛适用于各种内脏胶痛,如胃肠绞痛及膀胱刺激症状如尿频、尿急等,疗效较好。对胆绞痛及肾绞痛的疗效较差。在治疗这两种绞痛时,常和吗啡类镇痛药合用。用阿托品治疗遗尿症,是利用其松弛膀胱逼尿肌的作用。一般用硫酸阿托品0.5~1mg皮下注射,对于轻症可口服其0.3mg的片剂,也可口服更温和的含莨菪碱颠茄酊或复方颠茄片(见制剂及用法项)。
2.制止腺体分泌用于全身麻醉前给药,以减少呼吸道分泌,防止分泌物阻塞呼吸道及吸入性肺炎的发生,也可用于严重的盗汗和流涎症。
3.眼科
(1)虹膜睫状体炎 0.5%~1%阿托品溶液滴眼,松弛虹膜括约肌和睫状肌,使之充分休息,有利于炎症的消退;同时还可预防虹膜与晶体的粘连。
(2)检查眼底如需扩瞳,可用阿托品溶液滴眼,但因其扩瞳作用可维持1~2周,调节麻痹也可维持2~3天,视力恢复较慢,目前常以作用较短的后马托品溶液取代之。
(3)验光配眼镜滴用阿托品类可使睫状肌的调节功能充分麻痹,晶状体固定,以便正确地检验出晶状体的屈光度,但阿托品作用持续时间过长,现已少用。只有儿童验光时,仍用之。因儿童的睫状肌调节机能较强,须阿托品发挥充分的调节麻痹作用。
4.缓慢型心律失常临床上常用阿托品治疗迷走神经过度兴奋所致窦房阻滞、房室阻滞等缓慢型心律失常,还可用于治疗继发于窦房结功能低下而出现的室性异位节律。
5.抗休克对暴发型流行性脑脊髓膜炎、中毒性菌痢、中毒性肺炎等所致的感染性休克,可用大剂量阿托品治疗,可能解除血管痉挛,舒张外周血管,改善微循环。对于休克伴有心率过速或高烧者,不用阿托品。
6.解救有机磷酸酯类中毒(见第七章)和有些毒蕈类的中毒。
【不良反应及中毒】阿托品的作用广泛,当利用某一作用时,其它作用便成为副作用,这应预先告诉病人,以免惊慌。不同剂量的阿托品的不良反应表现大致如下:
0.5mg:轻微心率减慢,略有口干及乏汗;1mg:口干,心率加速,瞳孔轻度扩大;2mg:心悸,显著口干,瞳孔扩大,有时出现视近物模糊;5mg:上述症状加重,语言不清,烦躁不安,皮肤干燥发热,小便困难,肠蠕动减少;10mg以上:上述症状更重,脉速而弱,中枢兴奋现象严重,呼吸加快加深,出现谵安、幻觉、惊厥等。严重中毒时,可由中枢兴奋转入抑制,产生昏迷和呼吸麻痹等。
阿托品的最低致死量在成人约为80~130mg ,儿童约为10mg。
误服中毒量的颠茄果、曼陀罗果、洋金花或莨菪根茎等,也可逐次出现上述症状。中毒的解救除洗胃排出胃内药物等措施外,可注射新斯的明、毒扁豆碱或毛果芸香碱等。当解救有机磷酸酯类的中毒而用阿托品过量时,当然不能用新斯的明、毒扁豆碱等抗胆碱酯酶药。中枢症状明显时,可用安定或短效巴比妥类,但不可过量,以避免与阿托品类药的中枢抑制作用产生协同作用。
【禁忌证】青光眼及前列腺肥大者禁用,后者因其可能加重排尿困难。老年人慎用。
山莨菪碱
山莨菪碱(anisodamine)是我国从茄科植物唐古特莨菪中提出的生物碱。
山莨菪碱对抗乙酰胆碱所致的平滑肌痉挛和抑制心血管的作用,与阿托品相似而稍弱,同时也能解除血管痉挛,改善微循环。但它的抑制唾液分泌和扩瞳作用则仅为阿托品的1/20~1/10。还因不易穿透血脑屏障,中枢兴奋作用很少。和阿托品相比,其毒性较低,解痉作用的选择性相对较高,副作用与阿托品相似。适用于感染性休克、内脏平滑肌绞痛。青光眼禁用。
东莨菪碱
东莨菪碱(scopolamine)对中枢神经的抑制作用较强,小剂量主要表现为镇静,较大剂量时,则致催眠作用。个别人可能出现不安、激动等类似阿托品的兴奋症状。主要用于麻醉前给药。此外还有抗晕动病和抗震颤麻痹的作用和用途。防晕作用可能和抑制前庭神经内耳功能或大脑皮层及抑制胃肠道蠕动有关,可与苯海拉明合用以增加效果。预防性给药效果好,如已发生呕吐再用药则疗效差。也用于妊娠呕吐及放射病呕吐。对震颤麻痹症有缓解流涎、震颤和肌肉强直的效果,可能与其拮抗中枢神经的乙酰胆碱作用有关。
我国医药工作者阐明了中药麻醉处方的主要药物洋金花,而洋金花的主要成分就是东莨菪碱。故也用东莨菪碱来代替洋金花作为中药麻醉剂。
本品的外周作用和阿托品相似,仅在作用强度上略有不同。扩瞳、调节麻痹和抑制腺体分泌较阿托品强,而对心血管作用较弱。由于能升高眼内压,故青光眼患者忌用。
第二节 阿托品的合成代用品
由于阿托品用于眼科作用太持久,用于内科,副作用又较多,针对这些缺点,通过改变其化学结构,合成了不少代用品,主要有两类,即扩瞳药和解痉药。
近年尚出现一类以哌仑西平(pirenzepine)为代表的M1受体阻断药,选择性地抑制胃酸分泌,用于消化性溃疡病,成为一种新类型。
一、合成扩瞳药
后马托品和托吡卡胺
后马托品(homatropine)的扩瞳作用与调节麻痹作用都比阿托品明显短暂,调节麻痹作用约在用药后24~36小时消退,适用于一般眼科检查。其调节麻痹作用高峰出现较快,但不如阿托品完全,特别是对于儿童。托吡卡胺(tropicamide)的特点是起效快而持续时间最短。
表8-2 几种扩瞳药滴眼作用的比较
| 药 物 | 浓度(%) | 扩瞳作用 | 麻痹调节作用 | ||||
| 高峰(分) | 消退(日) | 高峰(小时) | 消退(日) | ||||
| 硫酸阿托品 | 1.0 | 30~40 | 7~10 | 1~3 | 7~12 | ||
| 氢溴酸后马托品 | 1.0 | 40~60 | 1~2 | 0.5~1 | 1~2 | ||
| 托吡卡胺 | 0.5~1.0 | 20~40 | 1/4 | 1/2 | 90 | >90 | >90 |
| 生物利用度(%) | 10~20 | 60~70 | 20 | ||||
| 起效时间(分) | iv 1 | 舌下3 | 舌下3 | ||||
| 口服(分) | |||||||