组织学
第一章 组织学绪论
一、组织学发展概况及研究内容与意义
组织学(histology)与胚胎学(embryology)是相互关联的两门学科,我国医学教育习惯地将它们列为一门基础课程。组织学是研究机体微细结构及其相关功能的科学,它是以显微镜观察组织切片为基本方法的,故又称显微解剖学(microanatomy)。从细胞的发现和细胞学说的建立起始,组织学发展迄今为已有300余年历史。英国人Hooke(1635~1703)用放大镜观察软木塞薄片,首先描述了细胞壁所成的小室,称之为“cell”。意大利人Malpighi(1628~1694)用放大镜观察了脾、肺、肾等的组织结构,荷兰人Leeuwenhoek(1632~1723)用较高倍的放大镜发现了精子、红细胞、肌细胞、神经细胞等,荷兰人Graaf(1641~1673)观察报道了卵泡。法国人Bichat(1771~1822)用放大镜观察肉眼解剖的组织,并于1801年发表的“膜的研究”一文,首次提出“组织”(法文tissu,原意为编织物)一词,还将人体的组织分为21种。德国人Meyer(1819)又将组织重新分类为8种,并创用Histology一词。Brown(1831)进而发现了细胞核,对细胞的结构有了初步的认识。在有机体结构长期研究和争议的基础上,德国学者Schleiden(1804~1881)和Schwann(1810~1882)于1838~1839年分别指出细胞是一切植物和动物的结构、功能和发生的重要单位,创立了细胞学说,成为组织学、胚胎学、生理学、病理学等生命科学发展的重要里程碑,被誉为是19世纪自然科学的三大发现(细胞学说、物质和能量守恒定律、达尔文进化论)之一。此后不久,德国学者Virchow(1821~1902)于1858指出细胞只源于细胞,细胞损害是一切疾病的基础,建立了细胞病理学说,使细胞学说更趋完善。19世纪中期以后,随着光学显微镜、切片技术及染色方法的不断改进与充实,推进组织学的继续发展。本世纪初至中期,陆续制成相差显微镜、偏光显微镜、暗视野显微镜、荧光显微镜、紫外光显微镜等特殊显微镜,并用之于组织学研究;与此同时,组织化学、组织培养、放射自显影等技术也渐建立和完善并广泛应用,组织学研究更趋深入,资料日益丰富。本世纪40年代电子显微镜问世,并不断改进,至今已广泛用于观察细胞和组织的微细结构及其不同状态下的变化,使人类对生命现象结构基础的认识深入到更微细的境界,其中许多重要资料已列为现代组织学的基本内容。
我国组织学研究起始于本世纪之初,组织学是从人体解剖学分化出来的一门较年轻的科学。我国老一辈组织学家如马文昭(1886~1965)、鲍鉴清(1893~1982)、王有琪(1899~)、张作干(1907~1969)、李肇特(1913~)、薜社普(1917~)等,他们在学科建设、科学研究和人才培养等方面做出了历史性贡献。
近30年科学技术发展更为迅猛,许多新技术、新设备不断涌现并用之于细胞学和组织学的研究,诸如免疫细胞化学术、单克隆技术、细胞分离术、细胞融合术、显微分光光度计、图像分析仪与立体计量术、同位素示踪术、流式细胞术、蛋白质和核酸的分离提取及原位检测、原位杂交等核酸分子杂交术、X-射线衍射技术、X-射线显微分析术,以及分子重组与基因工程等。这些新技术大多与计算机技术相结合,对细胞进行微观和微量的定性和定量分析,使组织学的研究进入更深入而广阔的境地。
组织(tissue)是由细胞(cell)和细胞间质(intercellular substance)组成,众多细胞由细胞间质组合在一起构成一细胞群体。细胞是组织的结构和功能单位,高等动物和人体的细胞有成百上千种类型,各种细胞具有一定的形态结构特点,合成与功能相关的特殊蛋白质,表达某种代谢特点和功能活动,即为细胞的表现型(phenotype)。细胞间质是由细胞产生的非细胞物质,包括纤维、基质和不断流动的体液(血浆、淋巴、组织液等),它们参与构成细胞生存的微环境(microenvironment),起支持、联系、营养和保护细胞的作用,对细胞的分化、运动、信息沟通也有重要影响。组织微环境的稳定是保持细胞增殖、分化、代谢和功能活动的重要条件,微环境成分的异常变动也可使细胞发生病理变化。组织有多种类型,每种组织具有某些共同的形态结构特点和相关的功能。一般传统性将组织分为四种,即上皮组织、结缔组织、肌组织和神经组织,称为基本组织(primary tissue)。但现代组织学的研究愈来愈多地发现,一种组织内的细胞结构和功能往往是多种多样的,它们的起源也不同;因此应认识到,组织分类是一种归纳性的相对意义的概念,不能机械僵化地理解。几种组织相互结合,组成器官(organ)和系统(system),人体的组成包括神经、内分泌、免疫、循环、皮肤、感官、消化、呼吸、泌尿、生殖等系统。
医学组织学的研究对象是人体,但人体材料来源受限,尤其是许多实验性研究的开展,需选用实验动物为材料。应用显微镜观察机体的组织结构及其形态演变,称为描述组织学。一般光学显微镜下所见的结构,称光镜结构;电子显微镜下显示的结构,称超微结构(ultrastructure)研究不同动物种系的组织结构和功能的,称为比较组织学。应用实验方法研究组织结构与功能的动态变化、理化因子或生物因子的调节或影响,以及致病、致癌等机理,秒为实验组织学。从分子水平探讨细胞和组织的功能及其异常变化的机理,则属分子生物学。
不言而喻,学习医学科学必须首先熟悉人体的结构、组成及其基本生命现象,组织学、从微观水平阐明机体的结构与相关功能,无疑是医学教育的重要入门课程之一,它为生理学、生物化学、免疫学、病理学以及临床医学等的学习奠定坚实基础。组织学是以微细结构的形态描述为其基本内容,但随着生命科学的研究不断深入,现代组织学的内容与60年代相比已发生巨大变化。它的内容不断充实、更新和扩展,不仅形态观察更微细深入,而且涉及的领域更为广阔,从整体水平、细胞水平和分子水平探索许多复杂生命现象的物质基础以及环境与生物体的相互关系;不仅与现代生物学和医学的许多重大理论进展相关,而且与人类社会面临的众多实际问题和疾病防治密切相关。诸如:细胞增殖与分化的调控,细胞突变、癌变与逆转,细胞运动与迁移,细胞识别与通讯,细胞与组织的移植,细胞与组织的衰老,细胞与免疫、组织与器官的再生,神经调节与体液调节,环境污染与组织病变等等。这些问题的研究与解决,都需要多学科的密切协作和高技术的综合应用,组织学也处于当代生命科学各学科相互交叉的网络中,与分子生物学、细胞生物学、生理学、生物化学、生物物理学、免疫学、病理学、肿瘤学、环境毒理学等,理论上相互关联渗透,技术上相互引用促进,关系日益密切。在基础医学各门课程的教学中,处处可看到现代医学的这种发展势头。
二、组织学研究方法
(一)一般光学显微镜术
应用一般光学显微镜(简称光镜)观察组织切片是组织学研究的最基本方法。取动物或人体的新鲜组织块,先用固定剂(fixative)固定(fixation),使组织中的蛋白质迅速凝固,防止细胞自溶和组织腐败。常用的固定剂如洒精、甲醛、醋酸、苦味酸、四氧化锇等,一般常将几种固定剂配制成混合固定液,以抵消或减弱单种固定剂对组织的收缩或膨胀等缺点,达到更好固定效果。固定后的组织块(约3~5mm3大小)用石蜡、火棉胶或树脂等包埋(embedding)成硬块,以切片机(microtome)切成5~10μm厚的组织切片(tissue section),切片贴在载玻片上经脱蜡等步骤后进行染色。组织块也可立即投入液氮(-196℃)内快速冻结,用恒冷箱切片机(cryostat)制成冷冻切片(frozen section),这种方法制片迅速,细胞内酶活性保存较好,常用于酶组织化学染色。血细胞和分离培养的细胞可直接涂在玻片上,制成涂片(smear)。疏松结缔组织和肠系膜等软组织可撕成薄片铺在玻片上(铺片),牙和骨等坚硬组织可磨成薄片(磨片)。组织切片等标本经染色、透明后,以封固剂和盖片封固,即可长期保存,镜下观察。
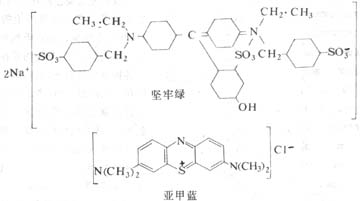
图1-1 坚牢绿(酸性染料)与亚甲蓝(碱性染料)的化学结构及其染色反应示意
染色(staining)是用染料使组织切片着色,便于镜下观察。天然和人工合成的染料甚多,它们都是含发色团的有机化合物,当染料具有助色团成为盐类物质,即可溶解于水并具电荷,与组织有亲合力,使组织着色。含氨基(-NH2)、二甲氨基〔-N(CH3)2〕等碱性助色团的染料,称碱性染料(basic dye),它的盐溶液具阳电荷;含羧基(-COOH)、羟基(-OH)或磺基(-SO3H)等酸性助色团的染料,称酸性染料(acid dye),它的溶液具阴电荷(图1-1)。组织的染色原理一般认为基于化学结合或物理吸附作用。细胞和组织的酸性物质或结构与碱性染料亲合力强者,称嗜碱性(basophilia);而碱性物质或结构与酸性染料亲合力强者,称嗜酸性(acidophilia);若与两种染料的亲合力均不强者,称中性(neutrophilia)。组织的基本成分是蛋白质,构成蛋白质的氨基酸常是即有含氨基的,也有含羧基的,是两性电解质。各种蛋白质的等电点因氨基酸成分的不同而异,其电荷性质又与溶液的pH值相关,根据研究目的选用合适的染色方法,调整好染液的pH值,即可取得良好染色效果。常用的酸性染料如伊红、坚牢绿、橙黄G等,碱性染料如苏木精、亚甲蓝、碱性品红等。组织学中最常用的是苏木精(hematoxylin)和伊红(eosin)染色法,简称HE染色法。苏木精使细胞核和胞质内的嗜碱性物质着蓝紫色,伊红使细胞质基质和间质内的胶原纤维等着红色。
物理吸附作用的染色方法,如用苏丹染料显示脂肪组织,染料溶于脂肪内,使细胞内的脂滴显色。又如用硝酸银、氯化金等重金属盐显示细胞和组织的某些结构,则是使金属微粒附着在结构表面而呈棕黑色或棕黄色。银染法中有些组织结构可直接使硝酸银还原而显示,称此为亲银性(argentaffin);有些结构无直接还原作用,需加入还原剂方能显色,则称为嗜银性(argyrophilia)。还有些组织成分如结缔组织和软骨基质中的糖氨多糖,当用甲苯胺蓝(toluidine blue)等碱性染料染色后呈紫红色,这种现象称为异染性(metachromasia),其原理可能是该染料在溶液中呈单体状态时显蓝色,当它与多阴离子的高分子物质耦合后,染料分子聚合成多聚体而显红色(图1-2)。还有些染色方法的原理至今还不清楚。
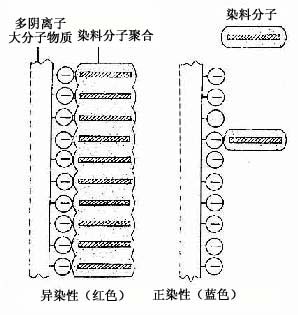
图1-2 异染性示意图
(二)几种特殊显微镜的应用
1.荧光显微镜 荧光显微镜(fluorescence microscope)是用来观察标本中的自发荧光物质或以荧光素染色或标记的细胞和结构。荧光显微镜是以高压汞灯产生的短波紫外线为光源,并配有激发、阻断、吸热和吸收紫外线等滤片系统,标本中的荧光物质在紫外线激发下产生各种颜色的荧光,借以研究该荧光物质在细胞和组织内的分布。组织中的自发性荧光物质如神经细胞和心肌细胞等内的脂褐素呈棕黄色荧光,肝贮脂细胞和视网膜色素上皮细胞内的维生素A呈绿色荧光,某些神经内分泌细胞和神经纤维内的单胺类物质(儿茶酚胺、5-羟色胺、组胺等)在甲醛作用下呈不同颜色的荧光,组织内含有的奎宁、四环素等药物也呈现一定的荧光。细胞内的某些成分可与荧光素结合而显荧光,如溴化乙锭与吖啶橙可与DNA综合,进行细胞内DNA含量测定。荧光显微镜更广泛用于免疫细胞化学研究,即以异硫氰酸或罗丹明等荧光素标记抗体(一抗或二抗),用该标记抗体直接或间接地与细胞内的相应抗原结合,以检测该抗原的存在与分布。
2.相差显微镜 相差显微镜(phase contrast microscope)是用于观察组织培养中活细胞形态结构的。活细胞无色透明,一般光镜下不易分辨细胞轮廓及其结构。相差显微镜的特点是将活细胞不同厚度及细胞内各种结构对光产生的不同折射作用,转换为光密度差异(明暗差),使镜下结构反差明显,影像清楚。组织培养研究常用的是倒置相差显微镜(inverted phase contrast microscope),它的光源和聚光器在载物台的上方,物镜在载物台的下方,便于观察贴附在培养器皿底壁上的活细胞。
3.暗视野显微镜 暗视野显微镜(dark-field microscope)主要用于观察因反差或分辨力不足的微小颗粒。此种显微镜主要是有一个暗视野集光器,使光线不直接进入物境,故呈暗视野。而标本内的小颗粒产生的衍射光或散射光进入物镜,暗视野中的颗粒呈明亮小点,如同在暗室可见一束光线中的微小尘粒一般。普通通光镜最大分辨率为0.2μm,暗视野显微镜则可分辨0.004~0.2μm的微粒,适用于观察细胞内线粒体运动及标本中细菌等微粒的运动等。
4.共集激光扫描显微镜 共焦激光扫描显微镜(confocal laser scanning microscope,CLSM)是近10年研制成的高光敏度、高分辨率的新型仪器。它以激光为光源,光束经聚焦后落在样品(组织厚片或细胞)不同深度的微小一点,并作移动扫描,通过电信号彩色显像,经过微机图像分析系统进行二维和三维分析处理。CLSM可对细胞进行三维结构图像分析,细胞内各种荧光标记物的微量分析,细胞内Ca2+、pH值等的动态分析测定,细胞的受体移动、膜电位变化、酶活性和物质转运的测定,并以激光对细胞及其染色体进行切割、分离、筛选和克隆。因此,CLSM是一种高技术产品,可对细胞的多种功能进行全自动、高效、快速的微量定性和定量测定。
其他如偏光显微镜用于研究组织晶体物质及纤维等的光学性质,紫外光显微镜用于研究细胞内核酸的分布与定量等。
(三)组织化学和细胞化学术
组织化学(histochemistry)和细胞化学(cytochemistry)技术是通过化学或物理反应原理显示组织切片细胞内某种化学成分,进行定位、定量及其与功能相关的研究。如糖类、脂类、酶、核酸等与试剂发生化学物理反应,形成有色终末产物,在光镜下观察,有的可在电镜下观察。
1.糖类显示多糖和蛋白多糖的常用方法是过碘酸-雪夫反应(periodic acid Schiff reaction,PAS反应)。基本原理是过碘酸的氧化作用先使糖分子的乙二醇基变为乙二醛基,后者继而与Schiff试剂(无色亚硫酸品红复合物)结合,形成紫红色反应产物(图1-3)。颜色反应的深浅取决于组织内多糖的乙二醇分子的多寡。
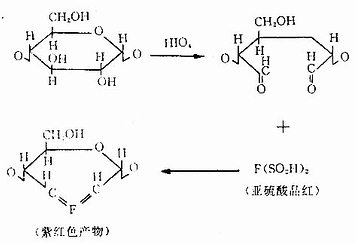
图1-3 PAS反应原理示意图
2.脂类脂类物质包括脂肪和类脂。标本用甲醛固定,冷冻切片,脂类保存较好。多用苏丹染料、油红O、尼罗蓝等溶于脂类的染料染色,使脂质呈色。也可用四氧化锇(OSO4)染色,脂肪酸或胆碱可使OSO4还原为OSO2而呈黑色。
3.酶细胞内的酶种类甚多,有氧化还原酶、水解酶、合成酶、转移酶等几类,目前已有100多种酶组织化学染色法。酶组化反应的基本原理是利用酶对其相应底物的水解、氧化等作用,然后再使底物的反应产物与某种捕获剂发生反应,形成沉淀或有色的最终产物,借此检测该酶在组织切片或细胞内的分布及活性强弱。如细胞的磷酸酶是一种重要的水解酶,碱性磷酸酶(ALP)和酸性磷酸酶(ACP)在合适的pH条件下可水解有机磷酸脂。小肠上皮细胞表面的纹状缘和肾近曲小管表面的刷状缘处,微绒毛含有丰富的ALP,与物质的吸收和转运功能相关;许多细胞的溶酶体内则含大量ACP,参与细胞内物质代谢。这两种酶均可以β-甘油磷酸钠为底物,底物被水解产生磷酸根,再以Ca2+、Co2+(显示ALP)或Pb2+(显示ACP)捕获磷酸根,最后用硫化铵处理,即形成硫化钴或硫化铅黑色最终产物,出现在组织切片中该酶存在的部位。因此,酶组化染色不是酶本身的直接显色,而是酶作用底物的化学反应产物显色的。
4.核酸 显示DNA的传统方法是Feulgen反应,切片先用稀盐酸处理,使DNA分子中脱氧核糖与嘌呤之间的连接键打开,形成醛基,再与Schiff 试剂作用,原理同PAS反应,使细胞核DNA显紫红色。还可用甲基绿-焦宁染色法同时显示DNA和RNA,这两种染料都是碱性,甲基绿使细胞核内的DNA呈蓝绿色,焦宁使细胞质和核仁内的RNA呈红色。
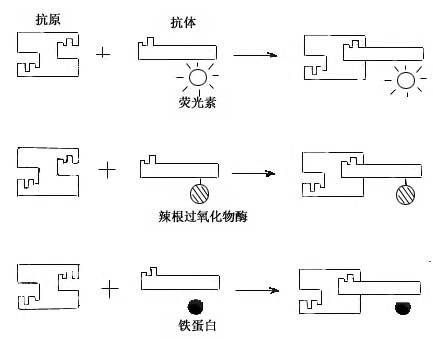
图1-4 免疫细胞化学术示意图
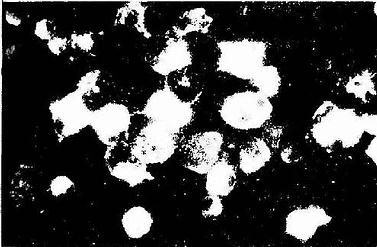
图1-5 人呼吸道分离上皮细胞粘蛋白免疫荧光像
(美国戴维斯加州大学 吴忍教授供图)
(四)免疫细胞化学术
免疫细胞化学(immunocytochemistry)术是应用抗原与抗体结合的免疫学原理,检测细胞内多肽、蛋白质及膜表面抗原和受体等大分子物质的存在与分布。这种方法特异性强,敏感度高,进展迅速,应用广泛,成为生物学和医学众多学科的重要研究手段。近年随着纯化抗原和制备单克隆抗体的广泛开展以及标记技术不断提高,免疫细胞化学的进展更是日新月异,不仅用于许多基本理论的研究,并取得重大突破,而且也用于疾病的早期快速诊断等临床实际。组织的多肽和蛋白质种类繁多,具有抗原性。分离纯化人或动物组织某种蛋白质,作为抗原注入另一种动物体内,后者即产生相应的特异性抗体(免疫球蛋白)。从被免疫动物的血清中提取出该抗体,再以荧光素、酶、铁蛋白或胶体金标记,用这种标记抗体处理组织切片或细胞,标记抗体即与细胞的相应蛋白质(抗原)发生特异性结合(图1-4)。常用的荧光素是异硫氰酸荧光素(FITC)和四甲基异硫氰酸罗丹明(TRITC),在荧光显微镜下可观察荧光抗体抗原复合物(图1-5)。常用的酶是辣根过氧化物酶(horseradish peroxidase,HRP,从辣根菜中提取的),它的底物是3,3-二氨基、联苯胺(DAB)和H2O2,HRP使DAB氧化形成棕黄色产物,可在光镜和电镜下观察(图1-6)。铁蛋白和胶体金标记抗体与抗原的结合,也可在光镜和电镜下观察(图1-7)。
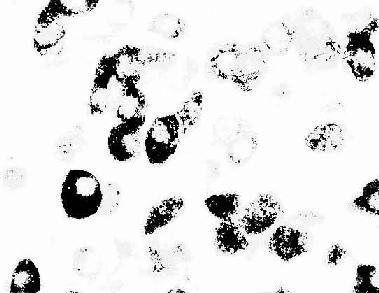
图1-6 大鼠腺垂体免疫组织化学(PAS法)示生长激素细胞
(上海医科大赵培林教授供图)
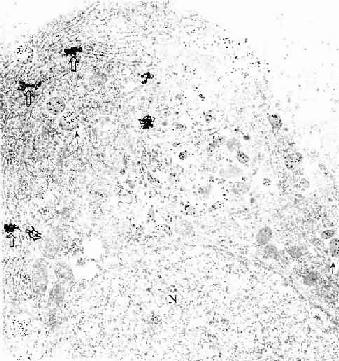
图1-7 免疫细胞化学(蛋白A-胶体金法)和原位杂交术示大鼠垂体
催乳素细胞电镜像 N催乳素细胞核
↑分泌颗粒内显示金粒
粗面内质网(RER)显示银粒
(加拿大Douglas医院研究中心童毅爱博士赠图)
标记抗体民被检抗原的结合方式有两种。一是直接法,即如上述用标记抗体与样品中的抗原直接结合(图1-8)。这种方法操作简便,但敏感度不及间接法。间接法是将分离的抗体(第一抗体简称一抗)再作为抗原免疫另一种动物,制备该抗体(抗原)的抗体(第二抗体简称二抗),再以标记物标记二抗。先后以一抗和标记二抗处理样品,最终形成抗原一抗-标记二抗复合物(图1-8)。间接法中的一个抗原分子可通过一抗与多个标记二抗相结合,因此它的敏感度较高,而且目前国内外均有多种标记二抗商品供应,使用方便。间接法中较常用的是一种称之为过氧化物酶-抗过氧化物酶复合物法(peroxidase-antiperoxidase complexmethod,PAS法),该法除需一抗和二抗外,还需制备HRP标记的抗酶抗体,即以HRP作为抗原免疫动物,制成抗HRP抗体,再以HRP标记该抗体制成由3个酶分子与2个抗酶抗体组成的相当稳定的环形PAP复合物。标本先后以一抗、二抗和PAP复合物处理后,再以DAB显色,即可检测抗原的分布。此法由于细胞内的抗原通过抗体的层层放大而与多个酶分子结合,因此敏感性很强(图1-9)。
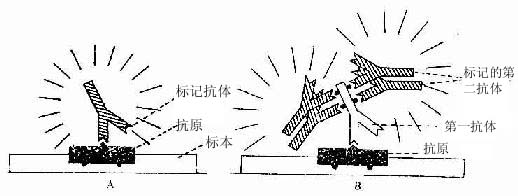
图1-8 免疫细胞化学直接法(A)与间接法(B)示意图
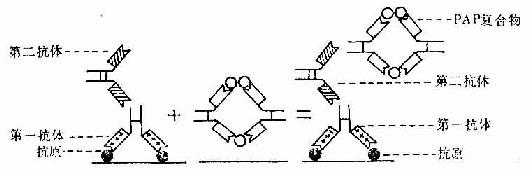
图1-9 免疫细胞化学PAP法示意图
免疫细胞化学术近10年来又有新进展,如生物素-亲合素等新颖试剂的应用,为检测微量抗原、受体、抗体开辟了新途径。生物素(biotin)又称维生素H,是从卵黄和肝中提取的一种小分子物质(分子量244.31);亲合素(avidin)又称卵白素,是从卵白中提取的一种糖蛋白(分子量68kD)。每个亲合素分子有生物素结合的4个位点,二者可牢固结合成不可逆的复合物。生物素-亲合素的应用大致有三种方法。①标记亲合素-生物素法(labelled avidin- biotin method,LAB法):将亲合素与标记物(HRP)结合,一个亲合素可结合多个HRP;将生物素与抗体(一抗与二抗)结合,一个抗体分子可连接多个生物素分子,抗体的活性不受影响。细胞的抗原(或通过一抗)先与生物素化的抗体结合,继而将标记亲合素结合在抗体的生物素上,如此多层放大提高了检测抗原的敏感性(图1-10)。②桥连亲合素-生物素法(bridged avidin-biotin method,BAB法):先使抗原与生物素化的抗体结合,再以游离亲合素将生物素化的抗体与酶标生物素搭桥连接,也达到多层放大效果(图1-10)。③亲合素-生物素-过氧化物酶复合物法(avidin-biotin-peroxidase complexmethod,ABC法);此法是前两种方法的改进,即先按一定比例将亲合素与酶标生物素结合在一起,形成亲合素-生物素-过氧化物酶复合物(ABC复合物),标本中的抗原先后与一抗、生物素化二抗、ABC复合物结合,最终形成晶格样结构的复合体,其中网络了大量酶分子,从而大大提高了检测抗原的灵敏度(图1-10)。现有配制现成的ABC药盒商品供应,操作简便,是目前广泛应用的一种方法。
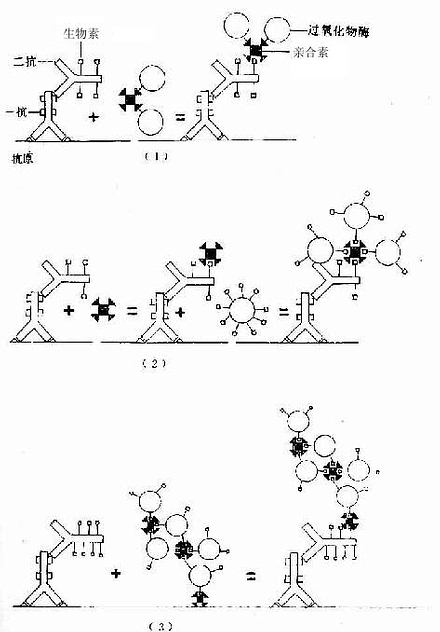
图1-10 生物素-亲合素免疫细胞化学示意图
(1)标记亲合素-生物素法
(2)桥连亲合素-生物素法
(3)亲合素-生物素-过氧化物酶复合物法(ABC法)
(五)同位素示踪术
同位素示踪术是用放射性核素的射线作用,研究细胞对某种物质的吸收、合成、转运和分泌等代谢过程。将放射性核素或其标记物注入动物体内或加入细胞培养的培养基内,细胞摄取该物质后,取被检组织制成切片或细胞涂片。可用显微镜放射自显影术(microau toradiography)检测该放射性物质在细胞内的原位分布及其代谢转归,即将薄层感光乳胶涂在切片或涂片的表面,标本在暗盒内保存一定时间后,细胞内的放射性核素产生的射线使乳胶中的溴化银还原为银粒,经显影和定影后在光镜下观察银粒的分布。β射线能量低,射程短,电离作用强,常用的β射线核素是3H、14C、32P、35S、45Ca、131I。如用3H-胸腺嘧啶核苷研究细胞DNA合成及细胞增殖动态(图1-11)。用35S-蛋氨酸研究某些腺细胞分泌物的合成与排泄,用131I-碘化钠研究甲状腺素的合成等。还可做标本中的银粒数计量或其光密度测定,进行定量分析。另外,也可用液体闪烁计数器测定分离细胞或其匀浆的放射线强度,进行定量研究。
(六)原位杂交术
原位杂交术(in situ hybridization)是一种核酸分子杂交技术,它是通过检测细胞内mRNA和DNA序列片段,原位研究细胞合成某种多肽或蛋白质的基
图1-11 大鼠肝大部切除后再生过程中增殖期肝细胞
摄取3H标记的胸腺嘧啶核苷放射自显影像
↑ 增殖期肝细胞核
因表达。其基本原理是根据两条单链核苷酸互补碱基序列专一配对的特点,应用已知碱基序列并具有标记物的RNA或DNA片段即核酸探针(probe),与组织切片或细胞内的待测核酸(RNA或DNA片段)进行杂交,通过标记物的显示,在光镜或电镜下观察目的mRNA或DNA的存在与定位。此项技术需首先制备某种核酸探针,其种类主要有三种:①利用大肝杆菌重组带有目的基因的质粒DNA,制成互补DNA探针(cDNA);②应用限制性核酸内切酶消化制成线性DNA模板,在体外转录获得反意RNA探针(cDNA);③依照待测核酸的核苷酸序列,应用DNA合成仪合成寡聚核苷酸探针。cRNA和cDNA的常用标记物有32S、32P、3H等放射性核素和荧光素、生物素、地高辛等非放射性物质。组织学应用的原位杂交术主要是染色体原位杂交和细胞原位杂交。前者是研究遗传基因、抗原基因、受体基因、癌基因等在染色体上的定位与表达;后者是研究细胞某种蛋白质的基因转录物mRNA在胞质内的定位与表达(图1-7,1-12)。核酸分子杂交术有很高的敏感性和特异性,它是免疫细胞化学的基础上,进一步从分子水平探讨细胞功能的表达及其调节机制的,已成为当前细胞生物学、分子生物学研究的重要手段。
图1-12 原位杂交术光镜像
A32P标记胰岛素cRNA探针放射自显影显示大鼠胰岛B细胞内胰岛素mRNa
B 地高辛-碱性磷酸酶标记胰岛素cRNA探针显示大鼠胰岛B细胞内胰岛素mRNA
C 地高辛-碱性磷酸酶标记心钠素cRNA探针显色示体外培养的人胎儿脐静脉
内皮细胞内的心钠素mRNA ×850
(第三军医大学蔡文教授供图)
(七)细胞和细胞化学定量术
组织和细胞形态结构及其化学成分的定量研究,是以量的测定及其数据变化阐述组织和细胞的生长、分化、代谢和功能的演变以及对环境因素和致病因素的反应。生命科学的研究不断深入,定量技术的应用日益广泛并有所进展。
1、显微镜分光亮度定量术此方法是应用显微分光亮度计(microspectrophotometer)测定组织化学和免疫组织化学染色标本的反应强弱,进行化成分的定量分析的。基本原理是细胞内某种物质的含量不同,其染色反应的深浅不一,对一定波长的光吸收也就不同,即某物质的消亮度与一定厚度和面积内的该物质浓度成正比。通过光电组合自动控制系统将消光度转换为电信号,即可得出光密度值(O、D值),进行定量分析比较。前述荧光素染色、酶和核酸组织化学染色、多肽和蛋白质免疫组化染色、放射自显影和原位杂交等标本,均可应用显微分光光度计做定量分析。
2、形态计量术 形态计量术(morphometry)是运用数学和统计学原理对组织和细胞进行二维和三维的形态测量研究,如细胞及其微细结构成分的数量、体积、表面积、周长等的相对和绝对值的测量,其中三维立体结构的研究又称体视学(stereology)。机体组织的光镜结构计量已有不少有意义的资料,如人和动物的肺泡数量和表面积,肾小体的数量和体积比,肝细胞的体积和数量,胰岛的数量及各类细胞的数量比,腺垂体各种内分泌细胞的数量比等。通过组织切片或照片(光镜和电镜)平面图像的测量,推算其立体结构数值,传统方法是将测试系统(点、线、方格等)投影或覆盖在切片上或照片上,把若干样品的平面测量数据按数学公式推算出其立体数值。目前已广泛应用图像分析仪(image analyzer)进行形态计量研究,该仪器也是光学、电子学和计算机高技术产品,它是将切片或照片图像通过摄像机显示于监示器屏幕上,并根据不同结构的颜色深浅(灰度)及各像点的大小位置,快速准确地得出所需的各种形态数据。组织化学和免疫组织化学染色标本,也可应用图像分析仪测定其光密度值,进行定量分析。
3、流式细胞术 流式细胞术(flow cytometry,FCM)是近年建立的细胞分类和定量研究技术,它是应用流式细胞仪(或称荧光激活细胞分类器,fluroescent activated cell sorter)对单个细胞生物化学和生物物理特性进行快速定量测定的。工作原理是先分离被检细胞制成悬液,并作荧光染色或标记,使单细胞液流快速通过该仪器的激光器照射分析区,被检细胞产生的不同荧光信号转变为电脉冲,分别输入计算机内贮存,并显示于示波器屏幕上,即可获得该细胞群体中不同类型细胞的有关数据,如不同细胞的数量、荧光强度以及细胞体积、表面积和内部结构等参数;还可使细胞附有不同电荷,分类收集各种细胞,该技术的特点是速度快,精确性高,灵敏度大,已成为一种重要手段广泛用于细胞动力学、遗传学、免疫学、肿瘤学等的研究。如细胞DNA,RNA或某种蛋白质的含量分析,单个染色体DNA含量及分选,淋巴细胞膜抗原或受体的分析及细胞亚群分选,杂交细胞等的分选等,也用于肿瘤临床诊断及疗效和预后的分析等。
(八)电子显微镜术
1、透射电镜术 透射电镜(transmission electron microscope,TEM)是以电子束穿透样品(组织的超薄切片),经聚合放大后,显像于荧光屏上进行观察和摄片的。电镜的放大倍数的分辨率比光镜大得多,放大倍数为几万至几十万倍,分辨率可达0.2nm。标本制备较光镜的更严格,新鲜组织切成小块(lmm3),用戊二醛,多聚甲醛、四氧化锇等固定,树脂包埋,以超薄切片机切成厚50~80nm的超薄切片,经醋酸铀和柠檬酸铅等重金属电子染色后,置于电镜下观察,标本在荧光屏上呈黑白反差的结构影像。被重金属浸染呈黑色的结构,称电子密度高(electron-dense);反之,浅染的部分称电子密度低(electron-lucent),这种染色称正染色(positive staining)。若被染结构着色浅淡,而其周围部分染成黑,是称为负染色(negative stainning)。透射电镜的电子枪加速电压50~100kV,电子束穿透力低,近年制成加速电压500kV以上的超高压电镜,电子束穿透力很强,可观察0.5~10μm厚的切片,可观察细胞内骨架等的立体超微结构。应用电镜观察细胞化学染色标本,称电镜细胞化学术(electron microscope cytochemistry);电镜观察免疫细胞化学染色标本,称免疫电镜术(immunoelectron microscopy);电镜与放射自显影结合的方法称电镜放射自显影术(electron microscopeautoradiography)。
2、扫描电镜术 扫描电镜(scanning electron microscope,SEM)是用于观察组织表面的立体结构的。组织块经固定后,置于真空镀膜仪内于燥,在标本表面先后喷镀一层碳膜和合金膜,即可置于镜下观察。扫描电镜的景深长,样品表面的金属膜可提高其导电性和图像反差,在荧光屏上扫描成像,呈现富有立体感的表面图像,如细胞表面的突起、微绒毛、纤毛及细胞的分泌与吞噬行为等(图1-13)。

图1-13大鼠分离肝巨噬细胞粘着吞噬羊红细胞扫描电镜像
M肝巨噬细胞,R羊红细胞
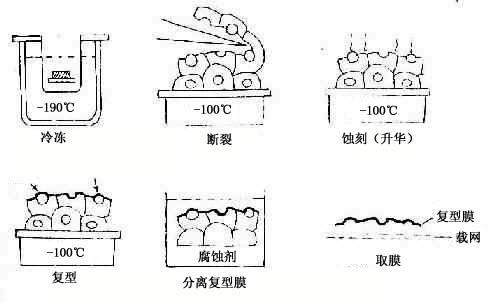
图1-14 冷冻蚀刻标本制备示意图
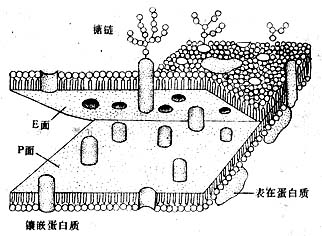
图1-15 细胞单位膜从中间层劈开示意图
3、冷冻蚀刻复型术和冷冻割断术
冷冻蚀刻复型术(tfeeze etch replica):是在透射电镜下观察组织或细胞断裂面的金属复制膜,显示细胞微细结构的立体影像。组织块先经甘油生理盐水处理(防止形成冰晶)后投入液氮快速冷冻,在低温下用钢刀将样品劈开,形成凹凸不平的断裂面:-100℃真空下使断裂面的冰晶升华,暴露不平整表面;在断裂面上先后喷镀一层合金膜和碳膜,用次氯酸等组织腐蚀掉;将反差的凸凹不平的金属复型膜置于镜下观察(图1-14)。此项技术尤适用研究生物膜的内部结构,如从单位膜的脂质分子疏水端劈开(图1-15),经蚀刻镀膜,镜下可见质膜断裂面复型膜结构状态(图1-16),其凹凸影像恰与实物相反。

图1-16小鼠肾近曲小管微绒毛冷冻蚀刻复型电镜像 ×38300
MV微绒毛 E E面,P P面(白求恩医科大学尹昕、朱秀雄教授供图)
冷冻割断术(freeze cracking):是将固定组织包埋在树脂内,低温下割断,断面喷镀合金,在扫描电镜下观察断面的立体构型。该技术适于研究组织内部微细结构的相互关系,如肝细胞与肝血窦和胆小管的关系,肾小体的肾小囊与血管球的关系等(图1-17)。
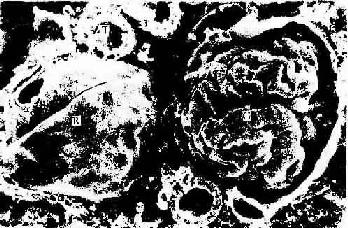
图1-17 大鼠肾冷冻割断扫描电镜示肾小体
R肾小囊外表面,G血管球,T肾小管
(白求恩医科大学尹昕、朱秀雄教授供图)
4、电镜X-射线显微分析术X-射线显微分析术(X-ray microanalysis)是研究细胞和组织内元素的种类、分布和含量的新技术。它是利用高速电子束轰击电镜内生物标本的微小区域,使该区所含的元素发射了一定波长的X-射线,通过检测器对X-射线进行波谱或能谱分析,即可测定微区内元素的性质、含量和分布。如测定细胞内Na、K、Ca、Fe、P、Cl等及某些微量元素的含量和分布变化,探讨各种元素与细胞生理和病理的关系。
(九)组织培养术
前述几种方法都是取人体或在体(in vivo)实验动物的组织,经固定等处理后,对已死亡的组织进行观察研究的。组织培养(tissue culture)或称体外实验(in vitro)则是取活组织或活细胞在体外适宜的环境中培养成活,进行实验研究。细胞在体外生存必须具有近似体内的生存条件,如充足营养供应,合理的O2与CO2比例,必要的电解质和适宜的渗透压,pH值、温度和湿度等,还需防止微生物污染。组织培养的特点在于可用研究各种理化因子(温度、激素、药物、毒物等)对活细胞的直接影响,并能观察记录(摄影、录像)。组织培养与前述方法结合应用,可研究某种因素对细胞增殖、分化、代谢、运动、吞噬、分泌等影响和调节的动态过程,以及细胞病变、癌变和逆转等机理,获得在体实验难达到的研究目的。
组织培养用液为平衡盐水及血清(小牛血清、胎盘血清等),羊水、腹水、组织浸出液等天然培养基(natural medium)。天然培养基成分复杂,且不稳定。目前广泛应用人工合成培养基(synthetic medium)现有多种商品供应,使用方便,但常仍需补充部分血清等。若仅用合成培养基和已制备好的几种必须因子与激素,称此为无血清培养基(serum-free medium),其成分和含量均是已知的,可精细研究某种因子对细胞的生物效应。
组织培养的方法甚多,常用容器有凹玻片、培养皿、培养瓶、培养板、流动小室等。取组织块贴于瓶底进行培养,可观察从组织块生长迁移出的细胞。取胚胎某器官原基或器官的一部分进行培养,称器官培养(organ culture)。更精细的方法是分离和纯化组织中的某种细胞,使之贴附在瓶底形成单层细胞(图1-18),称此为细胞培养(cell culture)。首次培养的细胞,称原代培养(primary cultrue;细胞增殖而密集再传代培养,称传代培养(subculture)。经长期培养而成的细胞群体,称细胞系(cell line);用细胞克隆(cell clone)或单细胞培养而建成的某种纯细胞群体,称细胞株(cell strain)。它们均可在液氮内长期冻存,供随时应用。现已建成多种肿瘤细胞株,广泛用于实验研究。
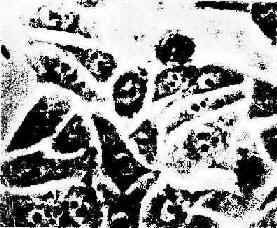
图1-18 体外培养的上皮细胞在相差显微镜下的图像(北京肿瘤研究所鄂征教授供图)
(十)细胞融合术
2个或2个以上的细胞融合成为一个细胞,称为细胞融合(cell fusion)。正常人体内也有细胞融合现象,如两性生殖细胞结合而成受精卵,多个巨噬细胞融合成一个体积很大的多核异物巨细胞。体外用人工方法使两种细胞融合,制成一种新品系的杂交细胞(hybrid cell),筛选出的此种杂交细胞有很强的生命力,增殖也很旺盛。常用的细胞融合诱导物是仙台病毒(Sendai virus)和聚乙烯二醇(polythyleneglycol,PEG)。细胞融合术是细胞遗传术、细胞免疫学、病毒学、肿瘤学等研究的一种重要手段,如将受抗原刺激后的小鼠脾淋巴细胞分离出来,与已建立的小鼠骨髓瘤(浆细胞瘤)细胞融合,筛选出的杂交瘤细胞可长期存活和增殖,成为制备单克隆抗体的细胞株。
三、组织学与胚胎学学习方法的几个要点
学习组织学与胚胎学应注意以下几方面:
1.平面与立体的关系切片和照片所显示的是细胞、组织和器官的平面结构,同一结构由于切面不同而呈现一定形态差异;通过细胞、组织、器官的平面结构的观察,还应建立对它们立体的整体结构的认识。因此应注意从平面结构的观察,树立整体结构的概念。一种传统的方法是将标本制成连续切片,观察记录每张切片中的结构,然后累积起来进行分析,或制成模型以表达其整体结构。目前则应用微机图像处理技术,在荧光屏上显示细胞和组织的三维重建图像。
2.结构与功能相联系每种细胞、组织和器官都有一定的形态结构特点。这些特点往往是它们行使一定功能的结构基础,两者密切相关。例如分泌蛋白质的腺细胞富有粗面内质网和发达的高尔基复合体,巨噬细胞则有较多的溶酶体;构成肌组织的肌细胞,形态细长,含有大量纵行肌丝,是细胞收缩的物质基础;上皮组织则细胞排列紧密,具有吸收和保护等功能相关结构。又如消化管是连续的管道,而食管、胃、小肠和大肠的粘膜又各有特点,它们与各段的相应功能相关。因此,结构与功能相结合既能达到深入理解,融会贯通,又可抓住要点,掌握规律。
3.从静态结构了解动态变化生活的细胞和组织是始终处于动态变化之中,在细胞分化,代谢和功能活动过程,其微细结构也有相应变化,细胞还不断增殖、运动、死亡和更新。即使是非细胞的间质成分包括坚硬的牙和骨的间质,也不断地被吸收和重建。胚胎时期的生长发育变化则更为显著。但在切片中所见的结构都是某一时刻的静态形象,所以要善于从组织的静态时相理解其动态变化。在动物实验中,可在不同实验时期取材观察,分析其动态过程。
4.纵横联系深化认识组织学从基本组织至各器官系统是阐述有机体统一整体的不可分割的部分,许多内容前后关联,相互印证。如细胞的结构与功能是组织学的基础,贯穿于全书始末;由细胞和细胞间质构成的各种组织组成不同的器官,器官的功能不仅建立在相关细胞特性的基础上,也与细胞间质及血管和神经的分布密切有关。又如细胞间连接结构不仅存在于上皮组织内,而且也分布在其它组织的细胞之间,并参与组织和器官的重要功能活动;淋巴细胞、内分泌细胞、神经细胞等更是在机体生命活动的整体网络中起广泛而重要的作用。
前已述及,现代医学和生物学研究进展迅速,使各学科的内容相互渗透和交叉,联系日益密切。组织学中研究方法的应用和许多基本理论的验证,都不可避免地要涉及其他学科的新技术和新成就,尤其是细胞生物学、分子生物学、免疫学、生物化学和生物物理学等。如细胞间连接、通讯及相互关系与调节,肌纤维的超微结构及其收缩机制的分子水平原理,血细胞发生中的造血干细胞学说的实验依据,淋巴细胞和抗原呈现递细胞的起源、分化及其在免疫应答中的抗原、抗体和受体的关系,许多新的内分泌细胞的发现和内分泌系统的展开,各种激素和调节因子的产生、作用及其相互关系,心血管、肺、肝、肾等器官一些细胞的结构和功能的新发现,神经元的信息传递与递质和受体的关系,生殖细胞的起源、分化和成熟等。随着组织学的进展,本书的修订在阐述基本内容的基础上,必然要有更新、充实和适当的扩展,有的内容以小字形式叙述,作为学习参考。因此在学习中应注意在掌握基本形态结构与功能的基础上,要善于自学钻研,扩充知识,纵横联系,深化认识,奠定坚实宽厚的基础,方能适应新世纪医药卫生事业发展的要求。
第二章 上皮组织
上皮组织(epithelial tissue)由密集的细胞组成,细胞形状较规则,细胞间质很少,大部分上皮覆盖于身体表面和衬贴在有腔器官的腔面,称被覆上皮。有些上皮构成腺,称腺上皮。上皮组织的细胞呈现明显的极性(polarity),即细胞的两端在结构和功能上具有明显的差别。上皮细胞的一面朝向身体表面或有腔器官的腔面,称游离面;与游离面相对的另一面朝向深部的结缔组织,称基底面。上皮细胞基底面附着于基膜,基膜是一薄膜,上皮细胞借此膜与结缔组织相连。上皮组织中没有血管,细胞所需的营养依靠结缔组织内的血管透过基膜供给。位于身体不同部位和不同器官的上皮,面临不同的环境,功能也不相同,细胞顶部常具有不同的结构,以适应各自的功能需要。上皮组织具有保护、吸收、分泌和排泄等功能,位于身体不同部位和器官的上皮常以某种功能为主。如身体表面上皮的功能主要为保护作用,而消化管腔面的上皮除有保护作用外,还有吸收和分泌功能。腺上皮的功能主要是分泌。有的器官的一些上皮细胞特化为有收缩能力的细胞,称肌上皮细胞(myoepithelial cell)。有些部位的一些上皮细胞能感受某种物理或化学性的刺激,则称感觉上皮细胞(sensory epithelial cell)。
一、被覆上皮
(一)被覆上皮的类型和结构
被覆上皮(covering epithelium)是按照上皮细胞层数和细胞形状进行分类的。单层上皮(simple epithelium)由一层细胞组成,所有细胞的基底端都附着于基膜,游离端可伸到上皮表面。复层上皮(stratified epithelium)由多层细胞组成,最深层的细胞附着于基膜上。上皮又根据细胞的形状(单层上皮)或浅层细胞的形状(复层上皮)进一步分类。将细胞的层数和细胞形状两个因素结合在一起。可将被覆上皮分为多种(表2-1)。部分腺上皮也可按上述标准分类。
表2-1 被覆上皮的类型和主要分布

1.单层扁平上皮单层扁平(鳞状)上皮(simple squamous epithelium)很薄,只由一层扁平细胞组成(图2-1。)由表面看,细胞呈不规则形或多边形,核椭圆形,位于细胞中央,细胞边缘呈锯齿状或波浪状,互相嵌合。由上皮的垂直切面看,细胞核呈扁形,胞质很薄,只有含核的部分略厚。
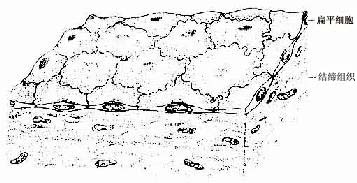
图2-1 单层扁平上皮模式图
衬贴在心、血管和淋巴管腔面的单层扁平上皮称内皮(endothelium)。内皮细胞很薄,大多呈梭形,游离面光滑,有利于血液和淋巴液流动及物质透过。分布在胸膜、腹膜和心包膜表面的单层扁平上皮称间皮(mesothelium),细胞游离面湿润光滑,便于内脏运动。
2.单层立方上皮单层立方上皮(simple cuboidal epithelium)由一层立方形细胞组成(图2-2)。从上皮表面看,每个细胞呈六角形或多角形;由上皮的垂直切面看,细胞呈立方形。细胞核圆形、位于细胞中央。这种上皮见于肾小管等处。
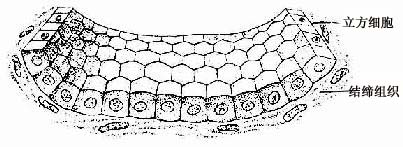
图2-2 单层立方上皮模式图
3.单层柱状上皮单层柱状上皮(simple columnar epithelium)由一层棱柱状细胞组成。从表面看,细胞呈六角形或多角形;由上皮垂直切面看,细胞呈柱状(图2-3),细胞核长圆形,多位于细胞近基底部。此种上皮大多有吸收或分泌功能 。在小肠和大肠腔面的单层柱状上皮中,柱状细胞间有许多散在的杯状细胞(goblet cell)(图2-3)。杯状细胞形似高脚酒杯,细胞顶部膨大,充满粘液性分泌颗粒,基底部较细窄。胞核位于基底部,常为较小的三角形或扁圆形,染色质浓密,着色较深。杯状细胞是一种腺细胞,分泌粘液,有滑润上皮表面和保护上皮的作用。
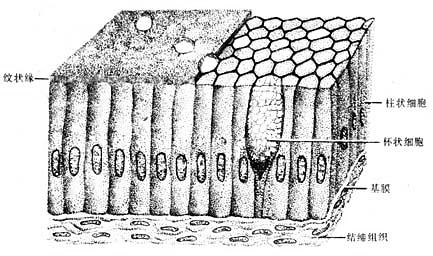
图2-3 单层柱状上皮模式图
被覆在子宫和输卵管等腔面的单层柱状上皮,细胞游离面具有纤毛,称单层纤毛柱状上皮(simple ciliated columnarepithelium)
4.假复层纤毛柱状上皮假复层纤毛柱状上皮(pseudostratified ciliated columnar)由柱状细胞、梭形细胞和锥体形细胞等几种形状、大小不同的细胞组成。柱状细胞游离面具有纤毛。上皮中也常有杯状细胞。由于几种细胞高矮不等,只有柱状细胞和杯状细胞的顶端伸到上皮游离面,细胞核的位置也深浅不一,故从上皮垂直切面看很象复层上皮。但这些高矮不等的细胞基底端都附在基膜上,故实际仍为单层上皮(图2-4)。这种上皮主要分布在呼吸管道的腔面。
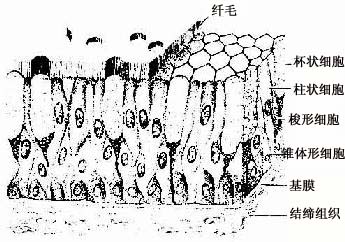
图2-4 假复层纤毛柱状上皮模式图
5.复层扁平上皮复层扁平(鳞状)上皮(stratified squamous epithelium)由多层细胞组成,是最厚的一种上皮(图2-5)。由上皮的垂直切面看,细胞的形状和厚薄不一。紧靠基膜的一层细胞为立方形或矮柱状,此层以上是数层多边形细胞,再上为梭形细胞,浅层为几层扁平细胞。最表层的扁平细胞已退化,并不断脱落。基底层的细胞较幼稚,具有旺盛的分裂能力,新生的细胞渐向浅层移动,以补充表层脱落的细胞。这种上皮与深部结缔组织的连接面弯曲不平,扩大了两者的连接面(图2-5)。
复层扁平上皮具有很强的机械性保护作用,分布于口腔,食管和阴道等的腔面和皮肤表面,具有耐磨擦和阻止异物侵入等作用。受损伤后,上皮有很强的修复能力。位于皮肤表面的复层扁平上皮,浅层细胞已无胞核,胞质中充满角蛋白(一种硬蛋白),已是干硬的死细胞,具有更强的保护作用,这种上皮称角化的复层扁平上皮(keratinized stratified squamousepithelium)(见皮肤章)。衬贴在口腔和食管等腔面的复层扁上皮,浅层细胞是有核的活细胞,含角蛋白少,称未角化的复层扁平上皮(nonkeratinized stratified squamousepithelium)。
6.复层柱状上皮复层柱状上皮(stratified columnar epithelium)的深层为一层或几层多边形细胞,浅层为一层排列较整齐的柱状细胞。此种上皮只见于眼睑结膜和男性尿道等处。
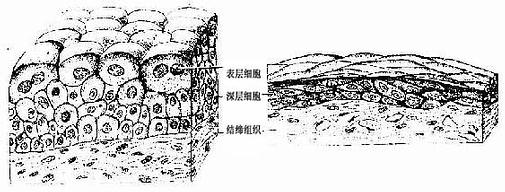
7.变移上皮变移上皮(transitional epithelium)又名移行上皮、衬贴在排尿管道(肾盏、肾盂、输尿管和膀胱)的腔面。变移上皮的细胞形状和层数可随所在器官的收缩与扩张而发生变化。如膀胱缩小时,上皮变厚,细胞层数较多,此时表层细胞呈大立方形,胞质丰富,有的细胞含两个细胞核;中层细胞为多边形,有些呈倒置的梨形;基底细胞为矮柱状或立方形(图2-6)。当膀胱充尿扩张时,上皮变薄,细胞层数减少,细胞形状也变扁(图2-6)
有人认为变移上皮是假复层上皮,所有细胞均向深部伸出长脚状突起,附着于基膜上(图2-7)
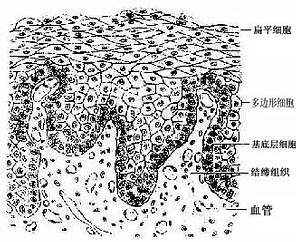
图2-5 复层扁平上皮模式图
(1)膀胱空虚时 (2)膀胱膨胀时
图2-6 变移上皮模式图(膀胱)
图2-7 变移上皮模式图(膀胱)
A.收缩状态 B.膨胀状态
(二)上皮组织的特殊结构
上皮组织与其功能相适应,在上皮的细胞的各个面常形成不同的特殊结构。这种结构有的由细胞质和细胞膜构成,有的由细胞膜、细胞质和细胞间质共同成。
1.上皮细胞的游离面
(1)细胞衣(cell coat):又称糖衣,为一薄层绒毛状的复合糖,包括糖蛋白、糖脂及蛋白多糖。上皮细胞的游离面细胞衣尤为显着(图2-8),细胞基底面及侧面也有类似细胞衣结构,但不甚明显。细胞衣具有粘着、支持、保护、物质交换及识别等功能。
(2)微绒毛(microvillus):是上皮细胞游离面伸出的细小指状突起,在电镜下才能清楚辨认(图2-8,2-9)。有些上皮细胞微绒毛少,长短不等,排列也不整齐。具有活跃吸收功能的上皮细胞有许多较长的微绒毛,且排列整齐,在高倍镜下可见细胞游离面显纵纹状的纹状缘(straited border)或刷状缘(brush border),这就是密集排列的长微绒毛的光镜图像(图2-3),除上皮细胞外,其它组织的细胞表面也常有微绒毛。
电镜下可见微绒毛表面为细胞膜,内为细胞质。微绒毛直径约0.1μm,长度因细胞种类或细胞生理状态的不同而有很大差别。绒毛轴心的胞质中有许多纵行的微丝(microfilament)。微丝一端附着于微绒毛尖端;另一端下伸到细胞顶部,附着于此部胞质中的终未网(terminal web)(图2-8,2-9)。终末网在吸收功能旺盛的上皮细胞中明显,为顶部胞质中的细丝(filametn)交织成的密网,网与细胞游离面平行,组成网的细丝固着于细胞侧面的中间连接(图2-8,2-9)。微绒毛中的微丝为肌动蛋白丝,终末网中有肌球蛋白。微绒毛大概也以肌丝滑动的方式伸长或缩短。微绒毛显著地扩大了细胞的表面积,参与细胞吸收物质的作用。
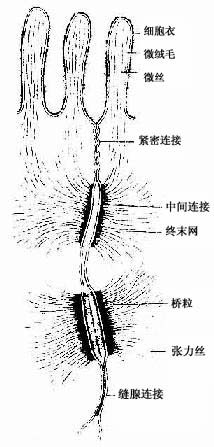
图2-8 单层柱状上皮细胞连接 超微结构模式图
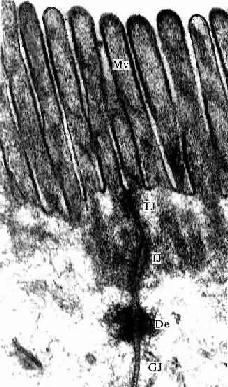
图2-9 小鼠小肠上皮细胞电镜像 ×84000
MV 微绒毛,TJ紧密连接,IJ中间连接,De桥粒,GJ缝隙连接
(上海医科大学电镜室供图)
(3)纤毛(cilium):是细胞游离面伸出的能摆动的较长的突起,比微绒毛粗且长,在光镜下能看见。一个细胞可有几百根纤毛。纤毛长约5-10μm,粗约0.2μm,根部有一个致密颗粒,称基体(basal body)。纤毛具有一定方向节律性摆动的能力。许多纤毛的协调摆动像风吹麦浪起伏,把粘附在上皮表分泌物和颗粒状物质向一定方向推送。例如呼吸道大部分的腔面为有纤毛的上皮,由于纤毛的定向摆动,可把被吸入的灰尘和细菌等排出。
纤毛的内部结构比微绒毛复杂。电镜下可见纤毛表面有细胞膜,内为细胞质,其中有纵向排列的微管。微管的排列有一定规律,中央为2条完整的微管。周围为9组成对的双联微管(图2-10,2-11)。基体的结构与中心粒基本相同,纤毛中的微管与基体的微管相连。
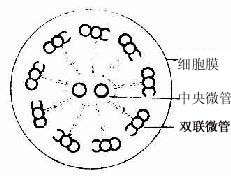
图2-10 纤毛横切面超微结构模式图
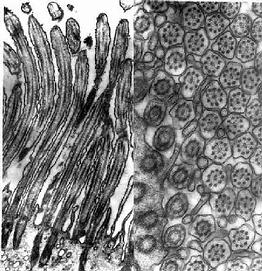
图2-11 大鼠输卵管上皮细胞纤毛电镜像 ×50000
左图 纤毛纵切, 右图 纤毛横切
(上海医科大学电镜室供图)
微管与纤毛的摆有关。有人从纤毛的双联微管中分离出一种具有ATP酶活性的蛋白质,称动力蛋白(dynein)。纤毛的运动可能是此种蛋白质分解ATp 使微管之间产生滑动所致。
2.上皮细胞的侧面在细胞紧密的组织,如上皮组织和其它某些组织,细胞排列密集,细胞间隙很窄,一般宽约15-20nm。细胞间隙中充满相邻细胞的细胞衣,并有少量糖胺多糖和钙离子,有较强的细胞粘着作用。这种粘着物质,在细胞的相邻面间广泛存在。此外,有些细胞的相邻面凹凸不平,互相嵌合,又进一步加强了细胞彼此的结合。细胞间结合更重要的结构,是在细胞相邻面形成特殊构造的细胞连接(cell junction)。上皮细胞间的连接结构发达,而且结构典型。肌细胞之间和神经细胞之间也有较多的细胞连接。结缔组织的细胞较分散,但有些相接触的细胞也有细胞连接。细胞连接由相邻细胞间局部特化的细胞膜、胞质和细胞间隙组成。
(1)紧密连接(tight junction):又称闭锁小带(zonula occludens)。这种连接呈点状、斑状或带状,带状的较典型,常见于单层柱状上皮和单层立方上皮,位于相邻细胞间隙的顶端侧面,呈箍状环绕细胞。在紧密连接的连接区、相邻两细胞的胞膜上有呈网格状的脊,这些脊彼此相对并紧贴在一起,细胞间隙消失。无脊的部分,有10-15nm的间隙(图2-8)。紧密连接除有机械连接作用外,更重要的是封闭细胞顶部的细胞间隙,阻挡细胞外的大分子物质经细胞间隙进入组织内。
(2)中间连接(intermediate junction):又称粘着小带(zonula adherens)。这种连接多为长短不等的带状,位于紧密连接下方,环绕上皮细胞顶部。相邻细胞之间有15-20nm的间隙,间隙中有较致密的丝状物连接相邻细胞的膜。在胞膜的胞质面,附着有薄层致密物质和细丝,细丝参与构成终末网(图2-8)。此种连接在上皮细胞间和心肌细胞间常见。它除有粘着作用外,大概还有保持细胞形状和传递细胞收缩力的作用。
(3)桥粒(desmosome):又称粘着斑(macula adherens)。呈斑状连接,大小不等,位于中间连接的深部,主要存在于上皮细胞间。连接区的细胞间隙宽约20-30nm,其中有低密度的丝状物,间隙中央有一条与细胞膜相平行而致密的中间线,此线由丝状物质交织而成。细胞膜的胞质面有较厚的致密物质构成的附着板,胞质中有许多直径10nm的角蛋白丝(张力丝)(tonofilament)附着于板中,并常折成袢状返回胞质,起固定和支持作用。桥粒是一种很牢固的细胞连接,在易受机械性刺激和磨擦的复层扁平上皮中多见(图2-8)。
在某些上皮细胞的基底面,即与深层结缔组织的相邻面,还可见半桥粒(hemidesmosome)(图2-12)。半桥粒为上皮细胞一侧形成桥粒一半的结构,将上皮细胞固着在基膜上。
(4)缝隙连接(gap junction):又称通讯连接(communication junction)。这种连接呈斑状,位于柱状上皮深部。此处细胞间隙很窄,仅2-3nm,并见相邻两细胞的间隙中有许多间隔大致相等的连接点(图2-8)。冷冻蚀刻复型等方法的研究证,相邻两细胞的胞膜中有许多配布规律的柱状颗粒,每个颗粒直径约7-9nm ,由6个亚单位并合组成,中央有直径约2nm的管腔。相邻两细胞膜中的颗粒彼此相接,管腔也通连,成为细胞间直接交通的管道(图2-13)。在钙离子和其它因素作用下,管道可开放或闭合。这种连接广泛存于胚胎和成体的多种细胞间,可供细胞相互交换某些小分子物质和离子,借以传递化学信息,调节细胞的分化和增殖。此种连接的电阻低,在心肌细胞之间,平滑肌细胞之间和神经细胞之间,可经此处传递电冲动。
以上四种连接,一般只要有两个或两个以上的连接挨在一起,即可称连接复合体(junctional complex)。连接结构的存在和数量常随器官不同发育阶段和功能状态及病理变化而改变。例如,在生精过程事,随着精原细胞的分化,支持细胞间的紧密连接可开放和重建(见男性生殖系统)。

图2-12 半桥粒和基膜超微结构模式图
3.上皮细胞的基底面
(1)基膜(basement membrane):又称基底膜。是上皮基底面与深部结缔组织间的薄膜。不同部位上皮的基膜甚至同一基膜的不同区域,其组成成分有所不同。基膜含有Ⅳ型胶原蛋白、层粘连蛋白和硫酸乙酰肝素蛋白多糖,有的部位基膜含纤维粘连蛋白。电镜下可将基膜分为三层(图2-12):紧贴在上皮细胞基底面的一层为透明板(lamina lucida),为电子致密度低的薄层,厚约10-50nm;其下面为电子致密度高的均质层,称致密板(lamina densa),又称基板,不同部位致密板厚度不等,约为20nm~300nm;第三层为网织板(lamina fibroreticularis),又称网板,位于致密板之下,由网状纤维和基质构成,有时可有少许胶原纤维。基膜厚薄不一,薄者仅由透明板和致密板组成。基膜除有支持和连接作用外,还是半透膜,有利于上皮细胞与深部结缔组织进行物质交换。基膜还能引导上皮细胞移动并影响细胞的分化。
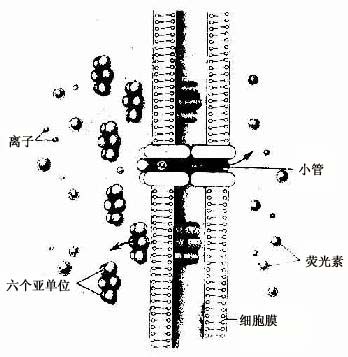
图2-13 缝隙连接超微结构模式图
↑示小分子物质经缝隙连接的小管进入相邻细胞
层粘连蛋白(laminin LN)是基膜中的一种主要成分,是一种大分子糖蛋白,含糖15%-28%,是由一条重链(A链)和2条轻链(B1,B2)构成的不对称的十字形结构,有3条短臂和一条长臂。层粘连蛋白具有与Ⅳ型胶原蛋白、硫酸乙酰肝素、半乳糖脑硫脂及神经节苷脂等分子结合的部位,这对基膜的构成具有重要意义。层粘连蛋白还可与上皮细胞、内皮细胞、神经细胞、肌细胞及多种肿瘤细胞相结合,促进它们粘着在基膜的Ⅳ型胶原蛋白上并铺展开,促进上皮细胞增殖、损伤神经元的存活及轴突生长。层粘连蛋白对保持细胞间的粘着和极性结构以及调节细胞分化皆有重要作用。最近证明,层粘连蛋白亦可增强由抗体或补体介导的巨噬细胞的吞噬功能,增强巨噬细胞对肿瘤细胞的杀伤作用。
(2)质膜内褶(plasma membrane infolding):是上皮细胞基底面的细胞膜折向胞质所形成的许多内褶(图2-14)。质膜内褶的主要作用是扩大细胞基底部的表面积,有利于水和电解质的迅速转运。由于转运过程中需要消耗能量,故在质膜内褶附近的胞质内,含有许多纵行排列的线粒体。
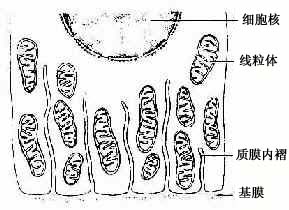
图2-14 上皮细胞基底面质膜内褶
超微结构模式图
二、腺上皮和腺
有些部位的被覆上皮除有保护和吸收功能外,也有分泌作用,如胃的单层柱状上皮等。但人体还有许多主要行使分泌功能的上皮,这些上皮称腺上皮(glandular epithelium)。以腺上皮为主要成分组成的器官称腺(gland)。腺细胞的分泌物中含酶、糖蛋白(也称粘蛋白)或激素等,各有特定的作用。
(一)外分泌腺和内分泌腺
在胚胎期,腺上皮起源于内胚层、中胚层或外胚层衍生的原始上皮。这些上皮细胞分裂增殖,形成细胞索,长入深部的结缔组织中,分化成腺。如形成的腺有导管通到器官腔面或身体表面,分泌物经导管排出,称外分泌腺(exocrine gland),如汗腺、胃腺等;如果形成的腺没有导管,分泌物经血液和淋巴输送,称内分泌腺(endocrine gland),如甲状腺、肾上腺等(图2-15)。
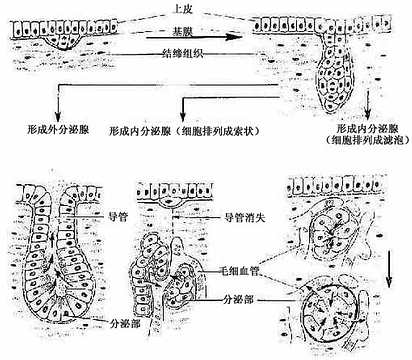
图2-15 腺发生模式图
(二)蛋白质分泌细胞
蛋白质分泌细胞(protein-secreting cell)大多呈锥体形或柱状,核圆形,位于细胞中央或靠近基底部。细胞基底部胞质显强嗜碱性,顶部聚集许多圆形分泌颗粒,HE染色呈红色,具有这些结构特点的蛋白质分泌细胞称浆液性细胞(serous cell)。电镜下见到,细胞基底部有密集平行排列的粗面内质网,并有许多线粒体位于内质网扁囊之间,核上方有发达的高尔基复合体。分泌过程经以下几个步骤(图2-16):①细胞摄入合成分泌物所需氨基酸等原料;②氨基酸结合到粗面内质网的核糖体上合成蛋白质,进入内质网腔内;③内质网以出芽方式形成小泡,将蛋白质输送到高尔基复合体;④蛋白质进入高尔基复合体,经过加工和浓缩,形成有膜包裹的分泌颗粒;⑤分泌颗粒聚集在细胞顶部,当分泌物释放时,分泌颗粒的膜与顶细胞膜融合,以出胞方式,将分泌物释放到细胞外。整个分泌过程所需要的能量由线粒体产生的ATP供给。浆液性细胞的分泌物为较稀薄的液体,其中含有不同的酶,如各种消化酶等。
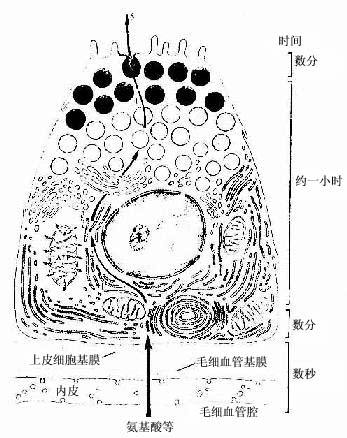
图2-16 胰腺浆液细胞分泌过程示意图
1.合成 2.输送 3.包裹 4.聚集 5.排出右侧表示每个步骤大致所需的时间
(三)糖蛋白分泌细胞
糖蛋白分泌细胞(glycoprotein-secreting cell)分泌糖蛋白,也称粘蛋白(mucoprotein,mucin)。细胞分泌的糖蛋白放后与水结合成粘性液体,称粘液(mucus),覆盖在上皮游离面,起滑润和保护上皮的作用。人体分泌粘液的细胞很多,主要分布于消化管和呼吸道。杯状细胞是散在于上皮中的一种典型的分泌粘液的细胞。另外,分泌粘液的细胞也组成大小不等的腺。分泌粘液的细胞大多呈柱状或锥体形,顶部胞质含许多较大的分泌颗粒,用PAS法染色时,颗粒着色很深;但在HE染色切片中,因不易保存分泌颗粒,致使分泌颗粒所在部位着色很浅,呈泡状或空泡状。细胞核常较扁,位于细胞基底部,核周围的胞质显弱嗜碱性。光镜下,将具有这些结构特点的细胞称粘液性细胞(mucous cell)。电镜下见到,细胞基底部有较多的粗面内质网和游离核糖体。高尔基复合体很发达,位于核上方。顶部胞质中含有许多有膜包裹的分泌颗粒。不同的腺分泌的糖蛋白化学组成有差别,腺细胞的结构也有所不同。
糖蛋白的合成包括蛋白质和多糖的合成,以及蛋白质与多糖结合形成糖蛋白。蛋白质的合成过程与蛋白质分泌细胞基本相同,多糖在高尔基复合体合成,并在此与蛋白质结合成糖蛋白。然后形成分泌颗粒,聚集在细胞顶部,以出胞方式将分泌物释放到细胞外。
(四)类固醇分泌细胞
类固醇分泌细胞(steroid secreting cell)的分泌物为类固醇激素(也称甾类激素)。细胞呈多边形或圆形,核圆形,位于细胞中央,胞质中含许多小脂滴。在HE染色切片中,脂滴中的脂类已被溶解,使胞质泡沫状。电镜下,这类细胞的胞质中粗面内质网和游离核糖体少。滑面内质网丰富,呈管状互相通连成网。高尔基复合体很大,位于核附近,有许多大小不等的线粒体,它们的嵴常呈管状。胞质中有许多含脂类的小泡,但无分泌颗粒(图2-17)。这类细胞贮存分泌物(激素)很少。脂类小泡中贮存较多的胆固醇和甘油三脂,是合成激素的原料。类固醇激素的合成是在滑面内质网和线粒体的酶共同参与下完成的,高尔基复合体也与分泌物合成有关,但确实的作用还不清楚。
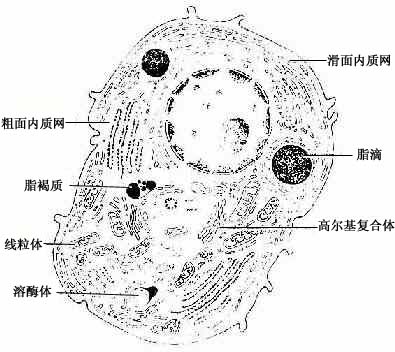
图2-17 类固醇分泌细胞超微结构模式图
(五)多肽分泌细胞
多肽分泌细胞(polyopeptide-secreting cell)能摄取胺或胺前体物,并经脱羧作用将胺前体物转变为胺,并能合成肽。具有这种共同细胞化学特性的细胞统称为APUD细胞(amine precursor uptake and decarboxylationcell)。APUD细胞常单个或成群地存在于一些器官或组织中。在光镜下,APUD细胞形状多为圆形、多边形或锥形,胞质着色浅。细胞基底部胞质内含大小不等的分泌颗粒,故又称基底颗粒细胞(basal granular cell)。HE染色标本中分泌颗粒不易辨认。有些细胞经铬盐染色,颗粒呈棕黄色,称嗜铬细胞。许多细胞可被银盐染色,颗粒着棕黑色,称亲银细胞或嗜银细胞。电镜观察,细胞基底部颗粒的大小、形状及电子致密度依细胞类型而各有不同。胞质内含少量粗面内质网及高尔基复合体,滑面内质网及游离核糖体较丰富。细胞内肽的合成过程与合成蛋白质的细胞基本相同,胺大概在滑面内质网和高尔基复合体生成。分泌物以胞吐或分子渗出方式释放到细胞外。
(六)外分泌腺的结构的分类
按组成外分泌的细胞数目,外分泌腺可分为单细胞腺(unicellular gland)和多细胞腺(multicellular gland)。前述的杯状细胞就是单细胞腺,但人体中大多数腺是多细胞腺。多细胞腺大小不等,一般都由分泌部和导管两部分组成(图2-18)。
1.分泌部分泌部(secretory portion)的形状为管状、泡状或管泡状。泡状和管泡状的分泌部常称腺泡(acinus)。分泌部一般由一层细胞组成,中央有腔。根据分泌部的形状,腺可分为管状腺(tubular)、泡状腺(acinar gland)和管泡状腺(tubuloacinar gland)(图2-18)
组成分泌部的腺细胞结构,因腺的种类和分泌物性质的不同而有显著差别。消化系统和呼吸管道的一些外分泌腺,分泌部由浆液性细胞或粘液性细胞组成;据此,可将这些腺分为以下几种类型:①浆液性腺(serous gland),腺的分泌部都由浆液性细胞组成;②粘液性腺(mucous gland),腺的分泌部都由粘液性细胞组成;③混合性腺(mixed gland),是指由浆液性细胞和粘液性腺泡共同组成的腺,并常有由浆液性细胞和粘液性细胞一起组成的混合性腺泡(mixed acinus)。但需说明,这种按浆液性细胞和粘液性细胞对腺的分类,只适用于一部分外分泌腺。还有相当多的腺不能按上述特点分类。
2.导管导管(duct)与分泌部直接通连,由单层或复层上皮构成。导管主要是排出分泌物,但有些腺的导管还有吸收水和电解质及排泌作用。导管有无分支也是外分泌腺分类的一个依据。有些腺的一个或几个分泌部通连一条不分支的导管,称单腺(simple gland);有些腺的导管分成大小不等的几级分支,最小的导管未端通连分泌部,称复腺(compound gland)。通常是把分泌部的形状和导管是否分支两个因素结合一起,将腺进行分类的(图2-18)。
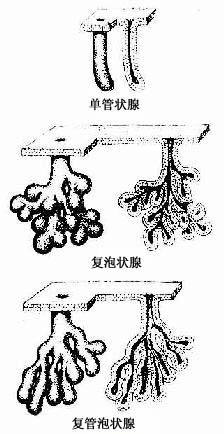
图2-18 外分泌腺的形态分类
三、上皮组织的更新和再生
上皮组织具有较强的再生能力。在生理状态下,有些部位被覆上皮的细胞不断死亡脱落,这在皮肤的复层扁平上皮和胃肠的单层柱状上皮尤为明显。上皮细胞死亡脱落后,不断由上皮中存在的幼稚细胞增殖补充,这些幼稚细胞具有分裂能力,这是生理性的更新。由于炎症或创伤等病理原因所致的上皮损伤,由周围未受损伤的上皮细胞增生补充,新生的细胞移到损伤表面,形成新的上皮,这是病理性再生。
第三章 结缔组织
结缔组织(connective tissue)由细胞和大量细胞间质构成,结缔组织的细胞间质包括基质、细丝状的纤维和不断循环更新的组织液,具有重要功能意义。细胞散居于细胞间质内,分布无极性。广义的结缔组织,包括液状的血液、松软的固有结缔组织和较坚固的软骨与骨;一般所说的结缔组织仅指固有结缔组织而言。结缔组织在体内广泛分布,具有连接、支持、营养、保护等多种功能。
结缔组织均起源于胚胎时期的间充质(mesenchyme)。间充质由间充质细胞和大量稀薄的无定形基质构成。间充质细胞呈星状,细胞间以突起相互连接成网,核大,核仁明显,胞质弱嗜碱性(图3-1)。间充质细胞分化程度低,在胚胎时期能分化成各种结缔细胞、内皮细胞、平滑肌细胞等。成体结缔组织内仍保留少量未分化的间质细胞。
图3-1 间充质
本章讲述固有结缔组织(connectivetissue proper),按其结构和功能的不同分为疏松结缔组织、致密结缔组织、脂肪组织和网状组织。
一、疏松结缔组织
疏松结缔组织(loose connectivetissue)又称蜂窝组织(areolar tissue),其特点是细胞种类较多,纤维较少,排列稀疏。疏松结缔组织在体内广泛分布,位于器官之间、组织之间以至细胞之间,起连接、支持、营养、防御、保护和修复等功能。
疏松结缔的组成如下:
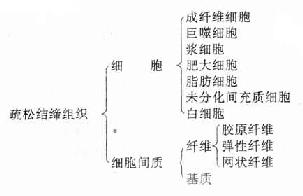
(一)细胞
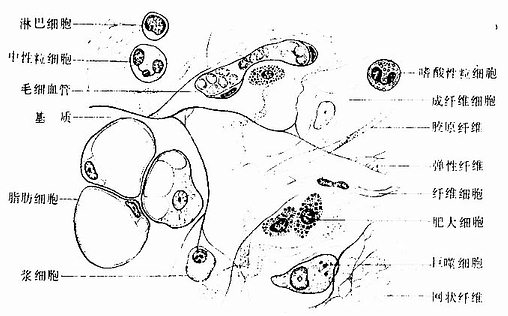
图3-2 疏松结缔组织铺片模式图
疏松结缔的细胞种类较多,其中包括成纤维细胞、巨噬细胞、浆细胞、肥大细胞、脂肪细胞、未分化的间充质细胞。此外,血液中的白细胞,如嗜酸性粒细胞、淋巴细胞等在炎症反应时也可游走到结缔组织内。各类细胞的数量和分布随疏松结缔组织存在的部位和功能状态而不同。
1.成纤维细胞成纤维细胞(fibroblast)是疏松结缔组织的主要细胞成分。细胞扁平,多突起,呈星状,胞质较丰富呈弱嗜碱性。胞核较大,扁卵圆形,染色质疏松着色浅,核仁明显(图3-2)。在电镜下,胞质内富于粗面内质网、游离核糖体和发达的高尔基复合体,表明细胞合成蛋白质功能旺盛(图3-3,3-4)。成纤维细胞既合成和分泌胶原蛋白,弹性蛋白,生成胶原纤维、网状纤维和弹性纤维,也合成和分泌糖胺多糖和糖蛋白等基质成分。
成纤维细胞处于功能静止状态时,称为纤维细胞(fibrocyte)(图3-3)。细胞变小,呈长梭形,胞核小,着色深,胞质内粗面内质网少、高尔基复合体不发达。在一定条件下,如创伤修复,结缔再生时,纤维细胞又能再转变为成纤维细胞。同时,成纤维细胞也能分裂增生。
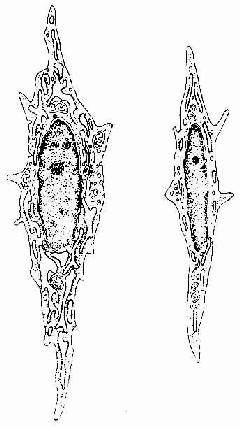
图 3-3 成纤维细胞(左)和纤维细胞(右)超微结构模式图
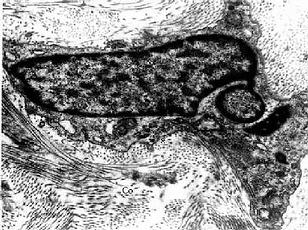
图 3-4 人真皮成纤维细胞电镜像 ×21000
Co胶原原纤维 (上海医科大学电镜室供图)
成纤维细胞常通过基质糖蛋白的介导附着在胶原纤维上。在趋化因子(如淋巴因子、补体等)的吸引下,成纤维细胞能缓慢地向一定方向移动。
2.巨噬细胞巨噬细胞(macrophage)是体内广泛存在的具有强大吞噬功能的细胞。在疏松结缔组织内的巨噬细胞又称为组织细胞(histiocyte),常沿纤维散在分布,在炎症和异物等刺激下活化成游走的巨噬细胞。巨噬细胞形态多样,随功能状态而改变,通常有钝圆形突起,功能活跃者,常伸出较长的伪足而形态不规则。胞核较小,卵圆形或肾形,多为偏心位,着色深,核仁不明显,胞质丰富,多呈嗜酸性,含空泡和异物颗粒,电镜下,细胞表面有许多皱褶、小泡和微绒毛,胞质内含大量初级溶酶体、次级溶酶体、吞噬体、吞饮小泡和残余体。细胞膜附近有较多的微丝和微管(图3-5,3-6)。
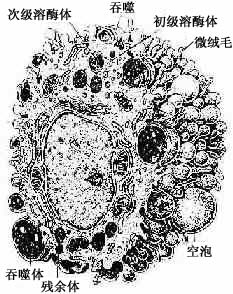
图3-5 巨噬细胞超微结构立体模式图
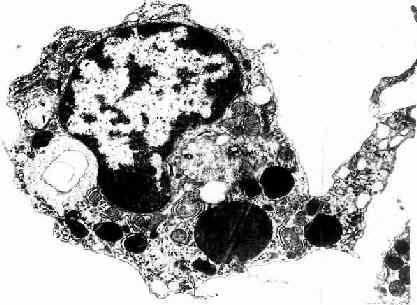
图3-6 猴巨噬细胞电镜像×8400
(白求恩医科大学尹昕、朱秀雄教授供图)
巨噬细胞是由血液内单核细胞穿出血管后分化而成。此时,细胞变大,线粒体及溶酶体增多,粘附和吞噬能力增强。在不同组织器官内的巨噬细胞存活时间不同,一般为2个月或更长。
巨噬细胞有重要的防御功能,它具有趋化性定向运动、吞噬和清除异物及衰老伤亡的细胞、分泌多种生物活性物质以及参与和调节人体免疫应答等功能。
(1)趋化性定向运动:巨噬细胞可沿某些化学物质的浓度梯度进行定向移动,聚集到产生和释放这些化学物质的病变部位,这种特性称为趋化性(chemotaxis)。这类化学物质称为趋化因子(chemotactic factor),如补体C5a、细菌的产物、炎症组织的变性蛋白等。
(2)吞噬作用:巨噬细胞具有强大的吞噬能力,包括非特异性吞噬作用和特异性吞噬作用。巨噬细胞经趋化性定向运动抵达病变部位时,即伸出伪足并粘附和包围细菌、异物、衰老伤亡的细胞等,进而摄入胞质内形成吞噬体或吞饮小泡。吞噬体、吞饮小泡与初级溶酶体融合,形成次级溶酶体,异物颗粒被溶酶体酶消化分解后,成为残余体。
在非特异性吞噬过程中,巨噬细胞直接识别和粘附被吞噬物,如碳粒、粉尘、衰老的细胞和某些细菌。巨噬细胞表面有多种受体,有的能与抗体结合(Fc受体);有的能与补体结合(C3受体);有的能与纤维粘连蛋白结合(纤维粘连蛋白受体),在特异性吞噬过程中,抗体,补体、纤维粘连蛋白作为识别因子先将细菌、病毒、异体细胞、受损伤的细胞等包裹起来,通过它们与巨噬细胞表面相应的受体结合,才能被巨噬细胞识别和粘附,启动巨噬细胞的吞噬过程,并显著增强吞噬作用(图3-7)。这种免疫吞噬作用是巨噬细胞重要的功能特征。
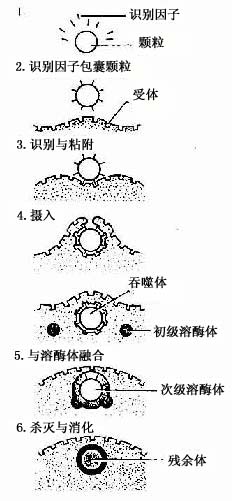
图3-7 巨噬细胞特异性吞噬过程示意图
(3)分泌作用 :巨噬细胞有活跃的分泌功能,能合成和分泌数十种生物活性物质,如溶菌酶(lysozyme)、干扰素(interferon)、补体(complement)等参与机体的防御功能。还能分泌血管生成因子、造血细胞集落刺激因子、血小板活化因子等激活和调节有关细胞功能活动的多种物质。
(4)参与和调节免疫应答:巨噬细胞能捕捉、加工处理和呈递抗原。被巨噬细胞捕捉的抗原经加工处理后,与主要组织相容性复合体(MHC)的Ⅱ类基因产物结合,形成抗原-MHCⅡ类分子复合物贮存在巨噬细胞表面、并呈递给淋巴细胞,启动淋巴细胞发生免疫应答。其次,巨噬细胞本身也是免疫效应细胞,活化的巨噬细胞能杀伤病原体和肿瘤细胞。此外,巨噬细胞分泌的某些生物活性物质如白细胞介素Ⅰ(interleukinⅠ,IL-Ⅰ)、干扰素等也参与调节免疫应答。
3.浆细胞浆细胞(plasmacell)通常在疏松结缔组织内较少,而在病原菌或异性蛋白易于入侵的部位如消化道、呼吸道固有层结缔组织内及慢性炎症部位较多。细胞卵圆形或圆形,核圆形,多偏居细胞一侧,染色质成粗块状沿核膜内面呈辐射状排列。胞质丰富,嗜碱性,核旁有一浅染区(图3-2)。电镜下,胞质内含有大量平行排列的粗面内质网和游离的多核糖体。发达的高尔基复合体和中心体位于核旁浅染区内(图3-8,3-9)。
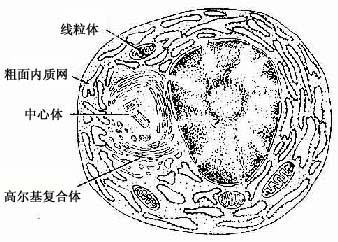
图3-8 浆细胞超微结构模式图
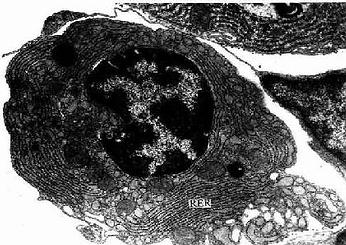
图3-9 猴浆细胞电镜像×10250
RER:粗面内质网
(白求恩医科大学尹昕、朱秀雄教授供图)
浆细胞具有合成、贮存与分泌抗体(antibody)即免疫球蛋白(immunoglobulin,Ig)的功能,参与体液免疫应答。浆细胞来源于B淋巴细胞。在抗原的反复刺激下,B淋巴细胞增殖、分化,转变为浆细胞,产生抗体。抗体能特异性地中和、消除抗原。
4.肥大细胞肥大细胞(mastcell)较大,呈圆形或卵圆形,胞核小而圆,多位于中央。胞质内充满异染性颗粒,颗粒易溶于水(图3-2)。电镜下,颗粒大小不一,圆形或卵圆形,表面有单位膜包裹,内部结构常呈多样性,在深染的基质内含螺状或网格状晶体,或含细粒状物质(图3-10)。肥大细胞分布很广,常沿小血管和小淋巴管分布。
图3-10 大鼠肥大细胞脱颗粒(G)
(同济医科大学阮幼冰教授供图)
肥大细胞与变态反应有密切关系。肥大细胞合成和分泌多种活性介质,包括组胺(histamine)、嗜酸性粒细胞趋化因子(ECF-A)、白三烯(leukotriene)和肝素(heparin)等。组胺、白三烯能使细支气管平滑肌收缩,使微静脉及毛细血管扩张,通透性增加。嗜酸性粒细胞趋化因子能吸引嗜酸性粒细胞到变态反应的部位,肝素则有抗凝血作用。组胺、嗜酸性粒细胞趋化因子和肝素等合成后贮存于颗粒内并能迅速释放。释放时颗粒合并,形成脱粒管道,开口于细胞表面;白三烯则不在颗粒内贮存,其释放较组胺等迟缓(图3-11)。
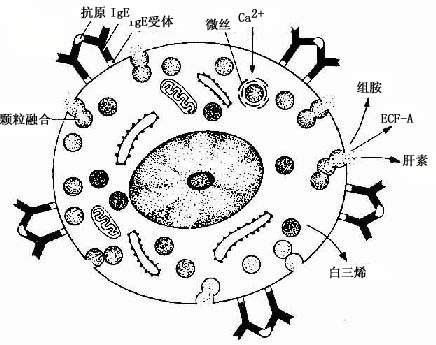
图3-11 肥大细胞脱颗粒示意图
肥大细胞脱颗粒、释放介质是一种特异性反应。机体受过敏原(如花粉、某些药物等)的刺激后,浆细胞产生亲细胞性抗体IgE。肥大细胞膜表面有IgE受体,当IgE与肥大细胞的IgE受体结合后,机体即对该过每原呈致敏状态。当机体再次接触相同的过敏原时,少量的过敏原便可与肥大细胞上的IgE结合,启动肥大细胞脱颗粒,释放介质,引起过敏反应(图3-11),如在皮肤引起荨麻疹,在呼吸道引起支气管哮喘等。
一般认为,肥大细胞的祖细胞来源于骨髓,经血流迁移到结缔组织内,发育为肥大细胞。组织内的肥大细胞可分裂增殖,其寿命数天至数月。
5.脂肪细胞脂肪细胞(fatcell)常沿血管分布,单个或成群存在。细胞体积大,常呈圆球形或相互挤压成多边形。胞质被一个大脂滴推挤到细胞周缘,包绕脂滴。核被挤压成扁圆形,连同部分胞质呈新月形,位于细胞一侧。在HE标本中,脂滴被溶解,细胞呈空泡状(图3-2)。脂肪细胞有合成和贮存脂肪、参与脂质代谢的功能。
6.未分化的间充质细胞未分化的间充质细胞(undifferentiated mesenchymal cell)是保留在成体结缔组织内的一些较原始的细胞,它们保持着间充质细胞的分化潜能,在炎症与创伤时可增殖分化为成纤维细胞、脂肪细胞。间充质细胞常分布在小血管尤其是毛细血管周围,并能分化为血管壁的平滑肌和内皮细胞。
7.白细胞血液内的白细胞,受趋化因子的吸引,常穿出毛细血管和微静脉,游走到疏松结缔组织内,行使其功能,参与免疫应答和炎症反应。疏松结缔组织内以嗜酸性粒细胞、淋巴细胞、中性粒细胞多见。游走出的单核细胞将分化为巨噬细胞。
(二)纤维
1.胶原纤维胶原纤维(collagenousfiber)数量最多,新鲜时呈白色,有光泽,又名白纤维。He 染色切片中呈嗜酸性,着浅红色。纤维粗细不等,直径1-20μm,呈波浪形,并互相交织。胶原原纤维由直径20~200nm的胶原原纤维粘合而成(图3-2)。电镜下,胶原原纤维显明暗交替的周期性横纹,横纹周期约64nm(图3-12)。胶原纤维的韧性大,抗拉力强。胶原纤维的化学成分为Ⅰ型和Ⅱ型胶原蛋白。胶原蛋白(简称胶原,collagen)主要由成纤维细胞分泌。分泌到细胞外的胶原再聚合成胶原原纤维,进而集合成胶原纤维。

图3-12 人胶原纤维电镜像×150000
(同济医科大学武忠弼教授供图)
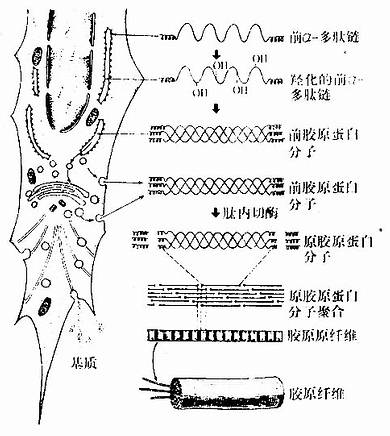
图3-13胶原纤维与基质形成过程示意图
胶原纤维形成的基本过程如下(图3-13):
(1)细胞内合成前胶原蛋白分子:成纤维细胞摄取合成蛋白质所需的氨基酸,包括脯氨酸、赖氨酸和甘氨酸,在粗面内质网的核糖体上按照特定的胶原mRNA的碱基序列,合成前α-多肽链。后者边合成边进入粗面内质网腔内,并在羟化酶的作用下,将肽链中的脯氨酸和赖氨酸羟化。经羟化后,三条前α-多肽链互相缠绕成绳索状的前胶原蛋白分子(procollagen molecule)。溶解状态的前胶原蛋白分子,两端未缠绕,呈球状构型,在粗面内质网腔内或转移到高尔基复合体内加入糖基后,分泌到细胞外。
(2)原胶原蛋白分子的细胞外聚合:细胞外的前胶原蛋白分子,在肽内切酶的作用下,切去分子两端球状构形部分,形成原胶原蛋白分子(tropocol-lagen)粗约1.5nm,长约300nm。原胶原蛋白分子平行排列聚合成胶原原纤维。聚合时,相互平行的相邻分子错开1/4分子长度,同一排的分子,首尾相对并保持一定距离,聚合成束,于是形成具有64nm周期横纹的胶原原纤维。聚合时,分子内、分子间的化学基因进行缩合、交联,增加原纤维的稳固性。若干胶原原纤维经糖蛋白粘合成粗细不等的胶原纤维。
胶原纤维的一菜成受多方面的影响和调控。如细胞内脯氨酸的含量直接影响前α-多肽链的合成。缺氧或缺乏维生素C或Fe2+等辅助因子,导致前α-多肽链的羟化受到抑制,造成前胶原蛋白合成障碍,影响创伤的愈合。聚合时,如胶原蛋白分子内和分子间的交联障碍(常因赖氨酰氧化酶不足所致)将影响胶原纤维的稳固性。除成纤维细胞外,成骨细胞、软骨细胞、某些平滑肌细胞等起源于间充质的细胞以及多种上皮细胞也能产生胶原蛋白。
不同组织的胶原蛋白其分子类型不同,已证实α-多肽链按其一级结构分为α1,α2,α3,三类,各类又分为10型,如α1(Ⅰ)、α1(Ⅱ)、α1(Ⅲ)、α1(Ⅲ)……α1(X)。
根据构成胶原蛋白三股肽链的不同,现已发现有11种不同类型的胶原。现将主要几种类型的组成、分布和特点列举于表(表3-1)。
表3-1 胶原蛋白的类型、分布和特点
| 类型 | 前胶原蛋白 的三股肽链 | 分 布 | 主 要 特 点 |
| Ⅰ | [α1(Ⅰ)]2α2(Ⅰ) | 真皮、筋膜、巩膜、被膜、腱、纤维软骨、骨、牙本质 | 构成致密并有横纹的粗纤维束,抗拉力强 |
| Ⅱ | [α1(Ⅱ)]3 | 透明软骨和弹性软骨 | 构成有横纹的细原纤维,抗压力较强 |
| Ⅲ | [α1(Ⅲ)]3 [α1(Ⅳ)]2α2(Ⅳ) | 网状纤维、平滑肌、神经内膜、动脉、肝、脾、肾、肺、子宫 | 构成有横纹的细原纤维,维持器官的形态结构 |
| Ⅳ |
二、致密结缔组织
致密结缔组织(dense connective tissue)是一种以纤维为主要成分的固有结缔组织,纤维粗大,排列致密,以支持和连接为其主要功能。根据纤维的性质和排列方式,可区分为以下几种类型。
1.规则的致密结缔组织主要构成肌腱和腱膜。大量密集的胶原纤维顺着受力的方向平行排列成束,基质和细胞很少,位于纤维之间。细胞成分主要是腱细胞,它是一种形态特殊的成纤维细胞,胞体伸出多个薄翼状突起插入纤维束之间,胞核扁椭圆形,着色深(图3-16)。

图3-16 肌腱与腱细胞
2.不规则的致密结缔组织见于真皮、硬脑膜、巩膜及许多器官的被膜等,其特点是方向不一的粗大的胶原纤维彼此交织成致密的板层结构,纤维之间含少量基质和成纤维细胞。
3.弹性组织弹性组织(elastic tissue)是以弹性纤维为主的致密结缔组织。粗大的弹性纤维或平行排列成束,如项韧带和黄韧带,以适应脊柱运动;或编织成膜状,如弹性动脉中膜,以缓冲血流压力。
机体内还有一些部位的结缔组织、纤维细密,细胞种类和数量较多,常称为细密结缔组织,如消化道和呼吸道粘膜的结缔组织。
三、脂肪组织
脂肪组织(adipose tissue)主要由大量群集的脂肪细胞构成,由疏松结缔组织分隔成小叶(图3-17)。根据脂肪细胞结构和功能的不同,脂肪组织分为两类。
1.黄(白)色脂肪组织呈黄色 (在某些哺乳动物呈白色),即通常所说的脂肪组织。它由大量单泡脂肪细胞集聚而成,细胞中央有一大脂滴,胞质呈薄层,位于细胞周缘,包绕脂滴。在HE切片上,脂滴被溶解成一大空泡。胞核扁圆形,被脂滴推挤到细胞一侧,连同部分胞质呈新月形(图3-18)。黄色脂肪组织主要分布在皮下、网膜和系膜等处,约占成人体重的10%,是体内最大的贮能库,参与能量代谢,并具有产生热量、维持体温、缓冲保护和支持填充等作用。
图3-17 脂肪组织
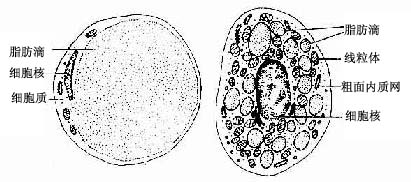
图3-18 单泡脂肪细胞和多泡脂肪细胞超微结构模式图
2.棕色脂肪组织呈棕色,其特点是组织中有丰富的毛细血管,脂肪细胞内散在许多小脂滴,线粒体大而丰富,核圆形,位于细胞中央。这种脂肪细胞称为多泡脂肪细胞(图3-18)。
棕色脂肪组织在成人极少,新生儿及冬眠动物较多,在新生儿主要分布在肩胛间区、腋窝及颈后部等处。棕色脂肪组织的主要功能是,在寒冷的刺激下,棕色脂肪细胞内的脂类分解、氧化,散发大量热能,而不转变为化学能。这一功能受交感神经调节。
四、网状组织
网状组织(reticular tissue)是造血器官和淋巴器官的基本组织成分,由网状细胞(reticular cell)、网状纤维和基质构成。网状细胞是有突起的星状细胞,相邻细胞的突起相互连接成网(图3-19)。胞核较大,圆或卵圆形,着色浅,常可见1~2个核仁。胞质较多,粗面内质网较发达。
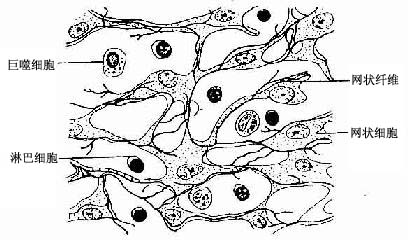
图3-19 网状组织
网状细胞产生网状纤维。网状纤维分支交错,连接成网,并可深陷于网状细胞的胞体和突起内,成为网状细胞依附的支架。网状组织为淋巴细胞发育和血细胞发生提供适宜的微环境。
第四章 软骨和骨
软骨与骨是构成身体支架的器官,它们分别以软骨组织和骨组织为主要结构成分。在人的一生中,这两种组织尤其是骨组织能不断更新和改建,从而适应成年前机体的生长发育和成年后机体支持功能的变化需求。人体99%以上的钙和85%的磷以羟基磷灰石的形式贮于骨组织中,因而骨又是人体的钙、磷贮存库。
一、软骨
软骨(cartilage)由软骨组织及其周围的软骨膜构成。软骨是固态的结缔组织,略有弹性,能承受压力和耐磨擦,有一定的支持和保护作用。胎儿早期的躯干和四肢支架主要为软骨,至成体,软骨仅分布于关节面、椎间盘、某些骨连接部位、呼吸道及耳廓等处。软骨组织由软骨细胞、基质及纤维构成。根据软骨组织所含纤维的不同,可将软骨分为透明软骨、纤维软骨和弹性软骨三种。
(一)透明软骨
透明软骨(hyaline cartilage)分布较广,成体的关节软骨、肋软骨及呼吸道的一些软骨均属这种软骨。新鲜时呈半透明状,较脆,易折断。透明软骨间质中的纤维为胶原原纤维,含量较少,基质较丰富。
1.透明软骨的结构
(1)软骨细胞(chondrocyte):位于软骨基质内的小腔――软骨陷窝(cartilage lacuna)中。陷窝周围有一层含硫酸软骨素较多的基质,称软骨囊(cartilage capsule),染色时呈强嗜碱性。软骨细胞在软骨内的分布有一定规律,靠近软骨膜的软骨细胞较幼稚,体积小,呈扁圆形,单个分布;位于软骨中部的软骨细胞接近圆形,成群分布,每群有2~8个细胞,它们是由一个细胞分裂增生而成,故称同源细胞群(isogenous group)。同源细胞群中的细胞分别围以软骨囊。软骨细胞核呈椭圆形,细胞质弱嗜碱性。新鲜软骨的软骨细胞充满于软骨陷窝内。但在HE染色切片中,细胞收缩成不规则形,故软骨囊和细胞之间出现较大的空隙(图4-1)。软骨细胞的超微结构特点是胞质内有丰富的粗面内质网和发达的高尔基复合体,还有一些糖原和脂滴,线粒体较少(图4-2)。软骨细胞主要以糖酵解方式获得能量。
(2)基质:透明软骨基质的化学成分主要为嗜碱性软骨粘蛋白,它以长链的透明质酸分子为主干,干链上以许多较短的蛋白质链连接硫酸软骨素A、C和硫酸角质素(见图3-15)。这种羽状分支的大分子结合着大量的水,大分子又引互结合构成分子筛,并和胶原原纤维结合在一起形成固态结构。软骨内无血管,但由于软骨基质内富含水分(约占软骨基质的75%),通透性强,故软骨深层的软骨细胞仍能获得必需的营养。
(3)纤维:透明软骨中无胶原纤维,但有一些由Ⅱ型胶原组成的胶原原纤维,它们呈交织状分布(图4-2)。胶原原纤维直径为10~20nm,无明显横纹,其折光率与基质相近,故在光镜下不易分辨。软骨囊含硫酸软骨素较多,含胶原原纤维少或无,故嗜碱性较强。软骨囊之间则含胶原原纤维较多,故呈弱嗜酸性。
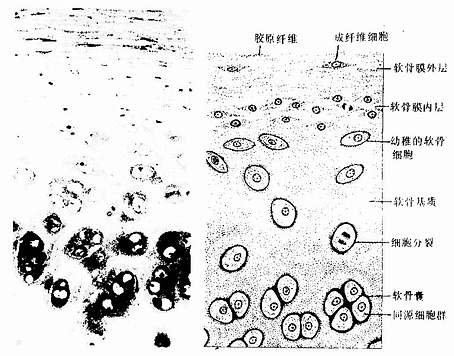
图4-1 透明软骨
左图为人气管透明软骨 HE×100
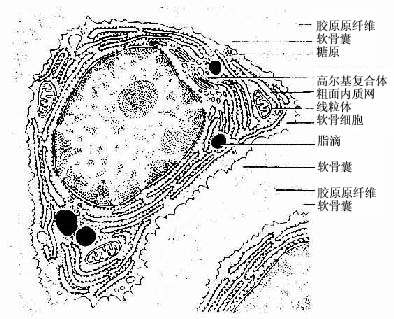
图4-2 透明软骨超微结构模式图
2.软骨膜除关节面的关节软骨外,软骨的表面均覆有较致密的结缔组织,即软骨膜(perichondrium)。软骨膜分内、外二层,外层纤维多,细胞少,主要起保护作用,内层纤维少,细胞较多,其中有些梭形小细胞,称骨原细胞,可增殖分化为软骨细胞(图4-1)。软骨的营养来自软骨周围的血管,并可通过软骨膜渗透至软骨内部,供应软骨细胞。
3.软骨的生长方式软骨有两种并存的生长方式
(1)间质生长(interstitial growth):或称软骨内生长,是通过软骨内软骨细胞的长大和分裂,进而不断地产生基质和纤维,使软骨从内部生长增大。
(2)外加生长(appositional growth):或称软骨膜下生长,是通过软骨膜内层的骨原细胞向软骨表面不断添加新的软骨细胞,产生基质和纤维,使软骨从表面向外扩大。
(二)纤维软骨
纤维软骨(fibrous cartilage)分布于椎间盘、关节盘及耻骨联合等处。结构特点是有大量呈平行或交错排列的胶原纤维束,软骨细胞较小而少,常成行分布于纤维束之间(图4-3)。HE染色切片中,胶原纤维染成红色,纤维束间的基质很少,呈弱嗜碱性,软骨囊则呈强嗜碱性。
(三)弹性软骨
弹性软骨(elastic cartilage)分布于耳廓及会厌等处。结构特点是间质中有大量交织分布的弹性纤维,软骨中部的纤维更为密集(图4-4)。弹性软骨具有较强的弹性。
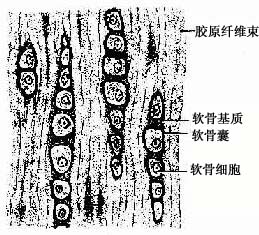
图4-3 纤维软骨
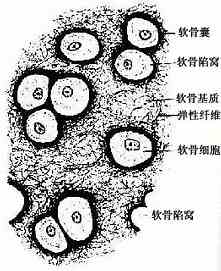
图4-4 弹性软骨
二、骨
骨由骨组织、骨膜及骨髓等构成。骨组织是坚硬而有一定韧性的结缔组织。
(一)骨组织的结构
骨组织(osseous tissue)由大量钙化的细胞间质及数种细胞组成。钙化的细胞间质称为骨基质(bone matrix)。细胞有骨原细胞、成骨细胞、骨细胞及破骨细胞四种。骨细胞最多,位于骨基质内,其余三种细胞均位于骨组织的边缘(图4-5)。
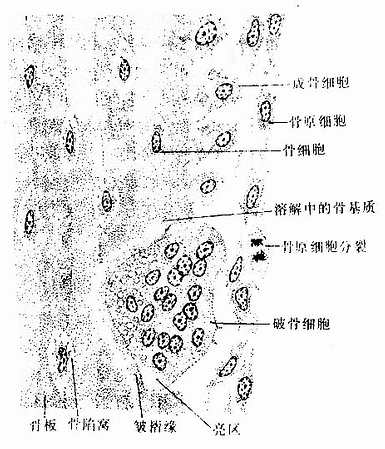
图4-5 骨组织和各种细胞
1.骨基质即骨的细胞间质,由有机成分和无机成分构成,含水极少。有机成分由成骨细胞分泌形成,包括大量胶原纤维(占有机成分的95%)及少量无定形基质。无定形基质为凝胶,内含中性或弱碱性糖胺多糖,有粘着胶原原纤维的作用。基质中还含有两种钙结合蛋白:骨钙蛋白(osteocalcin)和骨磷蛋白(phosphophoryms)。前者有两个与钙亲合力强的部位,后者则有许多钙结合部位,但只有一部分骨磷蛋白是可溶性的,其余均与胶原纤维相结合。钙结合蛋白与钙化及钙的运输有关。无机成分又称骨盐(bone mineral),主要为羟磷灰石结晶(hydroxyapatite crystal,(Ca10(PO4)6( OH )2),属不溶性中性盐,呈细针状,长10~20nm,沿胶原原纤维长轴规则排列并与之结合。有机成分与无机成分的紧密结合使骨十分坚硬。
骨基质结构呈板层状,称为骨板(bone lamella),成层排列的骨板犹如多层木质胶合板。同一骨板内的纤维相互平行,相邻骨板的纤维则相互垂直,这种结构形式有效地增强了骨的支持力。
2.骨组织的细胞
(1)骨细胞(osteocyte):单个分散于骨板内或骨板间。骨细胞是有许多细长突起的细胞,胞体较小,呈扁椭圆形,其所在空隙称骨陷窝(bone lacuna),突起所在的空隙称骨小管(bone canaliculi)(图4-6)。相邻骨细胞的突起以缝隙连接相连,骨小管则彼此连通。骨陷窝和骨小管内含组织液,可营养骨细胞和输送代谢产物(图4-7)。骨陷窝周围的薄层骨基质钙化程度较低,并可不断更新,在机体需要时,骨细胞的溶骨作用可溶解此层骨基质,使Ca2+释放入骨陷窝的组织液中,继而进入血液,对维持血钙的恒态水平有一定作用。
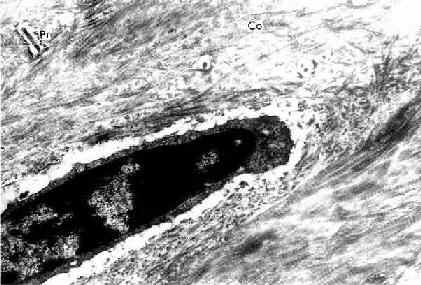
图4-6 小鼠骨细胞和骨基质(脱钙后)电镜像×25000
Pr骨细胞突起和骨小管,Co胶原原纤维
(上海医科大学电镜室供图)
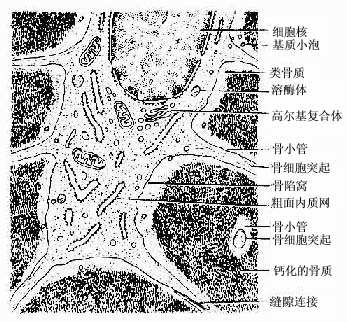
图4-7 骨细胞超微结构模式图
(2)骨原细胞(osteogenic cell):是骨组织中的干细胞,位于骨外膜及骨内膜贴近骨处。细胞较小,呈梭形,核椭圆形,细胞质少,弱嗜碱性。当骨组织生长或改建时,骨原细胞能分裂分化为成骨细胞(图4-5)。
(3)成骨细胞(osteoblast):分布在骨组织表面,成年前较多,常排成一层,成年后较少。成骨细胞是具有细小突起的细胞,胞体呈矮柱状或椭圆形,其突起常伸入骨质表层的骨小管内,与表层骨细胞的突起形成连接。核圆形,多位于细胞的游离端(图4-5)。胞质嗜碱性,电镜下可见大量粗面内质网和发达的高尔基复合体。成骨时,成骨细胞分泌骨基质的有机成分,称为类骨质(osteoid),同时以类似顶浆分泌的方式向类骨质中释放一些小泡,称基质小泡(matrix vesicle)。基质小泡直径约0.1μm,有膜包被,膜上有碱性磷酸酶、焦磷酸酶和ATP酶,泡内含钙和小的羟磷灰石结晶。一般认为,基质小泡是使类骨质钙化的重要结构。近年发现,骨基质中的钙结合蛋白均由成骨细胞分泌产生。当成骨细胞被类骨质包埋后,便成为骨细胞。
(4)破骨细胞(osteoclast):主要在骨组织表面,数目较少。破骨细胞是一种多核的大细胞,直径约100μm,含有2-50个核。目前认为它由多个单核细胞融合而成,无分裂能力。光镜下,破骨细胞贴近骨基质的一侧有纹状缘(图4-5),胞质呈泡沫状,在HE染色的切片中胞质易为伊红染色。电镜下可其贴近骨基质一侧有许多不规则的微绒毛,称为皱褶缘(ruffled border)(图4-8),即光镜下的纹状缘。在皱褶缘的周缘有一环形胞质区,内有多量微丝,而无其它细胞器,称为亮区(clear zone)。亮区的细胞膜平整并紧贴于骨基质表面,形成一道环形胞质围墙,使所包围的区域成为封闭的微环境区。破骨细胞功能活跃时,向此区释放多种蛋白酶、碳酸酐酶、乳酸及柠檬酸等,在酶及酸的作用下使骨基质溶解。皱褶缘可增大吸收面积,电镜下可见皱褶缘基部有吞饮泡和吞噬泡,泡内含小骨盐晶体及解体的有机成分,表明破骨细胞有溶解和吸收骨基质的作用。
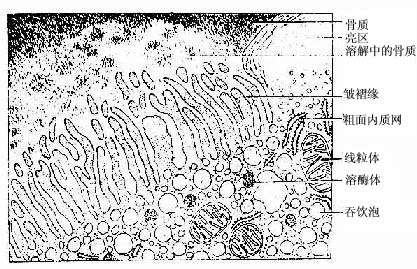
图4-8 破骨细胞超微结构模式图
(二)长骨的结构
长骨由骨松质、骨密质、骨膜、关节软骨及血管、神经等构成。
1.骨松质(spongy bone) 分布于长骨的骨骺和骨干的内侧份,是大量针状或片状骨小梁相互连接而成的多孔隙网架结构,网孔即骨髓腔,其中充满骨髓。骨小梁厚度一般为0.1-0.4mm,由数层平行排列的骨板和骨细胞构成(图4-9)。骨小管穿行表层骨板开口于骨髓腔,骨细胞从中获得营养并排出代谢产物。
2.骨密质(compact bone) 分布于长骨骨干和骨骺的外侧份。骨密质内的骨板排列很有规律,按骨板排列方工可分为环骨板、骨单位和间骨板。
(1)环骨板(circumferential lamella):分布于长骨干的外侧面及近骨髓腔的内侧面,分别称为外环骨板及内环骨板。外环骨板较厚,约有10~40层,较整齐地环绕骨干排列(图4-9)。内环骨板较薄,仅由数层骨板组成,排列不甚规则。外环骨板及内环骨板均有横向穿越的小管,统称穿通管(perforating canal,又称Volkmann管)。穿通管与纵行排列的骨单位中央管相通连(图4-9),它们都是小血管、神经及骨膜成分的通道,并含有组织液。
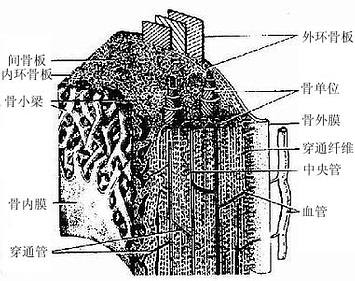
图4-9 长骨骨干结构模式图
(2)骨单位(osteon):又称哈弗系统(Haversian system),是长骨干起支持作用的主要结构单位。骨单位位于内、外环骨板之间在,数量较多,呈筒状,直径30~70μm,长0.6~2.5mm,由10~20层同心圆排列的骨板(哈弗骨板)围成。各层骨板之间有骨细胞。各层骨细胞的突起经骨小管穿越骨板相互连接。骨单位的中轴有一中央管(central canal),或称哈弗管(Haversian canal)(图4-9,4-10),内含骨膜组织、毛细血管(有的是微动静脉)和神经。
各个骨单位表面都有一层厚约2μm的粘合质,是一层含骨盐多而胶原纤维少或缺如的骨基质,在骨的横磨片上呈折光较强的轮廓线,称粘合线(cement line)(图4-10)。骨单位周边部的骨小管都在粘合线以内返折,不与相邻单位表面的骨小管通连。骨单位最内层的骨小管均开口于中央管,使每一骨单位内的骨细胞均能通过相互通连的骨小管获得营养。骨的内、外环骨板与骨单位交界处也有粘合线,但不如骨单位之间的明显。
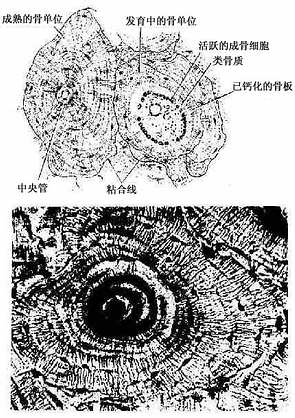
图4-10 骨单位
下图为人骨脱钙后冷冻切片硫堇染色×400
(上海医科大学组织胚胎学教研室供图)
(3)间骨板(interstitial lamella): 是填充在骨单位之间的一些不规则的平行骨板,它们是原有的骨单位或内外环骨板未被吸收的残留部分,其中除骨陷窝及骨小管外,无其它管道(图4-9)。
3.骨膜除关节面以外,骨的内、外表面分别覆以骨内膜和骨外膜。骨外膜(periosteum)分为两层:外层较厚,为致密结缔组织,纤维粗大而密集,有的纤维横向穿入外环骨板,称穿通纤维(perforating fiber)或Sharpey纤维,起固定骨膜和韧带的作用;内层较薄,结缔组织疏松,含骨原细胞和成骨细胞及小血管和神经。在骨髓腔面、骨小梁的表面、中央管及穿通管的内表面均衬有薄层结缔组织,即骨内膜(endosteum)。骨内膜的纤维细而少,细胞常排列成一层,颇似单层扁平上皮,细胞之间有缝隙连接,它们与骨细胞突起之间也有缝隙连接。这些细胞能分裂分化为成骨细胞。还有人认为这种细胞具有离子屏障功能,其作用是分隔骨细胞周液和骨髓腔内的组织液,使骨细胞周液维持一定的钙、磷浓度,有利于骨盐结晶的形成。
三、骨的发生
骨由间充质发生。从胚胎早期间充质向骨原基分化起始,到骨发育完善为止,历时约20年以上。骨的发育经历为断生长与改建的复杂演变,具体表现为两个方面,即骨组织形成与骨组织分解吸收,两者相辅相成。骨发育完善后,仍保持形成与分解吸收交替进行的内部改建,终身不止,但改建速度随年龄增长而逐渐缓慢。
骨的发生有两种方式:膜内成骨(intramembranous ossification)与软骨内成骨(endochondral ossification)
(一)膜内成骨
这种方式是先由间充质分化成为胚性结缔组织膜,然后在此膜内成骨。人体的顶骨、额骨和锁骨等即以此种方式发生。膜内成骨的具体的过程是:在将要形成骨的部位,血管增生,营养及氧供丰富;间充质细胞渐密集并分裂分化为骨原细胞,其中部分骨原细胞增大,成为成骨细胞;成骨细胞分泌类骨质,并被包埋其中,成为骨细胞;继而类骨质钙化成骨基质,形成最早出现的骨组织。最早形成骨组织的部位称为骨化中心(ossification center)。新形成的骨组织表面始终有成骨细胞或骨原细胞附着,它们向周围成骨,逐渐形成初级骨小梁(图4-11),构成初级骨松质。随后,初级骨松质周围的间充质分化为骨膜,此后即进入生长与改建阶段。以顶骨为例,随着脑的发育,原始顶骨也不断生长与改建,其外表面以成骨为主,使骨不断生长,内表面以分解吸收为主,为断改变骨的曲度,从而使顶骨的生长与脑的发育相适应。通过生长与内部改建,顶骨出现了以初级骨密质组成的外板与内板,以及其间由骨松质组成的板障,但至成年才发育完善。成年后其内部改建仍缓慢地进行。
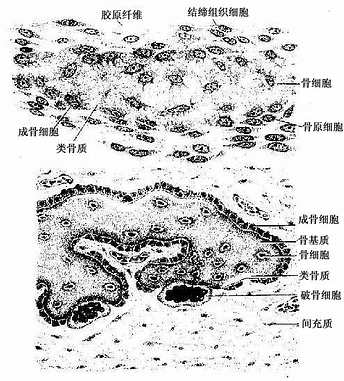
图4-11 膜内成骨过程
上图 骨化中心,类骨质形成 下图 形成初级骨小梁
(二)软骨内成骨
胎儿的大多数骨,如四肢骨、躯干骨及颅底骨等,均主要以软骨内成骨的方式发生。这种骨发生既包括与膜内成骨相似的发生过程,又包括软骨的持续生长与退化,以及软骨组织不断被骨组织取代的特有发生过程,而且其发生、生长与改建穿插交错的情况远较膜内成骨复杂。现以长骨的发生为例(图4-12)叙述如下。
1.软骨雏形形成在长骨将要发生的部位,间充质细胞密集并分化出骨原细胞,后者继而分化为软骨细胞。软骨细胞分泌软骨基质,细胞也被包埋其中,成为软骨组织。周围的间充质分化为软骨膜,于是形成一块透明软骨。其外形与将要形成的长骨相似,被称为软骨雏形(cartilage model)。
2.软骨周骨化是指软骨雏形中段周围产的骨形成。其过程先是软骨膜内出现血管,由于营养及氧供应充分,软骨膜深层的骨原细胞分裂并分化为成骨细胞。成骨细胞在软骨表面产生类骨质,自身也被包埋其中而成为骨细胞。类骨质随后钙化为骨基质,于是形成一圈包绕软骨中段的薄层初级骨松质。因此层骨松质犹如领圈,故名骨领(bone collar)。骨领表面的软骨膜从此改称骨外膜。骨外膜深层的骨原细胞不断分化为成骨细胞,向骨领表面及其两端添加新的骨小梁,使骨领的初级骨松质逐渐增厚,并从软骨中段向两端延伸。随着胚胎的发育,骨领初级骨松质中的成骨细胞不断向骨小梁壁上添加骨组织,使骨小梁的网孔逐渐变小。此过程的持续使初级骨松质逐渐成为初级骨密质。
3.软骨内骨化
(1)软骨退化与初级骨化中心形成:在骨领形成的同时,软骨雏形中段内的软骨细胞肥大并分泌碱性磷酸酶,使其周围的软骨基质钙化及肥大的软骨细胞自身退化死亡,留下较大的软骨陷窝。此变化示初级骨化中心即将在该区形成。初级骨化中心(primary ossification center)形成之初,血管连同破骨细胞及间充质等经骨外膜穿越骨领,进入退化软骨区,通过破骨细胞分解吸收钙化的软骨基质,形成许多与原始骨干长轴平行的隧道。隧道的壁为残存的钙化软骨基质,隧道的腔即初级骨髓腔。腔内充以来自间充质的骨原细胞和成骨细胞,以及破骨细胞和正在形成中的造血组织等,统称初级骨髓(primary bone marrow)。随后成骨细胞贴附于原始骨髓腔壁上(即残留的钙化软骨基质表面)生成骨组织,形成以钙化软骨基质为中轴表面附以骨组织的过渡型骨小梁。最开始出现过渡型骨小梁的部位即初级骨化中心。
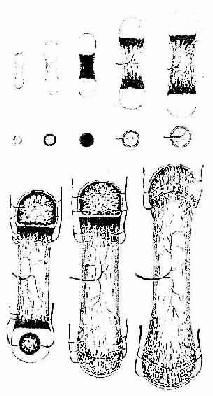
图4-12 软骨内成骨过程
中排为上排中段的横切面,小点示透明软骨,黑色
示钙化软骨基质,斜线示骨组织
(2)骨髓腔形成与骨的增长:初级骨化中心的过渡型骨小梁不久便被破骨细胞分解吸收,使许多初级骨髓腔合成一个较大的次级骨髓腔。骨领的内表面也逐渐被破骨细胞分解吸收。骨领的这种边形成边分解吸收的成骨过程,使骨干在增粗的同时保持骨组织的适当厚度,并使骨髓腔得以横向扩大。由于初级骨化中心两端的软骨组织不断生长,紧邻骨髓腔的软骨又不断退化,使初级骨化中心的骨化过程得以从骨干中段持续向两端进行,骨髓腔也随之纵向扩展。胎儿长骨的纵切面上,在骨的两端可观察到软骨内骨化的连续过程,表现为从软骨至骨干中段的骨髓腔之间,可依次分为下列代表成骨活动的四区(彩图4-13)。
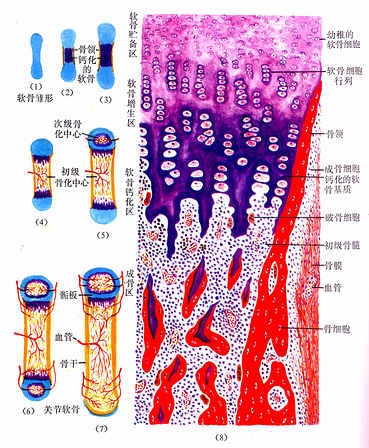
图4-13 长骨发生与生长 (1)~(7)示软骨内成骨及长骨生长
(8)示软骨被骨取代过程
软骨储备区(zone of reserve cartilage):软骨细胞较小,分散存在。软骨基质呈弱嗜碱性。
软骨增生区(zone of proliferating cartilage):软骨细胞较大,通过分裂形成的同源细胞群纵列成行,形成软骨细胞柱。
软骨钙化区(zone of calcifying cartilage):软骨细胞肥大,呈空泡状,核固缩,可见退化死亡软骨细胞留下的大陷窝。钙化的软骨基质呈强嗜碱性。
成骨区(zone of ossification):可见中轴为钙化软骨基质和表面为骨组织的过渡型骨小梁,小梁之间为隧道式初级骨髓腔。腔内有造血组织及血管,腔壁(即骨小梁表面)可见成骨细胞附着,破骨细胞也附骨小梁表面,附着处有凹陷,表明此处的骨基质已被分解吸收。
(3)次级骨化中心出现及骨骺形成:次级骨化中心(secondary ossification center)出现的时间因骨而异,早自出生前,晚至出生后数月或数年不等。出现的部位在骨干两端的软骨中央。次级骨化中心的发生过程与初级骨化中心相似。但骨化是从中央呈辐射状向四周进行的。最后以初级骨松质取代绝大部分软骨组织,使骨干两端转变成为早期骨骺。骺端表面始终保留薄层软骨,即关节软骨。早期骨骺与骨干之间亦保留一定厚度的软骨层,即骺软骨,称骺板(epiphyseal plate)(图4-12,4-13)。骺板软骨细胞继续分裂增殖及退化,破骨细胞及成骨细胞则不断从骨髓腔侧分解吸收钙化的软骨基质,并形成过渡型骨小梁,使骨化不断向两端推进,长骨因而不断增长(图4-14)至17-20岁时,骺板停止生长而被骨小梁取代,在长骨的干、骺之间留下线性痕迹,称为骺线(epiphyseal line)。早期骨骺通过生长及改建,最终形成内部为骨松质、表面为薄层骨密质的骨骺。
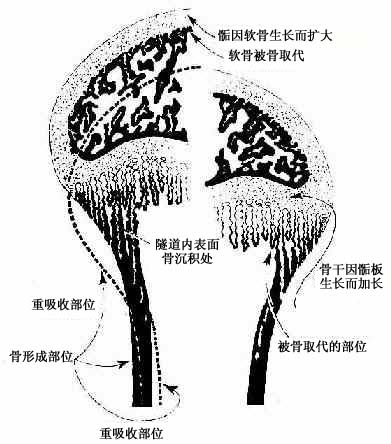
图4-14骨干骨密质形成和外形变化及骨骺发育示意图
(4)骨干骨密质形成及改建:构成原始骨干的初级骨松质,通过骨小梁增厚而使小梁之间的网孔变小,逐渐成为初级骨密质。初级骨密质中既无骨单位及间骨板,也不存在外、内环骨板。至1岁左右,由于破骨细胞在原始骨密质外表面顺长轴进行分解吸收,渐形成凹向深面的纵沟。骨外膜的血管及骨原细胞等随之进入沟内,由骨原细胞分化为成骨细胞造骨,先将纵沟封闭成管,再贴附于管壁表面,形成自外向内呈同心圆式排列的哈弗骨板。其中轴始终保留一条血管通道,即中央管。管内尚存的骨原细胞贴附于最内层哈弗骨板内表面,成为骨内膜。此即第一代骨单位(哈弗系统)的形成过程(图4-15)。第一代骨单位的形成是在初级骨密质被分解吸收的基础上进行的,故此代骨单位之间有残存的初级骨密质。以后第一代骨单位逐渐被第二代骨单位取代,残留的第一代骨单位片段便成为第二代骨单位之间的间骨板(图4-16)。后代骨单位取换前代的过程,称为骨单位改建。骨单位的出现与改建使初级骨密质成为次级骨密质。骨干伴随骨单位的相继形成而增粗,骨髓腔也因而明显扩大,成年后骨干不再增长,其内、外表面已出现环骨板。外环骨板的增厚约止于30岁左右,发育完善的骨干从此不再增粗,但其内部的骨单位改建仍持续进行。
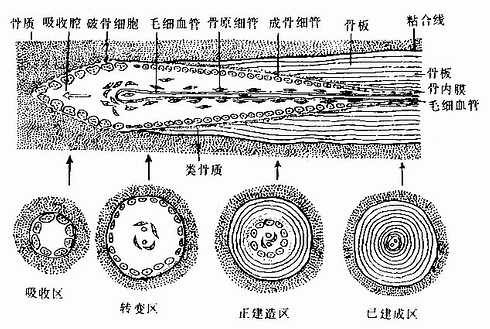
图4-15 骨单位形成过程模式图
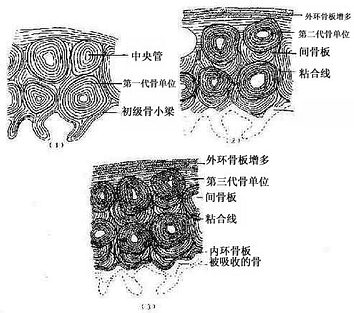
图4-16 骨密质改建示意图
(三)影响骨生长的因素
影响骨生长的因素很多,内因如遗传基因的表达和激素的作用等,外因如营养及维生素供应等。生长激素和甲状腺素可明显促进骺板软骨生长,若成年前这两种激素分泌过少,可致骺板软骨生长缓慢,肢体短小而成侏儒;若生长激素分泌过多,则骺板生长加速,可导致巨人症。甲状旁腺素通过反馈机制调节血钙水平,其调节方式是激活骨细胞和破骨细胞,通过溶骨作用分解骨盐,释放Ca2+入血,从而提高血钙水平。甲状旁腺素过多,有可能因骨盐大量分解而导致纤维性骨炎。降钙素能抑制骨盐溶解,并刺激骨原细胞分化为成骨细胞,增强成骨活动,使血钙入骨形成骨盐。雌激素可与成骨细胞膜上的雌激素受体结合,使其成骨活跃,产生足量的钙结合蛋白,促进类骨质的钙化。雌激素不足往往出现骨盐分解吸收过多,骨基质形成减少,绝经期妇女的骨质疏松症即起因于雌激素的不足。性腺发育不全可导致生长障碍而影响身高,肾上腺分泌的糖皮质激素对骨的形成有抑制作用。
维生素A可影响骨的生长速度,严重缺乏时骺板生长缓慢,以致骨生长迟缓甚至停止,维生素A过多则使破骨细胞过度活跃而易发生骨折,维生素C与成骨细胞合成胶原纤维有关,严重缺乏时,因骨的胶原纤维过少而易发生骨折,且骨折愈合极为缓慢。维生素D能影响骨钙的沉积,与类骨质能否及时钙化有关。儿童期缺乏维生素D可导致佝偻病,成人缺乏可导致骨软化症。近年发现成骨细胞表面有1,25-羟维生素D3(简称D3)受体,D3既可刺激成骨细胞分泌较多的钙结合蛋白,又能提高性碱性磷酸酶的活性而促进骨的钙化,临床疗效较好。
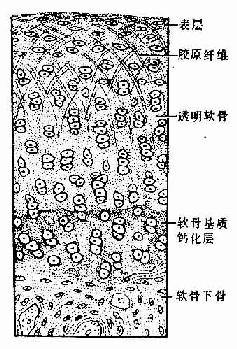
图4-17 关节软骨
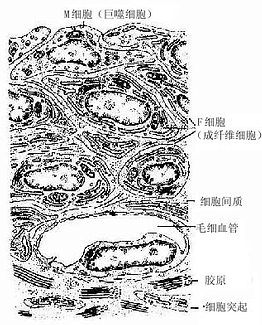
图4-18 滑腊超微结构模图
新近还发现骨内存在一些生物活性物质,通过分离和纯化骨的各种细胞和骨体外培养等研究,已肯定有些活性物质是由成骨细胞产生的。这些活性物质分别对成骨细胞及破骨细胞起激活或抑制作用,有的表现出旁分泌或自分泌作用。由于这些物质的改建密切有关,因此有人认为骨内存在着使骨生成与骨分解吸收相偶联的偶联因子。例如转化生长因子-β(TGF-β)、前列腺素、白细胞介素1和6、巨噬细胞释放的肽刺激因子等。
其它如细胞外钙、氧自由基特别是超氧阴离子、二萜烯等均能影响骨的生长发育。
四、关节
关节分可动与不可动两大类型。可动关节的结构比较复杂,由关节软骨、关节囊及滑液等构成。
1.关节软骨关节软骨(articular cartilage)为关节表面的薄层透明软骨,表面光滑,附有滑液,可减小关节运动时的磨擦力。关节软骨与一般的透明软骨有一定差异,表层的细胞较小,单个分布,深层的细胞较大,成行分布,近骨部的软骨基质钙化,钙化的软骨组织与骨骺的骨组织相连接,整个关节软骨基质内的胶原原纤维呈拱形排列,有加固软骨组织的作用(图4-17)。关节软骨的营养由滑液供应。
2.关节囊关节囊(articular capsule)可分内外两层。外层纤维排列紧密,与腱和韧带相连处明显增厚;内层较疏松,称为滑膜(synovial membrane)。滑膜内层常被覆2~4层扁平或立方形的上皮样结缔组织细胞,称为滑膜细胞(synovial cell),其基部无基膜,细胞间避孕药少量间质或纤维。电镜下可区分出两种滑膜细胞,一种似巨噬细胞,称M细胞,含溶酶体较多,有吞噬力;另一种似成纤维细胞,称F细胞,含粗而内质网较多,能分泌透明质酸和一些粘蛋白,组成滑液(图4-18)。
3.滑液滑液(synovial fluid)是关节囊内的少量透明粘性液体,其中除含大量水、透明质酸和粘液蛋白外,还含有少量细胞,主要为淋巴细胞和巨噬细胞。若所含细胞数量增多(>300个/μ1),特别是中性粒细胞增多,可作为病变的指征。
第五章 血液和血细胞发生
一.血液
血液(blood)约占体重的7%,在成人循环血容量约5L。血液由血浆(plasma)和血细胞(blood cell)组成。从血管取少量血液加入适量抗凝剂(如肝素或枸橼酸钠),有形成分经自然沉降或离心沉淀后,血液可分出三层:上层为淡黄色的血浆,下层为红细胞,中间的薄层为白细胞和血小板(图5-1)。血浆相当于结缔组织的细胞间质,约占血液容积的55%,其中90%是水,其余为血浆蛋白(白蛋白、球蛋白、纤维蛋白原)、脂蛋白、脂滴、无机盐、酶、激素、维生素和各种代谢产物。血液流出血管后,溶解状态的纤维蛋白原转变为不溶解状态的纤维蛋白,于是凝固成血块。血块静置后即析出淡黄色清明的液体,称血清(serum)。血液保持一定的比重(1.050~1.060)、PH(7.3~7.4)渗透压(313mosm)粘滞性和化学成分,以维持各种组织和细胞生理活动所需的适宜条件。
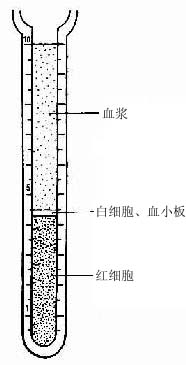
图5-1 血浆、白细胞和红细胞比积
血细胞约占血液容积的45%,包括红细胞、白细胞和血小板。在正常生理情况下,血细胞和血小板有一定的形态结构,并有相对稳定的数量。血细胞形态结构的光镜观察,通常采用Wright或Giemsa染色的血涂片标本。血细胞分类和计数的正常值如下:

血细胞形态、数量、比例和血红蛋白含量的测定称为血像。患病时,血像常有显著变化,故检查血像对了解机体状况和诊断疾病十分重要。
(一)红细胞
红细胞(erythrocyte,red blood cell)直径7~8.5μm,呈双凹圆盘状,中央较薄(1.0μm),周缘较厚(2.0μm),故在血涂片标本中呈中央染色较浅、周缘较深(彩图5-2)。在扫描电镜下,可清楚地显示红细胞这种形态特点(图5-3)。红细胞的这种形态使它具有较大的表面积(约140μm2),从而能最大限度地适应其功能――携O2和CO2。新鲜单个红细胞为黄绿色,大量红细胞使血液呈猩红色,而且多个红细胞常叠连一起呈串钱状,称红细胞缗线。
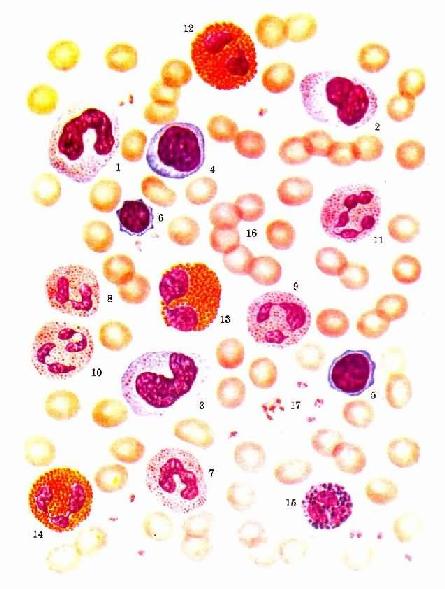
图5-2 各种血细胞 1.2.3.单核细胞 4.5.6.淋巴细胞 7.8.9.10.11.中性粒细胞
12.13.14.嗜酸性粒细胞 15.嗜酸性粒细胞 16.红细胞 17.血小板.

图5-3 人红细胞扫描电镜像 ×4800
(白求恩医科大学组织胚胎学教研究室供图)
红细胞有一定的弹性和可塑性,细胞通过毛细血管时可改变形状。红细胞正常形态的保持需ATP供给能量,由于红细胞缺乏线粒体,ATP由无氧酵解产生;一量缺乏ATP供能,则导致细胞膜结构改变,细胞的形态也随之由圆盘状变为棘球状。这种形态改变一般是可逆的。可随着ATP的供能状态的改善而恢复。
成熟红细胞无细胞核,也无细胞器,胞质内充满血红蛋白(hemoglobin,Hb)。血红蛋白是含铁的蛋白质,约占红细胞重量的33%。它具有结合与运输O2和CO2的功能,当血液流经肺时,肺内的O2分压高,CO2分压低,血红蛋白即放出CO2而与O2结合;当血液流经其它器官的组织时,由于该处的CO2分压高而O2分压低,于是红细胞即放出O2并结合CO2。由于血红蛋白具有这种性质,所以红细胞能供给全身组织和细胞所需的O2,带走所产生的部分CO2。
正常成人每微升血液中红细胞数的平均值,男性约400万~500万个,女性约350万~450万个。每100ml血液中血红蛋白含量,男性约12~15g,女性约10.5~13.5g。全身所有红细胞表面积总计,相当于人体表面积的2000倍。红细胞的数目及血红蛋白的含量可有生理性改变,如婴儿高于成人,运动时多于安静状态,高原地区居民大都高于平原地区居民,红细胞的形态和数目的改变、以及血红蛋白的质和量的改变超出正常范围,则表现为病理现象。一般说,红细胞数少于300万/μ1,血红蛋白低于10g/100ml,则为贫血。此时常伴有红细胞的直径及形态的改变,如大红细胞贫血的红细胞平均直径>9μm,小红细胞贫血的红细胞平均直径 3/4
圆粗粒状 偶见 >1/2
圆 粗块状 消失 约1/2
圆 致密块 消失 更小
无
无
很强墨水蓝 开始出现有
减弱 嗜多染性 增多弱
红蓝间染
弱 红大量无
微 红大量无
无 红大量无
2.粒细胞发生粒细胞发生历经原粒细胞(myeloblast)、早幼粒细胞(又称前髓细胞,promyelocyte)、中幼粒细胞(又称髓细胞,myelocyte)、晚幼粒细胞(又称后髓细胞,metamyelocyte)进而分化为成熟的杆状核和分叶核粒细胞。从原粒细胞增殖分化为晚幼粒细胞大约需4~6天。骨髓内的杆核粒细胞和分叶核粒细胞的贮存量很大,在骨髓停留4~5天后释放入血。若骨髓加速释放,外周血中的粒细胞可骤然增多。各阶段细胞的一般形态特点见表5-2(图-11)。
3.单核细胞发生单核细胞的发生经过原单核细胞(monoblast)和幼单核细胞(promonocyte)变为单核细胞(图5-13)。幼单核细胞增殖力很强,约38%的幼单核细胞处于增殖状态,单核细胞在骨髓中的贮存量不及粒细胞多,当机体出现炎症或免疫功能活跃时,幼单核细胞加速分裂增殖,以提供足量的单核细胞。
4.血小板发生原巨核细胞(megakaryoblast)经幼巨核细胞(promegakaryocyte)发育为巨核细胞,巨核细胞的胞质块脱落成为血小板(图5-11)。原巨核细胞分化为幼巨核细胞,体积变大,胞核常呈肾形,胞质内出现细小颗粒。幼巨核细胞的核经数次分裂,但胞体不分裂,形成巨核细胞。巨核细胞呈不规则形,直径40~70μm,甚至更大,细胞核分叶状。胞质内有许多血小板颗粒,还有许多由滑面内质网形成的网状小管,将胞质分隔成许多小区,每个小区即是一个未来的血小板,内含颗粒。并可见到巨核细胞伸出细长的胞质突起沿着血窦壁伸入窦腔内,其胞质未端膨大脱落即成血小板(图5-12)。每个巨核细胞可生成约2000个血小板。
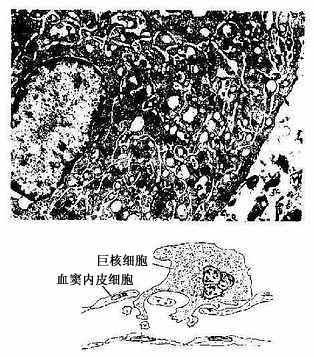
图5-12人巨核细胞电镜像(上图) ×45000
1.细胞核 2.血小板颗粒 3.滑面内质网
(白求恩医科大学尹昕、失秀雄教授供图)
下图示巨噬细胞胞质小块脱落至血窦内
表5-2 粒细胞发生过程的形态演变
| 阶段和名称 | 胞体 大小 形状 (μm) | 胞 核 形状染色质 核仁 核质 比例 | 胞 质 嗜碱性着色 嗜天青 特殊 分裂 颗粒 颗粒 能力 |
| 幼 早幼粒细胞 稚 中幼粒细胞 阶 晚幼粒细胞 段 成 熟 杆状核粒细胞 阶 分叶核粒细胞 段 | 11-18 圆 13-20圆 11-16 圆 10-15 圆 10-15 圆 10-15 圆 | 圆 细网状 2-6 >3/4 卵圆 粗网状 偶见 >1/2 半圆 网块状 消失 约1/2 肾形 网块状 消失 |