第一章 脂质化学及其代谢第一节 脂质种类及化学结构(缺)第二节 脂质代谢一、脂肪酸代谢(一)脂肪酸(fattycaid)的分解代谢-脂肪动员动物将脂肪酸以甘油三酯的形式贮存在脂肪组织内。一旦机体需要时,脂肪酶即可..
第一章 脂质化学及其代谢
第一节 脂质种类及化学结构(缺)
第二节 脂质代谢
一、脂肪酸代谢
(一)脂肪酸(fattycaid)的分解代谢-脂肪动员
动物将脂肪酸以甘油三酯的形式贮存在脂肪组织内。一旦机体需要时,脂肪酶即可逐步水解甘油三酯为游离脂肪酸(freefat acid, FFA)及甘油并释放入血以供其他组织氧化利用,这一过程称为脂肪动员。调节这一过程的关键酶为激素敏感性甘油三酯脂肪酶。当禁食、饥饿或交感神经兴奋时,肾上腺素、去甲肾上腺素、胰高血糖素等分泌增加,作用于脂肪细胞膜表面受体,激活腺苷酸环化酶,促进cAMP合成,激活cAMP-蛋白激酶,使胞液内甘油三酯脂及的调控敏感,故称为激素敏感性脂肪酶。
脂肪分解成游离脂肪酸和甘油后进入血。血浆白蛋白具有结合游离脂肪酸的能力,脂肪酸不溶于水,与白蛋白结合后由血流运送至全身各组织,主要由心、肝、骨骼肌等摄取利用。甘油溶于水,直接由血液运送至肝、肾、肠等组织。在肝甘油激酶(glycerokinase)作用下,转变为α-磷酸甘油,然后脱氢生成磷酸二羟丙酮,循糖代谢径而代谢。
(二)脂肪酸的β-氧化
脂肪酸是人及哺乳动物的主要能源物质。供能方式是通过β-氧化,在O2供给充足的条件下,脂肪酸在体内被分解成CO2和H2O并释放出大量能量以ATP形式供机体利用。除脑组织外,大多数组织均能氧化脂肪酸,但以肝和肌肉最为活跃。脂肪酸氧化的亚细胞器是线粒体,而脂肪酸是不能自由通过其内膜的。因此脂肪酸在进入线粒体之前必然被活化和转载。
1.脂肪酸的活化-脂酰CoA的生成。
在ATP、CoASH、Mg2+存在下,脂酰CoA合成酶(acyl-CoAsynthetase)催化脂肪酸活化,生成脂酰CoA。

2.脂酰CoA进入线粒体
在线粒体内膜两侧有肉毒碱脂酰转移酶(carnitine acyltransferase)Ⅰ和Ⅱ,该酶促进脂酰CoA将脂酰基转移到肉毒碱生成脂酰肉毒碱.后者与载体结合进入线粒体内侧,在内侧由肉毒碱脂酰转移酶Ⅱ催化脂酰肉毒碱转变为脂酰CoA并释放肉毒碱。
3.脂肪酸的β-氧化
在线粒体基质中疏松结合的脂肪酸β-氧化多酶复合体的催化下,从酯酰基的β-碳原子开始进行脱氢,加水,再脱氢及硫解等四步连续反应,脂酰基断裂生成-分子比原来少两个碳原子的脂酰CoA和-分子乙酰CoA。
4.脂肪酸氧化的能量生成
体内能量的重要来源之一是脂肪酸的氧化。以软脂酸为例,进行7次β-氧化,生成7分子FADH2,7分子NADH+H+及8分子酰CoA。每分子FADH2通过呼吸链氧化产生2分子ATP,每分子ANDH+H+氧化产生3分子ATP,每分子乙酰CoA通过三羧酸循环氧化产生12分子ATP。因此一分子软脂肪酸彻底氧化共生成(7×2)+(7×3)+(8×12)=131ATP。减去脂酸活化时耗去的2个高能磷酸键,相当于2个,ATP净生成129分子ATP或129×30.5=3935KJ/mol。软脂酸在体外彻底氧化成CO2及H2O时的自由能为971KJ。故其能量利用率为:
3935/9791×100%=40%
5.脂肪酸的其他氧化方式
除β-氧化之外,机体还存在脂肪酸氧化的其他方式:①不饱和脂肪酸的氧化。不饱和脂肪酸也在线粒体中进行β-氧化,所不同的是饱和脂肪素β-氧化过程中产生的脂肪烯酰CoA是反式△2脂烯酰CoA,而天然不饱和脂肪酸中的双键均为顺式。因此,需经线粒体特异的△3顺→△2反脂烯酰CoA异构酶的催化,将△3顺式转变为β-氧化酶系所需的△2反式构型,然后沿β-氧化途径进行代谢。②过氧化酶体脂肪酸氧化,除线粒体外,过氧化酶体中亦存在脂肪酸β-氧化酶系,它能使极长链脂肪酸氧化成较短链脂肪酸,而对较短链脂肪酸无效;在脂肪酸氧化酶(FAD为辅基)催化下,脱下的氢不与呼吸链偶联产生ATP而是生成H2O2,后者为过氧化氢酶分解;③丙酸的氧化,人体含有极少量奇数碳原子脂肪酸,β-氧化后除生成乙酰CoA外,最终生成丙酰CoA。另外,支链氨基酸氧化亦可产生丙酰CoA。丙酰CoA经β-羧化及异构酶的作用可转变为琥珀酰CoA,然后参加三羧酸循环而被氧化。
6.酮体的生成及利用
酮体是乙酰乙酸(acetoacetate),β-羟丁酸(β-hydroxybatyrate)及丙酮(acetone)三者的统称。酮体是脂肪酸在肝分解氧化时特有的中间代谢物,因为只有肝具有合成酮体的酶系,但缺乏利用酮体的酶系。
酮体的利用,除肝外,肝外心、肾、脑及骨骼肌线粒体是较高活性的利用酶。其一是琥珀酰CoA转硫酶,催化乙酸转变为乙酰乙酰CoA,其二是乙酰乙酰CoA硫解酶催化乙酰乙酰CoA生成乙酰CoA,后者即可进入三羧酸循环而被氧化供能。其三是乙酰乙酸硫激酶,此酶可直接活化乙酰乙酸生成乙酰乙酰CoA,后者在硫解酶的作用下硫解为2分子乙酰CoA。
另外,β-羟基丁酸在β-羟丁酸脱氢酶的催化下,脱氢生成乙酰乙酸,然后循上述途径代谢。而丙酮不能按上述方式活化,除随尿排出外,在血中酮体剧烈升高时,可从肺直接呼出,总之,肝是生成酮体的器官,但不能利用酮体,而肝外组织不能生成酮体,却可利用酮体。
(三)脂肪酸的合成代谢
长链脂肪酸以乙酰CoA为原料在胞液内由不同于β-氧化的脂肪酸合成酶及多功能酶等催化而完成。
1.脂肪酸合成酶系及反应过程
在乙酸CoA羟化酶的作用下,乙酰CoA羧化成丙二酸单酰CoA。
ATP+HCO3-+乙酰CoA→丙二酰CoA+ADP+Pi
在多酶体系或多功能酶的作用下,乙酰CoA与丙乙酰开始重复加成过程,每次延长二个碳原子。十六碳软酯酸的生成,需经过连续的七步重复加成。
脂肪酸生物合成,从乙酰CoA合成丁酰-S-ACP为第一轮反应,七步反应分别有七种酶催化。①乙酰CoA羧化酶;②乙酰基-ACP转移酶;③丙二酸单酰基-ACP转移酶;④3-酮酰基-合成酶;⑤3-酮酰基-ACP还原酶;⑥3-羧酰基-ACP脱水酶;⑦3-烯酰基-ACP还原酶。七种酶催化完成七步反应最后生成丁酰-SACP。需指出的是在大肠杆菌中七种酶蛋白聚合在一起构成多酶体系,而高等动物,这七种酶活性都在一条多肽链上,属多功能酶。
脂肪酸生物合成的碳链延伸循环过程是每轮新生成的酰基-SACP再与丙二酸单酰-SACP缩合,经还原、脱水和还原诸反应延伸两个碳原子,这样每轮循环,加上两个碳原子。所以软脂酸经七次循环即生成。
2,不饱和脂肪酸的合成
人体所含的不饱和脂肪酸主要有软油酸、油酸、亚油酸、亚麻酸及花生四烯酸等。前两种可由人体自身合成,而后三种则必须从食物摄取,因为人体缺乏相应的去饱和酶。
去饱和酶位于动物体内组织内质网上,其催化脱氢过程已基本明了。此氧化脱氢过程有线粒体外电子传递系统参与。该系统在有机毒物氧化或苯环上加氧等机体解毒过程中,也有重要作用。例如去饱和酶能使硬脂酸(18:0)脱去2H成油酸(18:1,△9)。
3.脂肪酸合成的调节
脂肪酸合成主要受二方面的调节:一是代谢物的调节作用。进食高脂肪食物以后或饥饿会使脂肪动员加强,肝细胞内脂酰CoA增多,可别构抑制乙酰CoA羧化酶,从而抑制体内脂肪酸的合成;进食糖类使糖代谢加强。NADPH及乙酰CoA供应增多,有利于脂肪酸的合成,同时糖代谢加强使细胞内ATP增多,可抑制异柠檬酸脱氢酶,造成异柠檬酸及柠檬酸堆积,透出线粒体,可别构激活乙酰CoA羧化酶,使脂肪酸合成增加,此外,大量进食糖类也能增加各种合成脂肪有关的酶活性从而使脂肪合成增强;二是激素的调节作用。胰岛素是调节脂肪合成的主要激素,它能诱导乙酶羟化酶,脂肪酸合成酶乃至ATP-柠檬酸裂解酶等的合成,从而促进脂肪酸合成。胰岛素还能促进脂肪酸合成磷脂酸。胰高血糖素,肾上腺素、生长素则与胰岛素作用相反,通过抑制乙酰CoA羧化酶的活性,从而阻止脂肪酸的合成。
二、多不饱和脂肪酸的重要衍生物-前列腺素、血栓烷及白三烯
前列腺素(prostglandins,PG)最早发现于精液,现知前列激腺素来源广泛,种类繁多,但均为二十碳多不饱和脂肪酸的衍生物。血栓烷(thromboxane,TX)来自白细胞,是由二十碳多不饱和脂肪酸的衍生物,来自血小板。白三烯(leukotrienes,LT)来自白细胞,是由二十碳多不饱和和脂肪酸衍生而来。PG、TXA2及LT3几乎参予了所有细胞代谢活动,并且与炎症、免疫、过敏、心血管病等重要病理过程有关,在调节细胞代谢上亦具有重要作用。
(一)前列腺素(PG)、血栓烷(TX)及白三烯(LT)的合成
1.PG及TX的合成。
以花生四烯酸为原料,机体除红细胞外,其他各组织均有合成PG的酶系。血小板内还有血栓烷合成酶。当细胞受外界剌激如血管紧张素Ⅱ(agniotensionⅡ)、缓激肽(bradydinin)、肾上腺素、凝血酶及某些抗原抗体复合物或一些病理因子(许多激活因素尚未清楚),细胞膜中磷脂酶被激活,使磷脂水解释出花生四烯酸,在一系列的作用下,逐步合成PG和TX,其合成过程如图1-1所示。
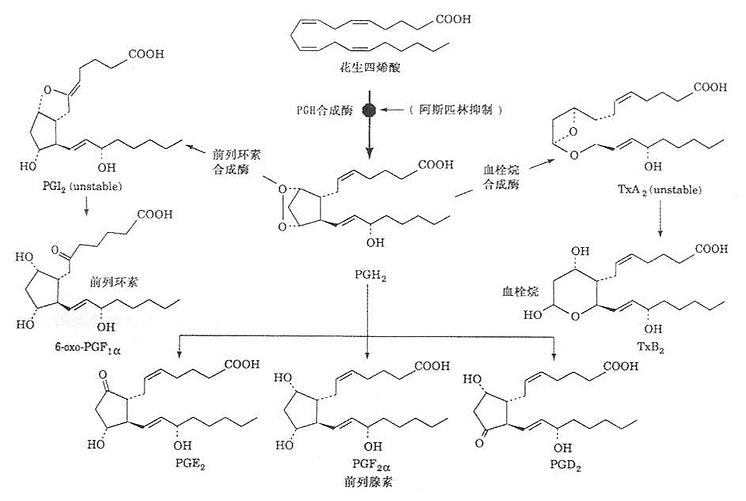
图1-1 PG和TX合成示意图
2.白三烯的合成
白三烯合成同样以花生四烯酸为原料,在脂氧合酶(lipoxygenase)作用下,生成氢过氧化二十四烯酸(5-HPETE),后者在脱水酶作用下生成白三烯(LTA4)。LTA4在酶促作用下转变成具有重要生物活性的化合物,如LTB4、LTC4、LTD4、及LTE4等。如图1-2所示。
(二)血栓烷(TX),内过氧化物与环前列腺素(PGI2)
这两种物质是与前列腺素有密切联系的化合物。血栓烷A2(TXA2)由血小板内血栓烷合成酶催化合成。由于是首先在血小板内分离出而且分子内含有一个血栓烷,故名。血栓烷B2(TXB2)和6-酮基前列腺素F1a是TXA2和PGI2的降解产物,无生物活性。环前列腺素(PGI2)含有二个五碳环。故名,它是在人类动脉及静脉最里面的内衬处合成(包括冠状动脉内衬),由环前列腺素合成酶催化。
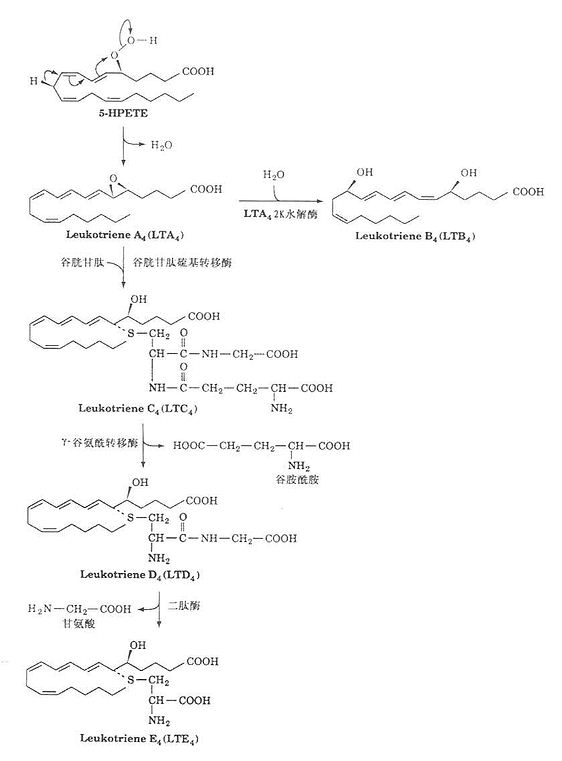
图1-2 白三烯合成示意图
三、胆固醇代谢
(一)胆固醇(clolesterol)的消化吸收
胆固醇主要由机体自身合成,但亦从食物中少量摄取。胆固醇主要来自动物内脏、蛋黄、奶油、肉等动物性食品,植物性食品不含胆固醇,但含植物固醇,过多摄入植物固醇可抑制胆固醇的吸收。食物中胆固醇以游离胆固醇和胆固醇酯两种形式存在,其中游离胆固醇占总量的85%~90%。胆固醇酯经胆汁酸盐乳化后,在小肠中为胰胆固醇酯酶水解生成游离胆固醇。游离胆固醇与胆汁酸盐,磷脂及脂肪的水解产物甘油一酯、脂酸等结合成混合微团,为小肠粘膜吸收。吸收的游离胆固醇80%~90%在肠粘膜细胞内,又与长链脂酸(主要是油酸)结合成胆固醇酯,后者大部分参入乳糜微粒(chylomicrons,CM),少量参与组成极低密度脂蛋白(verylowdensitylipoprotein, VLDL)经淋巴进入血循环。未被吸收的胆固醇在小肠下段及结肠被细菌还原转化为类固醇随粪便排出。
胆固醇的消化吸收可以由以下因素影响:①胆汁酸盐,它促进脂类包括胆固醇及固醇酯的乳化,既有利于胰脂酶及胆固醇酯酶及胆固醇酯酶的作用,又有利于胆固醇的吸收;②食物脂肪,脂肪能促进胆汁分泌,其分解产物又是混合微团的重要成份,它还促进肠粘膜细胞合成乳糜微粒,故食物脂肪有利于胆固醇的吸收;③植物固醇,由于其结构与胆固醇相似,但不易吸收,摄入过多可抑制胆固醇的吸收;④纤维素、果酸可与胆汁酯盐结合而促进其粪便排出,间接减少胆固醇的吸收;⑤某些药物如消胆胺,系阴离子交换树脂,它可与胆汁酸盐结合,加速胆汁酸盐的排泄,间接减少胆固醇的吸收。
(二)胆固醇的合成
1.合成部位
胆固醇合成部位除成年动物脑组织及成熟红细胞外,几乎在全身各组织内都可合成。但肝是主要合成场所,占合成总量的70%~80%。胆固醇合成酶系存在于胞液及光面内质网膜上,因此胆固醇的合成主要在胞液及内质网中进行。
2.合成过程
胆固醇合成部位以乙酰CoA为原料,而乙酰CoA主要产生于线粒体内,它不能自由通过线粒体内膜,需在线粒体内先与草酰乙酸缩合成柠檬酸,后者再通过线粒体内膜的载体进入胞液,然后在柠檬酸裂解酶的作用下,裂解生成乙酰CoA。这一过程是耗能的,每转支1分子乙酰CoA,要耗去1分子ATP。由乙酰CoA合成胆固醇需要大量的NADPH+H+及ATP供给合成反应所需的氢和能量。每合成1分子胆固醇需18分子乙酰CoA,36分子ATP及16分子NADPH+H+。乙酰CoA及ATP大多来自线粒体中糖的有氧氢化,而NADPH则主要来自胞液中糖的磷酸戊糖代谢途径。胆固醇合成步骤十分复杂,有近30步酶促反应大致可划分为三个阶段:
(1)甲羟戊酸的合成。在乙酰乙酰硫解酶的催化下,二分子乙酰CoA缩合成乙酰乙酰CoA;然后在羟甲基戊二酸单酰CoA合成酶(3-hydroxy-3-methylglutarylCoASynthase,HMG CoA Synthase)的催化下再与一分子乙酰CoA缩合生成痉甲基戊二酸单酰CoA(3-hydroxy-3methylglutarylCoA,HMGCoA)。HMGCoA是合成胆固醇及酮体的重要中间产物。在线粒体中,三分子乙酰CoA缩合成的HMGCoA裂解后生成酮体;而在胞液中生成的HMGCoA则在内质网HMGCoA还原酶(HMGCoA reductase )的催化下,由NADPH+H+供氢,还原生成甲痉戊酸(mevalonicacid,MVA)。HMG CoA还原酶是合成胆固醇的限速酶,该步也是胆固醇合成的限速反应。
(2)鲨烯的合成。MVA(C6)由ATP提供能量,在胞液内一系列酶的催化下,脱羧、磷酸化生成活泼的异戊烯焦磷酸(△3-isopenterylpyrophosphate, IPP)和二甲基丙烯焦磷酸(3,3-dimetytlallypyrophosphate ,DPP)然后三分子活泼的5C焦磷酸化合物(IPP及DPP)缩合成15C的焦磷酸法呢酯(farnesylpyrophosfhate, EPP)。二分子15C焦磷酸法呢酯在内质网鲨烯合酶(squalenesynthase)的作用下,再缩合,还原即生成30C的多烯烃-鲨烯(squalene)。
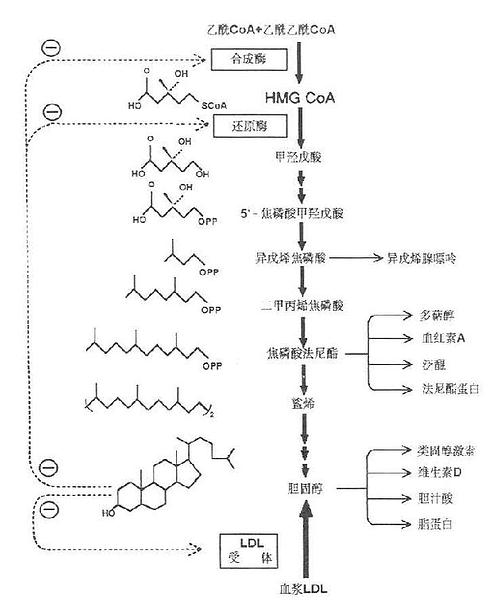
图1-3 胆固醇合成代谢图
(3)胆固醇的合成。鲨烯为含30个碳原子的多烯烃,具有与固醇母相近似的结构。鲨烯结合在胞液中固醇载体蛋白(sterolcarrierprotein,SCP)上以内质网单加氧酶和环化酶等的作用,环化生成羊毛固醇,后者再烃经氧化,脱羧,还原等反应,脱云个甲基(次CO2形式后成27℃的胆固醇,如图1-3所示。
3.合成调节
对胆固醇合成的调节主要是通过对HMGCoA还原酶活性的影响来实现的。
(1)饥饿与饱食。饥饿与禁食可抑制肝合成胆固醇。禁食使HMGCoA还原酶合成减少活性降低外,乙酰CoA,ATP,NADPH+H+的不足也是胆固醇合成减少的重要原因。相反摄取高糖、高饱和脂肪膳食后,肝HMGCoA还原酶活性增加,胆固醇的合成增加。
(2)胆固醇。它可反馈抑制肝胆固醇合成,主要是HMGCoA还原酶的合成。如图1-3所示。
(3)激素。胰岛素及甲状腺素能诱导肝HMGCoA还原酶的合成,从而加速胆固醇的合成。胰高血糖素及皮质醇则能抑制则能抑制并降低HMGCoA还原酶的活性,因而减少胆固醇的合成。甲状腺素除能促进HMGCoA还原酶的合成外,同时又促进胆固醇在肝转变为胆汁酸,且后一作用较前者强,结果使血清胆固醇含量反而下降。
另外,胆固醇合成有明显的昼夜节律性。午夜时合成最高,而中午合成最低,主要是肝HMGCoA还原酶活性有昼夜节律性所致。
(三)胆固醇的转化
1.在肝内转化成肝汁酸
正常人每天约合成1.0-1.5g胆固醇,其中约2/5(0.4-0.6g)在肝内转变成胆汁酸,随胆汁排入肠道。胆固醇在肝实质细胞的内质网7α羟化酶作用下,由NADPH+H+供氢,O2参加,7α-羟化生成7α-羟胆固醇。7α-羟化酶属单加氧酶系,是胆汁酸合成的限速酶。7α-羟胆固醇在内质网3α-及12α-羟化酶的作用下,亦需NADPH+H+及O2参加,3α-及12α-羟化,然后17β侧链经β-氧化脱去丙酰CoA即形成24C的胆酸。仅3α和7α-羟则生成鹅脱氧胆酸。二者再在肝细胞酶的催化下,分别与甘氨酸及牛磺酸结合即形成结合型的甘氨胆酸,牛磺胆酸,甘氨鹅脱氧胆酸及牛磺鹅脱氧胆酸。结合型的胆汁酸分泌入毛细胆管经胆管随胆汁排入胆囊储存或排入肠道。胆汁酸可反馈抑制7α-羟化酶从而抑制胆汁酸的合成。结合型的初级胆汁酸随胆汁分泌入肠道后,在小肠下段及大肠中受细菌的作用,发生水解,生成游离型的胆汁酸随胆汁分泌入肠道细菌作用下,使7α羟基脱氧,胆酸转变为7-脱氧胆酸(7-deoxycholic acid)鹅脱氧胆酸转变为石胆酸( lithocholic acid)。在肠道细菌作用后生成的7-脱氧胆酸及石胆酸即次级胆汁酸。
胆汁酸排入肠腔后,大部分未经细菌作用的结合型胆汁酸(甘氨胆酸及牛磺胆酸)在小肠,主要是回肠,通过主动吸收经门静脉回到肝,经肠道细胞作用后的游离型次级胆汁酸在大肠通过被动扩散进入门静脉。然后进入肝。肝细胞将从肠道来的游离型次级胆汁酸转变为结合型初级胆汁酸,与新合成的结合型胆汁酸一起,再分泌入毛细血管,经胆道又排入肠腔,这一过程称为肠肝循环。每次由肝排入肠腔的胆汁酸95%以上均被重吸收再利用,仅小部分随粪便排出。
胆汁酸生理作用是促进脂类的消化吸收。由于胆汁酸分子具有亲水和疏水的两个侧面,是一种很好的乳化剂,能使疏水的酯类在水中乳化成细小的微团,既有利于消化酶的作用,又促进其吸收。另外,还可阻止胆固醇在胆汁中形成结石(沉淀)。胆固醇难溶于水,胆汁在胆囊中浓缩后胆固醇较易析出沉淀。而胆汁酸盐卵磷酯,可使胆固醇分散形成成可溶性微团,使之不易形成结晶。若胆汁中胆固醇浓度过高或胆汁中酸盐及卵类脂与胆固醇的比值降低(小于10:1),则胆固醇析出沉淀,引起结石。
2.胆固醇在肝外组织的转化
胆固醇是肾上腺皮质、睾丸、卵巢等内分泌腺合成类固醇激素的原料。合成类固醇激素是胆固醇在体内代谢的重要途径。
(1)肾上腺皮质激素的合成。肾上腺皮质的球状带、束状带及网状带分别能够合成醛固酮、皮质醇(酮)、性激素。胆固醇是合成这些激素的原料。胆固醇在皮质细胞线粒体内膜的20α-羟化酶,22β-羟化酶及20,22碳链裂解酶的作用下,断裂侧链、释出一分子异已醛(6C),生成21碳的孕烯醇酮,羟化反应需NADPH+H+及O2参加。然后孕烯醇酮输出线粒体,在内质网异构酶的催化下,脱氢异构化生成21的碳的孕酮。孕酮是合成皮质激素的重要中间物,本身也具有激素活性,孕酮在17α、21β、11β及18羟化后,即可合成不同的皮质激素。
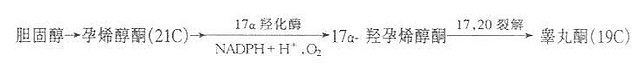
(2)睾丸酮的合成。睾丸间质细胞可直接以血胆固醇为原料合成睾丸酮。在17α-羟化酶及17,20碳裂解酸的作用下,胆固醇转化睾丸酮。
(3)雌性激素的合成。睾丸酮是卵巢合成雌二醇的直接前体。卵巢独有19-羟化酶,19-氧化酶及10,19碳裂解酶,在NADPH+H+及O2的参加下,睾丸酮的19位甲基氧化,三环芳香化转变为苯环,形成雌二醇。雌二醇的生理活性最大,雌酮(estrone)及雌三醇(estriol)为其代谢产物。
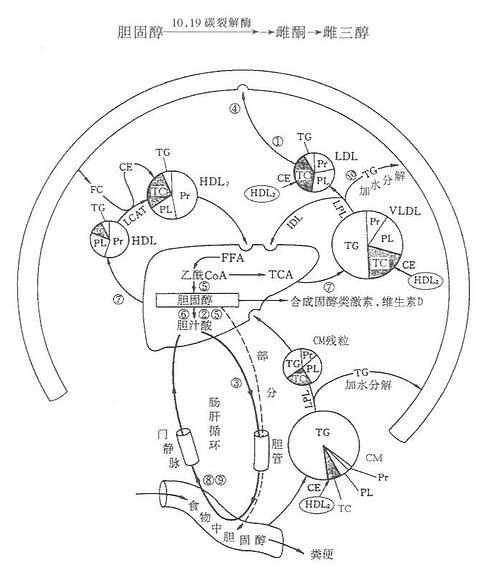
图1-4 胆固醇的主要代谢途径
胆固醇代谢与其他脂质代谢密切相关,是脂蛋白代谢的一个组成部分。血清胆固醇水平高低反映了机体某些脏器的代谢障碍,如血清胆固醇升高的有关疾病有:①糖尿病(LDL)代谢异常等;②甲状腺机能降低(胆固醇转换成胆汁酸盐减少);③胆汁淤滞症(排泄减少);④家族性高胆固醇血症(LDL受体缺乏);⑤肾病综合征(胆固醇合成亢进)。
血清胆固醇降低的有关疾病有:①甲状腺机能亢进症(转变成胆汁酸盐亢进);②重病肝病(肝产生VLDL和HDL减少);③吸收不良综合征;④营养失调;⑤无或低β脂蛋白血症(LDL减少)。如图1-4所示。
四、脂肪、磷脂、糖脂代谢
(一)脂肪代谢
脂肪的消化和吸收。膳食中的脂质主要为脂肪,此外还含少量磷脂,胆固醇等。在小肠经胆汁酸盐有作用,乳化并分散成细小的微团后,再被消化酶消化。小肠含有胰腺分泌的胰脂酶(pancreaticlipase,PL),磷脂酶A2(phospholipaseA,PLA2),胆固醇酯酶(cholesterylesterase)及辅脂酶(colipase)。胰脂酶特异催化甘油三酯的1及3位酯键水解,生成2-甘油一酯(2-monoglyceride,MG)及二分子脂肪酸。胰脂酶必须吸附在乳化脂肪微团水油界面上,才能作用于微团内的甘油三酯。辅脂酶能于胆汁酸盐及胰脂酶结合并促进胰脂酶吸附在微团的水油界面上,因而能增加胰脂酶的活性,促进脂肪的水解。磷脂酶A2催化磷脂2位酯键水解,生成脂肪酸及溶血磷脂。胆固醇酯酶促进胆固醇酯水解成游离胆固醇及脂肪酸。
脂类消化产物主要在十二指肠下段空肠上段吸收。中链脂肪酸(6-10C)及短链脂肪酸(2C-4C)构成甘油三酯,经胆汁酸盐乳化后即可被吸收,在肠粘膜细胞内脂肪酶的作用下,水解为脂肪酸及甘油,通过门静脉进入血循环。长链脂肪酸(12-26C)及2-甘油一酯吸收入肠粘膜后,在光面内质网转酰酶(acylstransferase)的催化下,由ATP供给能量,2-甘油一酯加上2分子脂酰CoA,再合成甘油三酯。后者参入乳糜微粒的组成,经淋巴进入血循环。
(二)脂肪的合成
脂肪(酰基甘油三酯)是机体储存能量的形式。肝、脂肪组织及小肠是合成甘油三酯的主要场所,以肝的合成能力最强。
甘油三酯合成原料是由葡萄糖代谢提供的甘油及脂肪酸。甘油三酯合成的两条途径,一是小肠粘膜细胞内由消化吸收的甘油一酯及脂肪酸在转酰酶的催化下合成甘油三酯。二是在肝细胞及脂肪细胞进行的合成途径-甘油二酯途径。3-磷酸甘油在转酰酶的作用下,加上2分子脂酰CoA生成磷脂酸(phosphatidicacid)。后者在磷脂酸磷酸酶的作用下,水解脱去磷酸生成1,2-甘油二酯,然后在转酰酶的催化下,再加上1分子脂酰基即生成甘油三酯。
合成脂肪的三分子酸可为同一种脂肪酸,也可是三种不同的脂肪酸。合成所需的3-磷酸甘油主要由糖代谢提供。肝、肾等组织含有甘油激酶,能利用游离甘油,使之磷酸化生成3-磷酸甘油。脂肪细胞缺乏甘油激酶因而不能利用甘油合成脂肪。
(三)磷脂的代谢
1.甘油磷脂的合成和降解
甘油磷脂可在全身各组织细胞内质网合成,内质网含有合成磷脂的酶系。但以肝、肾及肠等组织最活跃,其合成原料是脂肪酸,甘油主要由葡萄糖代谢转化而来,但多不饱和脂肪酸必须从植物油摄取,其他原料如磷酸盐、胆碱(choline)、丝氨酸、肌醇(inositol)等可来自食物和体内合成。其合成过程有两种,一是甘油二酯合成途径。磷脂酰胆碱及磷脂酰及乙醇胺主要通过此途径合成;二是CDP-甘油二酯合成途径。肌醇磷脂(phosphatidylinositol)、丝氨酸磷脂(phosphatidyline serine)及心磷脂(cardiolipin)由此途径合成,具体过程如下。
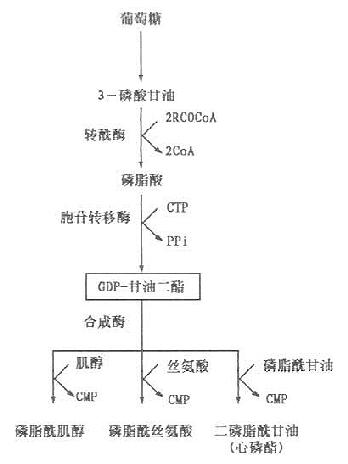
以上是磷脂合成的基本过程。此外磷脂酰胆碱亦可由磷脂酰乙醇胺从S-腺苷蛋氨酸获得甲基生成。磷脂酰丝氨酸可由磷脂酰乙醇胺羟化或其乙醇胺与丝氨酸交换生成。甘油磷脂的合成是在内质网膜外侧面进行,而在胞液中存在一类能促进磷脂在细胞内膜之间进行交换的蛋白质-磷脂交换蛋白(phospholipidexchange proteins)。不同的磷脂交换蛋白催化不同种类磷脂在膜之间进行交换。合成的磷脂通过这类蛋白的作用转移至不同的细胞器膜上,从而更新其磷脂。
甘油磷脂的降解是由多种磷脂酶类(phospholipase)分别作用于甘油磷脂分子中的不同酯键。作用于1,2位酯键的酶分别称为磷脂酶A1和A2,作用于溶血磷脂1位酯键的酶称为磷脂酶B1,作用于3位磷酸酯键的酶称为磷脂酶C,作用磷酸取代基间酯键的酶称为磷脂酶D。通过以上多种酶的作用甘油磷脂最终分解为甘油、脂肪酸、无机磷酸。
2.鞘磷脂的代谢
全身各组织均可合成鞘磷脂,但以脑组织最为活跃。内质网有合成鞘氨醇酶系,鞘胺醇是各种鞘磷脂的前体物质,其合成过程为:
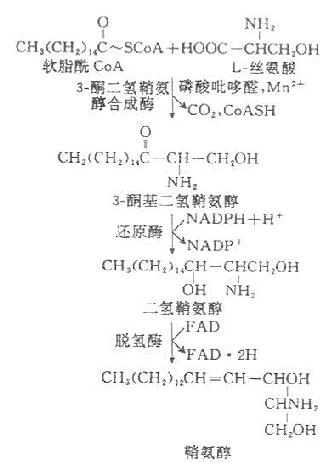
神经鞘磷脂以鞘氨醇为前体,在脂酰转移酶的催化下,其氨基与脂酰CoA进行酰胺缩合,生成N-脂酰鞘氨醇后,者由CDP-胆碱供给磷酸胆碱即生成神经鞘磷脂。
鞘磷脂的降解过程类似于磷脂的降解,在多种磷脂酶的作用下,可逐步水解。神经鞘磷脂酶存在于脑、肝、脾、肾等细胞的溶酶体中,属于磷脂酶C类,能够使磷酸酯键水解,产生磷酸胆碱及N-脂酰鞘氨醇。
(四)糖酯的代谢
1.糖基甘油酯的生物合成
糖基甘油酯分子是由糖类、甘油和脂肪酸组成的。其组成与磷脂的区别只是磷是基团被糖基所取代,因此合成过程与磷脂有许多相似之处。动物体内合成糖酯最活跃的器官是脑,亚细胞部位是微粒体。微粒体含有催化生成二半乳糖基甘油二酯的酶系。
2.糖基甘油酯的降解
脑组织含有脂肪酶和半乳糖苷酶催化半乳糖基甘油酯的水解反应。脑微粒体的半乳糖脂酶水解半乳糖基甘油二酯。动物体只有神经组织含有糖基甘油酯,其浓度在髓鞘形成期开始升高,因为它的合成速度最快,而水解酶活力又相应降低。由此表明糖脂参与了髓鞘形成的过程。糖脂降解产物是脂肪酸、半乳糖、甘油。
3.糖鞘脂代谢
哺乳动物的糖脂在肝脏和脾脏周转很快,但红细胞发育期动物的脑组织与内膜结合的糖脂半寿期却比较长。中性糖鞘脂的生物合成是通过在神经酰胺分子上顺序添加单糖而合成寡糖链,催化这一反应的酶总称为糖基转移酶,糖基供体是糖核苷酸衍生物(UDP-半乳糖,UD-P葡萄糖等,单糖从它的核苷酸衍生物转移给适宜的受体(底物)合成各种中性糖鞘脂。其中已糖苷神经酰胺的合成途径有两条。其一,是从鞘氨醇和UDP-半乳糖合成鞘氨醇半乳糖苷,由UDP-半乳糖:鞘氨醇β-半乳糖基转移酶催化,再经一个酰基转移酶合成1-0-半乳糖苷神经酰胺。但是已糖苷神经酰胺还是主要通过第二条途径合成的,即鞘氨醇首先酰化产生神经酰胺,后者再经UDP-半乳糖:N酰基鞘氨醇半乳糖转移酶催化合成1-0-半乳糖神经酰胺。
中性糖鞘脂的合成则是在多种糖基转移酶的催化下逐步合成的。如半乳糖基转移酶有催化生成α(1→4)糖苷键的酶,也有催化产生β(1→4)或β(1→3)糖苷键的酶;此外还有葡萄糖基转移酶、岩藻糖基转移酶、N-乙酰氨基葡萄糖基转移酶β(1→3)和不止一种N-乙酰氨基半乳糖转移酶催化产生β(1→3)糖苷键和催化产生а(1→3)糖苷键。
葡萄糖苷酶、N-乙酰、β-氨基乙糖苷酶、α-岩藻糖苷酶、芳香基硫酸酯酶和神经酰胺酶。由于糖鞘脂的分子结构复杂,因此每一类酶呈现多样的底物专一性。糖硝酯被以上诸酶水解生成鞘氨醇、脂肪和酸糖基。
第三节 脂质的生理功能
如前所述脂质化学结构各异,因而具有多种生物功能,如贮存能量、组成生物膜;组成细胞表面的特殊物质如受体、识别因子等。
一、贮存能量
机体在正常生理条件下,由葡萄糖提供能量,葡萄糖增多首先可转变为糖原储存,继而转变为脂肪(甘油三酯)存入脂肪组织;另外,身体的生长、组织的修复和酶类的合成,要维持充足的蛋白质供应,多余的蛋白质也转变成脂肪贮存起来,当机体需要能量时首先动用糖原,其次才动用脂肪。
二、构成生物膜
生物膜结构不仅是细胞结构的组织形式,也是生命活动的主要结构基础。许多生命过程,如能量转换、物质运输、信息识别与传递、细胞发育和分化,以及神经传导,激素作用等都与生物膜有密切关系。生物膜(包括细胞表面膜即质膜和各种细胞器膜)是由脂质双分子层与镶嵌或附着在此双分子层内的蛋白质所组成的。生物膜结构的“流动镶嵌模型”说明脂质双分子层是生物膜的基本结构,磷脂组成了不连续的流动双分子层(此外尚有胆固醇和糖脂等),它作为内嵌膜蛋白的基质。也给各种不同大小的分子提供进出膜的通透性屏障。少部分磷脂含有特异性的脂肪酸链或特殊的极性头,能专一地与某些膜蛋白相互作用,从而执行特定的生物功能。生物膜的结构是相对稳定而又具流动性,其流动性取决于膜脂的脂肪酸组成和胆固醇含量,亦受温度的影响。在生理条件下生物膜的脂质和蛋白质分子能自由地在膜上进行侧向扩散,但从膜双分子层的一侧向另一侧翻转运动则比较困难。
生物膜的双分子层两侧表面呈现不对称分布。膜蛋白和膜糖在膜结构内不对称现象是绝对的,而膜脂的不对称现象不是绝对的,几乎各种类型的脂质都存于膜双分子层的两侧,但其含量与分布各异。脂质分子层作为膜的基本结构,含有品种繁多,化学性质各异的磷脂和少量糖脂。膜脂有共同的结构特点:它们都是两性分子,具有亲水的极性头和疏水的疏水尾。这种独特的结构特点使它在水溶液中,能自发地形成胶束或片状双层结构。由两排脂质分子构成的片状双层结构就是脂质双分子层。在脂质分子层内所有分子的极性头,都面向膜的两侧水溶相。在生物膜内磷脂以不对称的方式构成双分子层,这就是膜磷脂的拓扑结构不对称现象。膜磷脂通过各种膜结构之间相似磷脂分子重新分布进行周转与更新,从而维持磷脂在膜结构中不对称分布,这种磷脂在膜结构间的周转重排过程为磷脂交换,这是完整的磷脂分子交换过程。这种交换生物体内是相当普通的。磷脂分子通过交换,侧向扩散等维持自身的更新,修复或取代那些死去的细胞膜结构,保障细胞膜的通透性,控制着体内代谢产物的流失和外源有毒物的潜入,发挥着重要作用。
三、脂质的转化作用
通过转化生成相应的具有生物活性的物质,如胆固醇转化为相应的激素,后者在机体生长、发育、代谢发挥着不可取代的作用。由脂肪酸转化的前列腺素,而前列腺素近年来倍受重视,它对心血管系统的作用表现为增加心肌收缩性,降低动脉血压,同时伴随着血管扩张和增加血管通透性,前列腺素对大脑皮层有镇定和安定效应。前列腺素还能使支气管哮喘缓解而被用于治疗哮喘。另外,鞘磷脂、糖鞘酯是神经组织特有的物质,其作用不可忽视。还有一些维生素,如类萜维生素、维生素A、维生素E、维生素K是生命必需的物质。并且随着脂质研究的继续,一些重要作用将会被发现。总之,脂质对于生命的作用是巨大的。
(黄俊军)
(脂质化学及其代谢)参考文献
1.Drayr JP,Vamecq J.The gluconeogenicity offatty acids in mammals .Trends Biochem Sci,1989,14:478~479
2.GurrMI,Harwood J.Lipid biochemistry.an introduction,chapman and hall,London,1991
3.SaltinB,Astrand PO.Free fatty acids and exercise Am Jclin Nutr,1983,57(sappl):7525~7585
4.DawsonRMC,Rhodes DN.Metabolism and physiological significance of lipids.John Wiley1-5;分别为ε4/4、ε4/2、ε4/3和3/3;基因型6:PCR产物(292bp)
四、ApoE多态性与疾病
人群中ApoE多态性存在种族变异,不同人群中ApoE基因型高度不同。欧洲人ε4等位基因频率从北到南呈下降趋势的分布。亚洲人ε4频率低,相比之下,非洲人及巴布比亚和新几内亚ε4频率高。
由于早期观察到ApoE2/2表型的Ⅲ型高脂蛋白血症病人未在成年即患冠心病,从此,对ApoE多态性进行了广泛研究,许多证据认为,ApoE多态性是动脉粥样硬化早期及发展过程中个体差异的主要原因。大量人群调查发现ε4等位基因的一般作用是可以显着地升高健康人的总胆固醇浓度,使之易患动脉粥样硬化,相反,ε2等位基因的一般作用是降低胆固醇浓度,其降低效应是ε4升高胆固醇的2~3倍。ApoE等位基因变异还与血浆ApoB浓度、甘油三酯及血管收缩压有关。Menzel等认为ε2等位基因对冠状动脉硬化的发展有防护作用,经临床研究发现,患心血管疾病如心肌梗塞幸存者,或血管造影证明有动脉粥样硬化者,比其对照组的ε4等位基因频率高。ApoE4/3杂合子比E3/2和E3/3基因型者发生心肌梗塞年龄早。ApoE多态性变异还与肾病综合症、糖尿病有关。
值得重视的是ApoE多态性与老年性痴呆病(AD)的关系。1993年,Rose研究发现,晚发性家族型AD病人ε4频率增多,还发现ApoE和来源于淀粉样前体蛋白的小多肽Aβ的亲和力很高。其后陆续发现AD病人中携带ε4等位基因者占46.2%,而对照组占13.2%。还发现携带二个ε4等位基因的研究对象比携带一个ε4的研究对象发生AD年龄早,比不携带ε4等位基因的研究对象发生AD年龄更早,1994年,Schacher等人相继报道百岁老人普遍携带ε2基因。。这一发现使ApoE多态性和研究向前迈出了一大步。有报道高老年人携带ε2等位基因数量是年青人的2倍。因此ε2等位基因似乎不仅可以保护人们免患AD,而且还与长寿有关。ApoE多态性与AD的关系,目前的研究主要集中在脑代谢中与Aβ或Tau蛋白以及神经元生长和分枝等有关。
总之,在研究高脂血症评定心脑血管疾病的危险因素方面,以ApoE多态性为手段进行研究有重要的临床意义。有学者认为,基因型的“坏”(ε4)和“好”(ε2)的等位基因之间的平衡,可作为基因分析应用于医学检验领域,协助临床疾病的诊断。
第五节 载脂蛋白(a)
脂蛋白(a)[LP(a)]是1963年Berg研究β-脂蛋白的变异型时发现的,当时测定脂蛋白(a)在人群分布率为30%。目前采用更灵敏的方法发现几乎存在于所有人群中,仅是血浆浓度差异很大,波动在0~1000mg/L的范围。Eaton和Melean等于1987年克隆了人Apo(a)的基因序列,并推导出氨基酸序列。结果提示了Apo(a)的分子结构与纤溶酶原极为相似。Apo(a)含有一个疏水信号序列,其后为37个Kingle-4拷贝、1个Kingle-5及1个胰蛋白酶样区。第36个Kingle-4含有一个额外未配对半胱氨酸,推测此处可能是Apo(a)以二硫键与ApoB结合的部位。经胰蛋白酶限制性水解Apo(a)发现,Apo(a)中的Kingle-4有75%~85%的氨基酸与颖溶酶原的第391~472个氨基酸相同,有共同的抗原簇,表现出两者有交叉反应。纤溶酶原(PG)是一种丝氨酸蛋白酶原,含有791个氨基酸残基。结构中含有5个富含半胱氨酸的“Kingle”样结构,即Kingle-5,在Kingle-5的后面为一丝氨酸蛋白酶区。PG与Apo(a)结构相似。
Kingle结构是三个二硫键组成的三套环形结构,含有78~82个氨基酸残基,在其第1与第6,第2与第4,第3与第5半胱氨酸上,连成三个二硫键。这种结构也出现在前凝血酶,尿激酶,链激酶和纤溶酶原激活剂(t-PA)的组份中。由于Apo(a)分子中的Kingle-4数目可在15-37之间变化,从而造成Apo(a)有多种不同的异构体。
Apo(a)结构中有一蛋白酶区,推测其功能可能是一种酶。另外在分子中相当于PG蛋白酶的丝氨酸被精氨酸代替,即可使其丧失酶的功能。由于Kingle结构与PG相似,推测Apo(a)可能结合到像PG受体或纤维蛋白那样的大分子上,再加上LP(a)颗粒携带的胆固醇结合到血管损伤部位,因此它不仅促进动脉粥样硬化形成,也阻碍血管内凝血块的溶解。
第六节 载脂蛋白D
ApoD是HDL中仅次于ApoAⅠ、AⅡ的一种载脂蛋白,在HDL2中约占21%,HDL3中占43%,VLDL中含有36%,ApoD化学本质是糖蛋白,其糖的组份中含有葡萄糖,甘露糖、半乳糖、葡萄胺和唾液酸。ApoD又称为薄线肽(thinline peptide),其分子量为22100,为一条多肽链,C-末端为天冬氨酸、苏氨酸、丙氨酸和丝氨酸,N-末端是封闭的,正常人血清含量为100~120mg/L。ApoD的生理功能尚不清楚,流行病学调查表明,ApoD与胆固醇酯尤其是HDL胆固醇之间存在着相关性,推测其可能是一种胆固醇转移蛋白,在胆固醇酯从HDL向VLDL的转移过程中起着重要的作用,也有不支持这一论点的实验依据,还有报道心肌梗塞和冠心病患者血浆ApoD水平与HDL-胆固醇水平呈正相关并同时降低。ApoD水平可能与遗传因素有关,并与ApoAⅠ共同作为心血管疾病的早期预测指标。
第七节 载脂蛋白H
人载脂蛋白H(human apolipoprotein H,ApoH)又称为β2糖蛋白Ⅰ(β2-glycoprotein,β2-GI),由Schultze等于1961年首先发现,它是人血浆中作为过氯酸可溶性部分存在的一种50kD糖蛋白。
ApoH是由326个氨基酸残基组成的单链多肽,其中含量最丰富的是脯氨酸(共31个),半胱氨酸共有22个,与二硫键的形成有关。含有甘氨酸23个,并与胱氨酸共同形成高频β-转角所必需。ApoH分子量为50kD,具有寡聚多糖的结构,含有5个分支糖胺寡聚多糖侧链,糖链占整个蛋白质分子的19%,系由半乳糖,甘露糖、N-乙酰氨基葡萄糖、岩藻糖及N-乙酰神经氨酸组成。所有寡聚多糖均通过糖基受体序列Asn-X-Ser/Thr而连接到天冬酰胺位点上,分别位于143、164、169、174和234残基位置上。受体序列中间位的“X”为色氨酸(Trp),且这两个Trp在蛋白链中都为同源位点。
因等位基因缺失可引起血清浓度异常,依此提出两个常染色体共显性等位基因-BgN(正常型)和BgD(缺失型)控制ApoH的表达模式:BgNBgN纯合子个体,其ApoH浓度在169~300mg/L;BgNBgD杂合子,血清浓度在60~140mg/L;而BgDBgD纯合子个体则<50mg/L。BgD缺失型等位基因出现频率在先天愚型人群中>20%,比健康人群要高。非遗传因素也可以起血清中ApoH含量的变化。因ApoH基因变异,其结构存在多态性,目前认为编码相关的三个普通等位基因即ApoH1、ApoH2和ApoH3、还有ApoH4的存在。三个常染色体的3个等位基因型决定了六种不同形式的表型,共同基因ApoH2出现频率高达90%。
在人血浆中占总量60%的ApoH存在于离心后d>1.21g/ml底层部分的游离脂蛋白中,余下部分则主要存在于富含TG的脂蛋白中,是CM、VLDL、LDL和HDL的组成成分,又是LPL的激活剂。有报道,ApoH在ApoCⅡ存在时,能提高LPL活性45±17%,而ApoCⅢ则降低ApoH是ApoCⅡ赋予的LPL活性的77%。ApoH还参与凝血机制,因为ApoH与血小板结合,使磷脂带阴电荷,从而减少凝血因子Xa、Va、Ca++与凝血酶原的结合位点或凝血酶原结合到血小板膜上后,通过调节腺苷酸环化酶活性来抑制ADP介导的血小板凝集,它作为一种血浆抑制因子,抑制内源性凝血旁路的接触激活。
在肾小管疾病中,ApoH的检测可作为早期肾小管损伤时的诊断指标,然而灵敏度尚不够高。
健康人血浆中ApoH浓度为193±30mg/L。
(周新 郑芳)
(载脂蛋白的种类与结构)参考文献
1.王克勤主编,脂蛋白与动脉粥样硬化,北京:人民卫生出版社,1995
2.Zannis V,Breslow J,Katz A,et al.Isoprotein ofhumnan apolipoprotein AI demonstrated in plasma and intestinal organ culture.JBiol Chem,1980,255:8612-8617
3.BrewerH,et al The amino acid sequence of human Apoa I,an apolipoprotein isolated fromhigh density lipoproteins .Biophy Res Commun,1978,80:623-630
4.SchaererE,et al.Human apolipoprotein AI and A Ⅱmetabolism,j Lipid Res,1982,23:850-862
5.SteinmetzA,Vterman G.Activation of lectithin:cholesterol acyltransferase by humanapolipoprotein A Ⅳ.J Biolchem,1985,260:2258-2264
6.Bojanovski D,Gregg R,Ghiselli G,et al.Human apolipoprotein A I isoproteinmetabolism:preapo A I conversion to mature ApoA I.J Lipid Res,1985-193
7.Avogarpm,etal Aer apolipoproteins better discriminatory than lipids foratherosclerosis.Lancet,1979,1:901
8.DeBackerG et al.Discriminatory valuc of ilpids and apoproteins in coronary heartdisease.Atherosclerosis,1982,42:197
9. Alberset al Immunoassay of hunan apolipoprotein B.Metab Chin Exp,1975,24:1339
10.NomaA Plasma lipids and apolipoproteins as discriminators for presnce and severityof angiographically defined coronary artery disease.Atherosclerosis,1983,49:1
11.周新,张华征,殷以礼等,抗人载脂蛋白B血清的制备及其临床应用,中华心血管病杂专,1986,14:135-137
12.YangC,Gu Z,Weng S,et al.Structure of apolipoprotein B100of human low densitylipoproteins.Arteriosclerosis,1989,9:96-108
13.Youg,S,BerticsS,Curtiss L,et al.Monochonal antibody MB19detcts genetic polymorphisn in humanapolipoprotein B.Proc Natl Acad Sci USA,1986,83:1101-1105
14.周新,张华征,韩豫等.人血清载脂蛋白C的分离与定量.科学通报,1984,29:437-440
15.BrownW,Levy R,Frerickson Det al. Studies of the proteins in human plasma very lowdensity lipoprotein .J Bio Chem,1970,245:6588-6594
16.BlaufussM,Cordon J,Schonfeld G et al.Biosynthesis of Apolipoprotein C-Ⅲin rat liver and smart intestinalmacosa.J Biol Chem,1984,259:2452
17.YasuhisaI,Shunichi K,Hiroshi I,et al .Plasma levels of lipids and Apolipoproteins Ephenotypic groups,Nature, 1985,269:605-608
18.UtermannG,Langenbeck U,Beisiegel V,et al .Genetics of the apolipoprotein E sysem in man,Am J,Hum Genet,1980,32:339-347
19.CristinaC,Walden M.Robert A,et al.Apolipoprotein E in hyperlipidemia.Am Intern Med,1994,120:1026-1036
20.DallongevilleJ.Cacan S,Davignon Jet al.Modulation of plasma triglyceride level by ApoEphenotype:a meta analysis,J Lipids Res ,1992,33:447-454
21.UtermannG et al Apolipoprotein E polymorphism in health and disease Am Heart J,1987,113:433-440
22.陈保生,等电点聚焦方法在AopE遗传表型研究中的应用,基础医学与临床,1991,11:57-60
23.ZannisV,Just P,Breslow J,et al .Human apolipoprotein e isoprotein subclasses aregenetiaclly determined Am J Hum Genet,1981,33:11-24
24.KurosakaD,Teramoto T,Matsushima T,et al .Apolipoprotein e deficiency with a depressedmRNA of mormal size .Atherosclerosis ,1991, 88:15-20
25.KambohM,Eerrell R,Sepehrnia B,Genetic studies of human apolipoprotein Ⅳ:Structural heterogeneity ofapolipoprotein H(β2-glycoprotein I),Am J,Hum Genet ,1988,42:452-457
26.McNallyT,Mackie I,Isenberg D et al.Immunoelectrophoresis and ELISA techniques forassay of plasma β2-glycoprotein –I and the influence of plasma lipids,Thrombosis Research,1993,72:275-286
27.McNeilH,Simpson R,Chesteman C,et al.Antiphospholipid antibodies are directed acomplex antigen that in cludes a lipid binding inhibitor of coagulation:β2gycoprotein –I(apolipotprotein H)Proc Natl Acad Sci USA,1990,87:4120-4124
28.RobertoG,Gianluca R,Maurizio Cet al.Apolipoprtein H:a two-step isolation method.JLipid Res ,1996,37:902-904
29.SiestG,Pillot T,Regis-Bailly A et al.Apolipoprotein E:An important gene and proteinto follow in laboratory medicine Clin Chem,1995,41:1068-1086
30.杨振华,夏永静译.载脂蛋白E:实验医学研究中的重要基因与蛋白质,交换资料,1995
第四章 载脂蛋白基因结构及其基因型
自80年代初期以来,随着分子生物学技术的发展和应用,载脂蛋白(Apo)AⅠ、AⅡ、AⅣ、(a)、B、CⅠ、CⅡ、CⅢ、CⅣ、D、E、F、H以及J的cDNA和基因已先后分离和鉴定。这些载脂蛋白基因的染色体定位业已完成。载脂蛋白cDNA及基因的鉴定以及染色体定位为深入研究载脂蛋白的结构与功能、载脂蛋白基因的表达与调控以及载脂蛋白基因的遗传变异与动脉粥样硬化的关系提供了新的工具。已有大量文献报道了各种载脂蛋白基因的多态性。有些多态性与异常的脂蛋白代谢以及早发动脉粥样硬化密切相关。本章拟就各种载脂蛋白的基因结构及其基因型、载脂蛋白基因的染色体定位、载脂蛋白基因的多态性与动脉粥样硬化的关联作一简要介绍。
第一节 载脂蛋白基因结构
载脂蛋白基因的分离是通过用相应的cDNA作为探针筛选基因文库而完成的。比较基因的核苷酸序列与cDNA的核苷酸序列得以鉴定基因的内含子与外显子数目以及它们的分界线。大部分真核细胞的基因含有内含子,内含子不编码氨基酸,但有些内含子参与基因表达的调控。外显子通常占据基因内的三个区域:第一个区域不编码氨基酸,含有RNA转录起始以及导向mRNA至核糖体合成蛋白质的信号序列;第二个区域编码信号肽、前肽以及成熟蛋白质的部分氨基酸;第三个区域除编码成熟蛋白质的氨基酸外,还含有终止翻译以及添加聚腺苷酸的信号。并非每个基因所含的内含子与外显子数目相等。真核细胞基因的这些结构特点也体现在载脂蛋白的基因结构中。有些载脂蛋白基因具有独特的结构特征。本节重点介绍ApoAⅠ、AⅡ、AⅣ、CⅠ、CⅡ、CⅢ、E基因结构的类同性、载脂蛋白B基因的结构特点以及Apo(a)基因的结构特点。其他的载脂蛋白基因结构均以列表的形式介绍。
一、ApoAⅠ、AⅡ、AⅣ、CⅠ、CⅡ、CⅢ及E的基因结构的类同性
载脂蛋白AⅠ、AⅡ、AⅣ、CⅠ、CⅡ、CⅢ以及E的基因结构非常相似。除ApoAⅣ缺少第1个内含子外,其余的载脂蛋白基因均由三个内含子与四个外显子组成(如图4-1所示)。内含子的分布位置几乎相同。第一个内含子截断5未翻译区,第二个内含子截断信号肽的编码区,靠近信号肽的切割部位,第三个内含子截断编码成熟蛋白质的区域。尽管ApoAⅣ缺少第一个内含子,它的第二及第三内含子的分布与其他载脂蛋白相同。载脂蛋白AⅠ、AⅡ、CⅠ、CⅡ、CⅢ、E基因的前三个外显子以及ApoAⅣ基因的前二个外显子的长度颇为相近,它们之间长度的不同主要取决于第四个或第三个(ApoAⅣ)外显子的长短。这七种载脂蛋白基因结构的类同支持如下假说,即这些基因起源于一个共同的前体,通过部分或完全的基因重复的机制衍化而来。
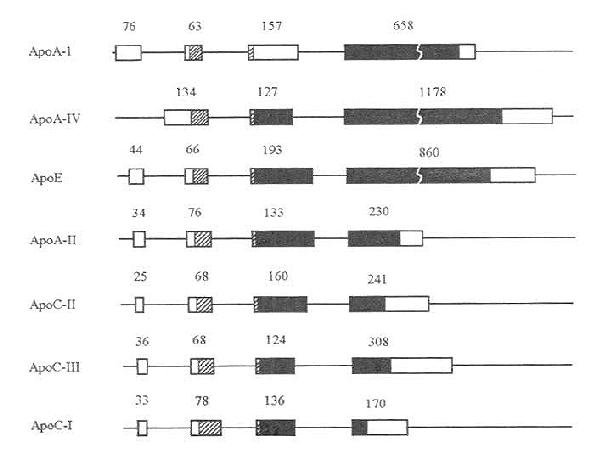
图4-1 载脂蛋白AⅠ、AⅡ、AⅣ、CⅠ、CⅡ、CⅢ以及E的基因结构示意图
宽方块代表外显子,细线代表内含子或5及3侧翼区。在外显子区内:两端的空方块代表5及3未翻译区;斜线方块代表信号肽区;位于信号肽与成熟肽之间的窄空方块代表前肽(Prosegment)区。图中的数值表示各个外显子的长度(核苷酸对的数目)。(源出:L.Chan,Klin.Wochenschr.67:227,1989)
二、载脂蛋白B的基因结构
与上述载脂蛋白基因的结构相比较,载脂蛋白B的基因结构具有显着的差异。后者长达43000核苷酸碱基对,含有28个内含子与29个外显子。其中外显子26与29分别长达7572与1906碱基对。外显子26编码载脂蛋白B的第1379至3903个氨基酸,它比迄今为止所发现的哺乳动物基因的任何外显子都长3倍之多。这种特长的外显子是否由一些短外显子融合所致尚不清楚。在载脂蛋白B的内含子中,已发现有6种重复DNA序列。其中某些特征序列模式已成为流行病学及家族研究的工具。
载脂蛋白B基因表达的产物有ApoB100和ApoB48,前者由4536个氨基酸组成,后者包含2152个氨基酸。载脂蛋白B48是由小肠RNA剪切酶修饰ApoB信使RNA所产生的。小肠ApoB信使RNA在第6666个核苷酸的位置上含U,而肝ApoB信使RNA的同一位置上为C。由U取代C导致了一个终止翻译密码子(UAA)的产生。UAA取代了编码ApoB100第2153个氨基酸谷氨酰胺的CAA密码子。故在小肠ApoB基因表达的产物ApoB48仅含2152个氨基酸。约占ApoB100组成的48%(见图4-2)。这种ApoB信使RNA剪切机制在哺乳动物的分子生物学研究领域内是空前未有的先例。这种机制的存在有何生理意义还待进一步的探讨。
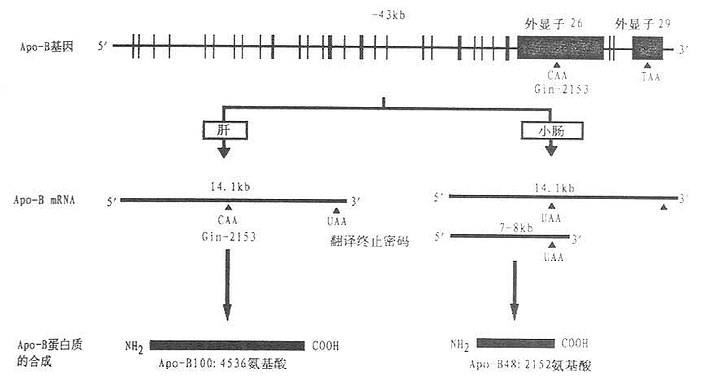
图4-2 载脂蛋白B基因结构以及ApoB100与ApoB48合成示意图
载脂蛋白B基因的29个外显子均由竖线表示出来,其中两个特长的外显子26个和29作了特别的标记。位于外显子之间的28个间隙代表28个内含子。图中的碱基对数目分别代表载脂蛋白B基因、载脂蛋白B100信使RNA以及ApoB48信使RNA的长度。UAA和TAA为终止翻译密码子,CAA为编码谷氨酰胺的密码子。(源自Young S G Circulation82(5):1597,1990)
三、载脂蛋白(a)的基因结构
载脂蛋白(a)的基因由10~45个内含子和11~46个外显子组成(见图4-3A)。这种变异主要取决于Kringle(丹麦烤卷饼)-4功能区的数目,此数目可高达37。其中24个Kringle-4功能区核苷酸序列完全相同,均由342核苷酸碱基对组成。第24、27、28及29区仅相异于3个核苷酸。其他的区有11~71核苷酸序列的不同。Apo(a)基因的结构与血纤维蛋白溶酶原的基因结构相似(见图4-3A与图4-1B)。其中信号肽编码区100%的等同。其他区域的类似程度在75%~94%不等。这提示Apo(a)与血纤维蛋白溶酶原基因由同一个前体衍化而来。正是由于这个类同性,脂蛋白(a)不仅与脂类代谢有关。而且也参与血液凝固的机制。
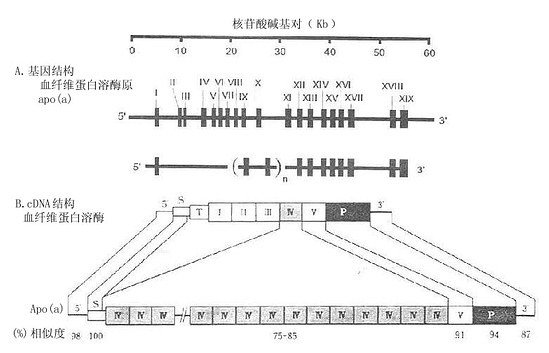
图4-3 Apo(a)与血纤维蛋白溶酶原基因结构(A)与cDNR结构(B)的比较
在图4-3A中,数值Ⅰ-XIX标记的竖棒代表外显子的数目与序列。外显子间的间隙为内含子。在Apo(a)的基因结构中,n代表Kringle-4功能区的数目是变动的,可高达37。在图4-3B中,S代表信号肽:T代表“尾巴”区;Ⅰ-Ⅴ分别代表Kringle-5功能区;P代表蛋白酶功能区。血纤维蛋白溶酶原与Apo(a)各功能区的相似程度(%)标记在图B的下部。(源自:Ichinose A. Biochemistry31:3115,1992 and Mclean et al. Nature 330:136,1987.)
四、人体载脂蛋白基因结构一览表
表4-1列出所有已经鉴定的人体载脂蛋白的基因结构,即内含子与外显子的组成以及基因表达后的产物信号肽、前肽及成熟肽的分布。表中附有的文献索引供进一步查阅时参考。
表4-1 人体载脂蛋白基因的结构特征
| 基因 | 内含子 | 外显子 | 信号肽 | 前肽 | 成熟肽 | 参考文献 |
| AⅠ | 3 | 4 | 18 | 6 | 243 | 6 |
| AⅡ | 3 | 4 | 18 | 5 | 77 | 7 |
| AⅣ | 2 | 3 | 20 | 377 | 8 | |
| (a) | 10-45 | 11-46 | 19 | 4.529 | 4.5 | |
| B | 28 | 29 | 27 | 4.536 | 9 | |
| CⅠ | 3 | 4 | 26 | 57 | 10.2 | |
| CⅡ | 3 | 4 | 22 | 79 | 11 | |
| CⅢ | 3 | 4 | 20 | 79 | 12a | |
| CⅣ | 2 | 3 | 25 | 102 | 12b | |
| D | 4 | 5 | 20 | 169 | 13 | |
| E | 3 | 4 | 18 | 299 | 14 | |
| F | * | * | 22 | 286 | 15 | |
| G* | ||||||
| H | * | * | 19 | 326 | 16 | |
| J | 8 | 9 | ? | 427 | 17.27 |
*:尚未见有关资料报道。
第二节 载脂蛋白基因的染色体定位
大部分人体载脂蛋白基因的染色体定位采用了两种方法:DNA印迹法(Southern blotting);荧光标记原位杂交法(fluorescence insitu hybridization)。DNA印迹法主要是分析从人与老鼠或中国苍鼠体细胞杂交体中提取的DNA。如果人体某种载脂蛋白cDNA或基因DNA探针仅与含有特定人体染色体的体细胞杂交体DNA杂交,且不与同一杂交体内非人体染色体DNA交叉反应,这种载脂蛋白基因的染色体定位便可初步确立。荧光标记原位杂交法使用荧光素标记的载脂蛋白DNA探针与固定的分裂中期的染色体杂交,这种方法可确立载脂蛋白基因在染色体上的特定位置。这种定位的准确性可用某个染色体特异性的中心粒探针杂交进行佐证。在已确立的人体载脂蛋白基因染色体定位中ApoAⅠ、CⅢ、及AⅣ在第11号染色体和ApoE、CⅠ及CⅡ在第19号染色体上的位置毗邻,而其他载脂蛋白基因的分布较分散。
一、载脂蛋白基因丛分布
人体载脂蛋白基因AⅠ、CⅢ和AⅣ在第11号染色体上的位置毗邻,它们分布在22000个核苷酸碱基对之内,排列顺序为AⅠ-CⅢ-AⅣ。AⅣ基因距AⅠ基因3末端12000个碱基对。AⅣ的转录方向与AⅠ一致。CⅢ基因位于AⅠ和AⅣ之间。它的转录方向与AⅠ及AⅣ相反。ApoE、CⅠ和CⅡ的基因分布在第19号染体上,它们之间的距离仅为4000核苷酸碱基对。这三个基因以及6磷酸葡萄糖异构酶基因紧密相连地分布在中心体至长臂第13区段内。低密度脂蛋白受体的基因亦分布在第19号染色体,不过它分布在短臂区域内。这种载脂蛋白基因丛的分布可能反映这些载脂蛋白基因在进化的早期比较接近。它们的表达可能受着协同的调控机制。这种毗邻分布也具有临床意义。其中一种载脂蛋白基因的多态性也可能与其毗邻的载脂蛋白基因的多态性或遗传特征有关。
二、载脂蛋白基因染色体位一览表
表4-2列出载脂蛋白基因的染色体定位。大部分载脂蛋白基因在染色体长臂或短臂上的位置均已确定。表中列出的主要参考文献供进一步查阅其定位方法时参考。
表4-2 人体载脂蛋白基因的染色体定位
| 基因 | 染色体 | 染色体区段 | 基因座符号**** | 参考文献 |
| AⅠ | 11 | q23-q末端* | APOAI | 22 |
| AⅡ | 1 | q21-q23 | APOA2 | 23 |
| AⅣ | 11 | q23-q末端 | APOA4 | 22 |
| (a) | *** | |||
| B | 2 | P24-p** | APOB | 24 |
| CⅠ | 19 | q13.2 | APOC1 | 21 |
| CⅡ | 19 | q13.2 | APOC2 | 21 |
| CⅢ | 11 | q23-q末端 | APOC3 | 22 |
| D | 3 | q27-q末端 | APOD | 13 |
| E | 19 | q13.2 | APOE | 25 |
| F | 12 | *** | APOF | 15 |
| G | *** | |||
| H1 | 17 | q23-q末端 | APOH | 26 |
| J2 | 8 | P21 | CLI | 27 |
*:q代表长臂;数值代表区段;
**:p代表短臂;
***:尚未见有关资料报导;
****:参见计算机网络联系基因库(GDB:http:11www.gdb.orgl);
1:ApoH也称为β2-糖蛋白Ⅰ(β2-glycoprotein Ⅰ);
2:ApoJ也称为补体融解抑制剂(Complement lysis inhibitor,CLI),硫化糖蛋白2(Sulphatedglycoprotein2,SGP-2),gp-Ⅲ,SP-40,40,TRPM-2等。
第三节 载脂蛋白基因的多态性
在人类进化过程中,基因的DNA序列在逐渐演变。这种演变大都发生在氨基酸编码子以外的区域,称为“中性”变化,不导致临床疾病的发生。但是,基因的氨基酸编码区以及基因表达的调控区的DNA序列改变时有发生。导致蛋白质的合成量改变或基功能的异常。载脂蛋白结构基因或其调控区DNA序列的突变引起致高脂血症或早发动脉粥样硬化已大量见诸于医学文献。新的载脂蛋白基因的多态性不断地被发现。
检测载脂蛋白基因的遗传变异通常使用从外周血白细胞中提取的DNA为起始材料,通过聚合酶链反应扩增基因DNA的产量,嗣后,或采用变性梯度凝胶电泳(denaturing gradientgel electrophoresis, DGGE)显示由基因编码胺基酸区DAN序列突变所致的单股DNA构象的多态性;或使用等位基因特异的寡核苷酸探针杂交法(allele-specificoligonuc leotide hybridization,ASO)探测突变的等位基因;或测定限制性片段长度多态性(restriction fragment length polymorphism, RFLP)鉴定基因DNA序列的突变;或直接对某基因的片段进行DNA序列测定,与正常的相应的DNA序列比较,检测有否突变发生。这几种方法为较常使用的方法。有关这些方法的详细介绍可参见本书第十六章的生物化学检验技术篇。本节主要介绍ApoB,ApoE,Apo(a)。ApoAⅠ基因的多态性。对其他载脂蛋白基因的多态性仅以举例的方式略述。
一、ApoB基因的遗传变异与多态性
ApoB基因的遗传变异与多态性分以下几种类型进行介绍:①RFLP;②导致血浆胆固醇水平降低的基因突变;③导致血浆胆固醇升高的基因突变;④其他类型的多态性。
1.RFLP
据报道,载脂蛋白B基因的限制性片段长度多态性至少375种。后来发现有些多态性并非存在,纯属DNA序列测定错误。表4-3列举了10种RFLP。产生这些RFLP的突变或发生在ApoB基因上游启动子区域,或发生在内含子区域,或在外显子区域。
表4-3 ApoB基因限制性片段长度多态性举例
| 惹限制性内切酶 | 酶切位点 | 突变等位基因出现频率 | 酶切部位存在或缺失 |
| AvaⅡ | 距第1外显子上游4Kb | 0.20 | 缺失 |
| MspⅠ | 启动子区内,-265bp | 0.21 | 缺失 |
| ApaLⅠ | 第4外显子,cDNA的417bp | 0.36 | 缺失 |
| HincⅡ | 第4内含子内,距第3外显子3末端3334bp | 0.12 | 存在 |
| PvuⅡ | 第4内含子内,距5外显子5末端4523bp | 0.08 | 存在 |
| AluⅠ | 第14外显子内,cDNA的1981bp | 0.48 | 缺失 |
| BalⅠ | 第20内含子内,距第21外显子5末端146bp | 0.50 | |
| XbaⅠ | 第26外显子内,cDNA的7674bp | 0.40-0.50 | 存在 |
| MspⅠ | 第26外显子内,cDNA的11040bp | 0.12 | 缺失 |
| EcoRⅠ | 第26外显子内,cDNA的12670bp | 0.20 | 缺失 |
(源自:Young S G. Circulation 82:1583,1990)
表4-3所列发生在外显子内的突变,除XbaⅠ限制性片段长度多态性外,其余均导致氨基酸改变。已有很多研究者致力于研究常见的ApoB基因PFLP与高胆醇血症、高甘油三酯血症硬化的相关关系,但发现令人信服的相关关系的报道不是很多,还有的结果相互矛盾。正如Young指出的那样,有的研究所使用的样本量太小;有的研究对照组的选择不合规范;有的研究基于不同的种族,忽视了正常的种族差异。很显然。在以后的相关研究中,尽可能选用大样本量,合理的选择对照组,考虑不同种族的正常遗传变异无疑对确证某些ApoE基因的RFLP与脂蛋白代谢紊乱的特殊表型以及早发动脉粥样硬化的关联尤为重要。
2.导致血浆胆固醇水平降低的ApoB基因突变
经过许多实验室的努力,一些ApoB基因的无义突变或移码突变导致家族性密度脂蛋白血症均已鉴定(见表4-4)。
表4-4 ApoB基因突变导致短ApoB的合成
| ApoB的长度 | DNA水平上的突变 | 短ApoB在血浆脂蛋白中的分布 |
| B-2 | 在第5内含因子中,G颠换成T | 无 |
| B-9 | T替代C,使翻译在411号密码子后终止 | 无 |
| B-25 | 在第21外显子内有694bp缺失 | 无 |
| B-27.6 | 在第24内含子内,剪接部位突变 | HDL,LDL |
| B-29 | 在第4152核苷酸上,T替代C | 无 |
| B-31 | cDNA核苷酸4480缺失 | HDL及密度大于1.2g/cm3部分 |
| B-32 | 在密码子1450上,T替代C | HDL,LDL |
| B-32.5 | 在4631核苷酸上,G替代T | HDL及密度大于1.21g/cm3部分 |
| B-37 | cDNA核苷酸5391至5394段缺失 | VLDL,LDL,HDL |
| B-39 | cDNA核苷酸5591缺失 | VLDL,LDL |
| B-40 | cDNA核苷酸5693至5694段缺失 | VLDL,LDL,HDL |
| B-46 | 在cDNA核苷酸6381上,T替代C | VLDL,LDL,HDL |
| B-49.6 | 在cDNA核苷酸6963上,T替代C | VLDL,LDL,HDL |
| B-52.8 | cDNA核苷酸7295缺失 | VLDL,HDL |
| B-54.8 | cDNA核甘酸7539缺失在cDNA核苷酸7655上,T替代C | VLDL,HDL |
| B-61 | 在核苷酸8525处,有37bp缺失 | VLDL,HDL |
| B-67 | cDNA核苷酸9327缺失 | LDL,VLDL |
| B-74.7 | cDNA核苷酸10366缺失 | LDL,VLDL |
| B-82 | 在核苷酸11411上,A替代C | VLDL,HDL |
| B-86 | cDNA核苷酸11840缺失 | VLDL,HDL |
| B-87 | cDNA核苷酸12032缺失 | VLDL,HDL |
| B-89 | cDNA核苷酸12309缺失 | VLDL,HDL |
(源自:Kane ,J.P.,and Havel, R.J.In:The metalbolic and molecular bases of inherited disease,edited by Scriver, C.R.et al, Vol Ⅱ,p1868,1995,McGraw –Hill,Inc.,New York,U.S.A)
家族性低低密度脂蛋白血症的患者大多为杂合子,即他们携带一个正常的ApoB等位基因和一个变异的ApoB等位基因。纯合子以及复合杂合子患者少见。短ApoB合成的患者血浆中ApoB的浓度较低,仅为正常人ApoB等位基因产生的ApoB-100浓度的2%~10%,其机理尚未完全明了。有人发现,含有ApoB87和ApoB89的LDL比含ApoB-100的LDL更易于被LDL受体摄取。亦有人推测在杂合子患者中,由一个正常ApoB-100等位基因编码的ApoB-100与两个正常ApoE等位基因编码的ApoE组成的脂蛋白颗粒比正常的脂蛋白颗粒多含有1倍的ApoE,故前者易于被LDL摄取清除。这些均有助于解释一部分短ApoB合成患者体内低浓度血浆ApoB及低浓度血浆胆固醇的机制有等进一步努力。不难想到的是,家族性低低密度脂蛋白血症患者血浆中LDL胆固醇低,产生冠心病及动脉粥样硬化的危险性也降低。已有一些报道证实,这些患者不产生动脉粥样硬化且寿命增长。故有人认为,对惯常食用高饱和脂肪、高胆固醇饮食的北美人群,携带合成短ApoB的突变基因非但无害,反而有益于健康。
3.导致血浆胆固醇升高的基因突变。
Brown和Goldstein的经典研究,即LDL受体基因的突变,引起LDL清除障碍,LDL在血浆中蓄积,导致早发动脉粥样硬化,这是家族性高胆固醇血症的主要病因。这些患者的血浆总胆固醇浓度高于7.76mmol/L。然而有相当一部分人的血浆胆固醇浓度在6.47~7.76mmol/L之间,与正常人相比为轻中度升高。长期以来,人们一直推测ApoB基因遗传变异可合成有缺损的ApoB蛋白质,后者与LDL受体亲和力下降,引起LDL清除障碍,LDL在血浆中蓄积。这种推测于1989年得到了证实。Soria等人发现了家族性ApoB100缺损。这些病人在其Apob cDNA第10708个核苷酸位置上,G转换成了A,导致ApoB100的等3500个氨基酸精氨酸变换成了谷氨酰胺。这一突变使其LDL与LDL受体的结合力下降,产生高胆固醇血症。据估计,这种突变在人群中的发生率与LDL受体的突变率接近,即1/500。
另一家族性ApoB100缺损是由ApoB基因第10800核苷酸位置上的C转换成T所致。这一突变ApoB内第3531个氨基酸精氨酸变成了半胱胺酸。8个患者的平均血浆LDL胆固醇水平在6.78mmol/L,而8个未患ApoB基因突变的亲戚为3.88mmol/L。患者LDL对LDL受体的亲和力仅为正常对照组的39%。由于C至T的转换,产生一个新的限制性内切酶切割部位(NsiI),这将有助于在大范围人群内检测这种突变发生率。
4.其他类型的多态型
距ApoB基因3末端500个核苷酸碱基对区域,有一DNA片段构成可变动数目的半联重复(variable number of tandem repeats. VNTR)已发现ApoB基因3末端这种VNTR所致的多态性与心肌梗塞的发作有关联。
ApoB信号肽由27个氨基酸组成。在高加索种族人群中发现了两种多态性:一种为插入等位基因型,编码27个氨基酸;另一种为缺失等位基因型,编码24个氨基酸。Visvikis 等人发现缺失等位基因型与高血浆ApoB 水平、LDL胆固醇水平、LP(a)水平以及总胆固醇水平有关。最近Kammerer等人在34家共686名美籍墨西哥人中发现编码ApoB信号肽的三种等位基因:SP-24,SP-27,SP-29,它们分别编码24,27与29肽。携带SP-24等位基因的纯合子其血浆ApoB与LDL胆固醇的浓度显著高于SP-27纯合子。SP-29杂合子的ApoB与LDL胆固醇水平比SP-24纯合子还高。
二、ApoE基因的多态性
ApoE在胆固醇与甘油三酯代谢中起着重要作用。在正常人群中,10%以上的个体间血浆胆固醇水平的着异可归究于ApoE基因的多态性。主要的ApoE等位基因有ApoE2、ApoE3和ApoE4。ApoE3在人群中的出现率最高,被认为较常见的ApoE基因。ApoE2与Ⅲ型高脂蛋白血症相关,而ApoE4在老年性痴呆病(Alzheimers disease)患者中的出现率较高。这后一发现开拓了人们的视野,即ApoE不仅在脂类代谢中至关重要,而且在其他的代谢过程中也扮演重要角色。已有报道,ApoE参与组织损伤的修复、免疫调节以及调控细胞生长与分化。相信随着时间推移,更多新的ApoE功能及新的ApoE基因多态性会被发现。
表4-5列举了一些已鉴定的ApoE基因的遗传变异。表中同时列出了密码子及其编码的氨基酸的改变、特定ApoE基因变异型首先被鉴定出的那个民族、出现频率、相关的高脂血症型以及遗传方式。
表4-5 ApoE多态性
| 多态性名称1 | 变异密码 子 | 核苷酸改变 | 氨基酸改变2 | 种族背景 | 分布率3 | 高脂血症型4 | 遗传方式 | |
| 常见的ApoE基因型 | ||||||||
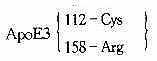 | - | - | - | 所有民族 | 41.9~91.1% | - | ||
| ApoE4 | 112 | TGC→CGC | Cys→Arg | 所有民族 | 6.4%~36.8% | N/HC | ||
| ApoE2 | 158 | CGC→TGC | Arg→Cys | 大部分民族 | 0.0%~14.5% | N/FD | 陷性 | |
| 与FD相关的多态型 | ||||||||
| ApoE0 | 第3内含子 | A →G,G缺 | 合成两种短肽 | 美洲黑人 | 14 | FD | 陷性 | |
| 3592bp-60 | 失移码突变 | 合成60肽 | 德国人 | 3 | FD | 陷性 | ||
| ApoE4-费城 | 13 | GAG →AAG | Glu →Lys | 拉丁美洲人 | 7 | FD | 陷性 | |
| 145 | CGT →TGT | Arg →Cys | 拉丁美洲人 | 陷性 | ||||
| ApoE3-Leiden | 112 | TGC →CGC | Cys →Arg | 荷兰人 | >40 | FD | 显性 | |
 | 21bp重复 | 7个氨基酸患联重复 | ||||||
| ApoE1 | 127 | GGC→GAC | Gly→Asp | 高加索人 | >25 | FD | 未知 | |
| 158 | CGC→TGC | Arg→Cys | ||||||
| ApoE2-Christchurch | 136 | CGC→AGC | Arg→Ser | 未报道 | 3 | FD | 未知 | |
| ApoE3 | 112 | TGC→CGC | Cys→Arg | 拉丁美洲人 | 6 | FD | 显性 | |
| 142 | CGC→TGC | Arg→Cys | ||||||
| ApoE3--kochi | 145 | CGT→TGT | Arg→His | 日本人 | 4 | FD | 未知 | |
| ApoE2 | 145 | CGT→TGT | Arg→His | 未报道 | 3 | FD | 未知 | |
| ApoE1- Harrisburg | 146 | AAG→GAG | Lys→Glu | 日本人高加索 人 | 8 | FD | 未知 | |
| ApoE2 | 146 | AAG→GAG | Lys→Gln | 荷兰人美国人 | >40 | FD | 显性 | |
| ApoE3华盛顿 | 210 | TGG→TAG | Trp→终止密码 | 美国白人 | 3 | FD | 陷性 | |
| ApoE2 Fukuoka | 224 | CGG→CAG | Arg→Gln | 日本人 | 1 | FD | 未知 | |
| 与非FD高脂血症相关的多态型 | ||||||||
| ApoE5 | 3 | GAG→AAG | Glu→Lys | 日本人 | 0.5% | HC | ||
| 13 | GAG→AAG | Glu→Lys | 法籍加拿大人 | 6 | HC/HTG | |||
| ApoE2-Dunedin | 228 | CGC→TGC | Arg→Cys | 未报道 | 2 | HTG | ||
| ApoE2 | 236 | GTG→GAG | Val→Glu | 荷兰人 | 8 | HTG | ||
| ApoE7-Suita | 244 | GAG→AAG | Glu→Lys | 日本人 | 0.5%~0.8% | HC/HTG | ||
| 245 | GAG→AAG | Glu→Cys | ||||||
| ApoE3 | 112 | TGC→CGC | Cys→Arg | 荷兰人 | 3 | HTG | ||
| 251 | CGC→GGC | Arg→Gly | ||||||
| ApoE1 | 158 | CGC→TGC | Arg→Cys | 荷兰人 | 2 | HC | ||
| 252 | CTG→GAG | Leu→Glu | ||||||
| 与高脂血症无关的多态型 | ||||||||
| ApoE4-+-Ferburg | 28 | CTG→CCG | Leu→Pro | 德国高加索人 | 0.4%~0.9% | N | ||
| 112 | TGC→CGC | Cys→Arg | ||||||
| ApoE4 | 112 | TGC→CGC | Cys→Arg | 荷兰人 | 5 | N | ||
| 274 | CGC→CAC | Arg→His | ||||||
| ApoE4+ | 296 | AGC→CGC | Ser→Arg | 荷兰人 | 5 | N | ||
| ApoE5 | 84 | CCG→CGG | Pro→Arg | 美国白人 | 0.2% | N | ||
| 112 | TGC→CGC | Cys→Arg | ||||||
| ApoE3-Freibaug | 42 | ACA→GCA | Thr→Ala | 德国高加索人 | 1 | N | ||
| ApoE3 | 99 | GCG→ACG | Ala→Thr | 美国人 | 1 | N | ||
| 152 | GCC→CCC | Ara→Pro | ||||||
| ApoE2 | 134 | CGG→CAG | Arg→Gln | 荷兰人 | 5 | N | ||
1.除费城(Philadelphia)与华盛顿(Washington)两地名外,其他的地名均未翻译过来;
2.氨基酸代号:Cys-半胱氨酸;Arg-精氨酸;Glu-谷氨酸;Lys-赖氨酸;Gly-甘氨酸;Asp-天门冬氨酸;Ser-丝氨酸;His-组氨酸;Gln-谷氨酰胺;Trp-色氨酸;Val-缬氨酸;Leu-亮氨酸;Thr-苏氨酸;Ala-丙氨酸;Pro-脯氨酸;
3:分布率:加百分号的分布率是根据检测1000人以上的结果计算的;未加百分号的数值代表测出的携带ApoE多态型(包括纯合子与杂合子)的人数;
4:缩写:N(Normal,正常)HC(hypercholesterolemia,高胆固醇血症);FD(familialdysbetalipoproteinemia,家族性异常低密度酯蛋白血症,含Ⅲ型高脂蛋白血症)。
(源自:Knijff et al. Hum. Mutation4:181,1994)
三、Apo(a)基因的多态性
血浆Lp(a)的浓度与Apo(a)蛋白质的大小成反比,即Apo(a)的分子量愈大,则Lp(a)的浓度愈低;Apo(a)的分子量愈小,则Lp(a)的浓度愈高。Apo(a)的分子量在400~800KDa之间。按照Apo(a)在聚丙烯凝胶电脉时相对于ApoB100(分子量为520KDa)的迁移率,Utermann等人于1987年将Apo(a)归类为六种多态型;F比ApoB100迁移快;B与ApoB100迁移率相等;S1,S2,S3,S4比ApoB100迁移慢。现已证实。Apo(a)蛋白质的多态型是由Apo(a)基因中Kringle-4的数目变化而引起的。Kring-4基因片段含有几个稀少的限制性酶切部位(NotI,SfiI.KspI,Sval,KpnI),这为加速筛选Apo(a)基因的多态性提供了帮助。表4-5列举在奥地利北部Tyrolean区高加索人群中用KpnI作工具所测得的RFLP与1-4Kringe的数目、Apo(a)蛋白质的大小以及血浆Lp(a)浓度的关系。
表4-6 Apo(a)Kpni 片段与Apo(a)蛋白质多态型、Kringle-4功能区数目以及血浆Lp(a)浓度之关系
| 表现分子量(KDa) | KpnI片段(Kb) | Kringle-4数目 | 等位基因 数目 | 平均Lp(a)浓度(mg%) | KpnI片段频率(%) | |
| F | <450 | 37-49 | 11-13 | 1-3 | * | <0.2 |
| B | ~500 | 55-66 | 14-16 | 4-6 | 61.7 | 1.2 |
| S1 | ~550 | 72-82 | 17-19 | 7-9 | 34.4 | 3.8 |
| S2 | ~600 | 88-99 | 20-22 | 10-12 | 24.5 | 11.2 |
| S3 | ~650 | 105-116 | 23-25 | 13-15 | 10.2 | 13.7 |
| S4 | >700 | 121-210 | 26-42 | 16-32 | <5.7 | 70.1 |
*:样本量太小,资料缺如。(源自:Utermann,G.In:The metabolic andmolecular bases of inherited disease.7th ed, Vol.Ⅱ,eds.Scriver,C.R.etal.p1897,McGraw-Hill.Inc.,New York,1995)
由表4-6可看出,血浆Lp(a)的浓度亦与Kpn片段的大小成反比。这为血浆Lp(a)与Apo(a)多态型的大小成反比从基因DNA水平提供了直接的证据。
Scana等人在Kringle-4第37个重复区(KIV-37,又称为KringleⅣ-10)检测出了两种突变:一种突变导致第72个氨基酸被精氨酸取代;另一种突变导致第66个氨基酸苏氨酸被蛋氨酸取代。前者致使其Lp(a)不能与赖氨酸结合,且血浆Lp(a)浓度降低。后者似乎与Lp(a)浓度无关。Mooser等人报道在距第1第外显子5’端1.3Kb区或内,由5个核苷酸[(TTT-TA)n]构成的VNTR与其血浆Lp(a)浓度相关。此外。亦有报道Apo(a)基因5’端侧翼区DNA序列的多态性控制血浆Lp(a)的浓度。
四、ApoAⅠ基因的多态性
ApoAⅠ为HDL的主要结构蛋白。ApoAI基因突变可导致异常的ApoAⅠ蛋白质的合成。有些异常的ApoAⅠ影响HDL的代谢。已报道的阻碍ApoAⅠ合成的基因突变有重排、缺失、无义突变等方式。这些突变的纯合子患者表现出极低HDL胆固醇水平和早发冠心病。目前已发现至少有20种不同的ApoAI结构基因的点突变导致氨基酸转换(见表4-7)。其中两种突变(精氨酸173→半胱氨酸和脯氨酸165→精氨酸)与低HDL胆固醇水平相关,但并不引致早发冠心病。
Talmud等人发现ApoAⅠ基因启动子区域内距转录起始部位第75个碱基(-75bp)A置换G的突变与高ApoAI及HDL水平相关。这种突变后的等位基因称为A等位基因,而含G的称为G等位基因。Saha等报道A等位基因在新加坡华人中出现的频率(0.27)高于高加索人(0.12)。Wang等人发现,ApoAⅠ基因第1内含子5末端,第83碱基C转换成T或第84碱基G转换成A,致使MspI酶切点丧失,这种突变与高HDL胆固醇相关,比上述的-75碱基A置换G突变与高HDL胆固醇的相关还强。
表4-7 人体ApoAI基因点突变导致氨基酸改变
| 氨基酸改变1 | 密码子2 | 核苷酸点突变 |
| Pro3→Arg | CCC | C→G |
| Pro3→His | CCC | C→A |
| Pro4→Arg | CCC | C→G |
| Arg10→Leu | CGA | G→T |
| Gly26→Arg | CGGC | G→C |
| Asp89→Glu | GATC | T→G,T→A |
| Asp103→Asn | CGAC | G→A |
| Lys107→0 | ||
| Lys107→Met | AAG | A→T |
| Glu136→Lys | CGAG | G→A |
| Glu139→Gly | GAG | A→G |
| Pro143→Arg | CCA | C→G |
| Glu147→Val | GAG | A→T |
| Ala158→Glu | GCG | C→G |
| Pro165→Arg | CCC | C→G |
| Glu169→Gln | CGAG | G→C |
| Arg173→Cys | GCGC | C→T |
| Arg177→His | CGC | G→A |
| Glu198→Lys | CGAG | G→A |
| Asp213→Gly | GAC | A→G |
1:氨基酸代号可参见表4-5脚注;第1排氨基酸右上角的数值表示其在ApoAⅠ一级结构上的位置;2:加底线的核苷酸为点突变部位。(源自:Eckardstein et al.J.Biol Chem.265:8612,1990)
五、其他载脂蛋白基因的多态性
与以上介绍的ApoB、ApoE、Apo(a)以及ApoAI的基因一样,其他载脂蛋白的基因也存在多态性,以下简要地列举一些例子。
1.ApoAⅠ-CⅢ-AⅣ基因限制性片段长度多态性
在ApoAⅠ-CⅢ-AⅣ基因丛内,使用XmnⅠ、ApaⅠ、MspⅠ、PstⅠ、SstⅠ、XbaⅠ、TaqⅠ和PvuⅡ限制性内切酶已检测出10多种RFLP。尽管这些多态性大多由编码氨基酸以外的DNA序列突变所致,其中有些RFLP的携带者与增加冠心病的危险相关。比如用限制性内切酶PstⅠ消化从人群中搜集的DNA后。用ApoAⅠcDNA探针印迹DNA可测得3.3Kb的DNA片段(称为P2等位基因)与2.2Kb的DNA片段(称为P1等位基因)。P1等位基因在正常人群中出现率较高。P2等位基因在低HDL胆固醇患者中的出现率高于对照组的6倍。来自英国与美国的报道亦证实,杂合子P1P2携带者血浆ApoAⅠ与HDL胆固醇的水平显著地低于P1P2基因型携带者。这提示在ApoAⅠ-CⅢ-AⅣ基因丛中,PstⅠ酶切点的多态性,P2等位基因,与降低血浆ApoAⅠ和HDL的水平以及诱发冠心病有关。最近,Dallinga-Thie等人在美国脂类研究杂志上报道,用限制性内切酶XmnⅠ与MspⅠ在ApoAⅠ-CⅢ-AⅣ基因丛内检测出的稀有等位基因与高血浆胆固醇、甘油三酯、ApoB以及LDL胆固醇水平相连。这些结果显示,ApoAⅠ-CⅢ-AⅣ基因丛参与调节血浆胆固醇及甘油三酯的代谢。
2.ApoEⅠ-CⅠ-CⅡ基因限制性片段长度多态性
位于第19对染色体上的ApoEⅠ-CⅠ-CⅡ基因丛也有多态性的存在。检测出其RFLP的限制性内切酶包括:HpaⅠ、TaqⅠ、BglⅡ、DraⅠ、NcoⅠ以及BglⅡ。Klasen等人报道,HpaⅠ限制性片段长度的多态性与易发Ⅲ型高脂血症有关。然而HpaⅠ限制性片段长度的多态性与E2/E2基因型无关接关联。这说明HpaⅠ的RFLP是不同于ApoE基因的一种独立的遗传因子,其突变点尚未阐明。
3.ApoAⅡ基因的突变
Deeb等报道了在一对日本姐妹中检测出的家族性ApoAⅡ缺陷症。冠状动脉造影显示这对姐妹未患血管疾病。尽管免疫生化检验测不出血浆ApoAⅡ水平,患者HDL胆固醇在正常范围。DNA分析显示,患者ApoAⅡ基因内第3内含子剪接供体部位的第一个碱基G突变成为A,从而阻碍了内含子从初级转录物中剪除掉的过程。这无疑是导致ApoAⅡ缺陷的原因。
4.ApoAⅣ基因的多态性
常见的ApoAⅣ等位基因编码ApoAⅣ的第360与347个氨基酸,分别为谷氨酰胺和苏氨酸。当ApoAⅣ基因的第360密码子上第3个碱基T置换G后,正常的第360氨基酸位置上的谷氨酰胺被代之为组氨酸,当第347密码子上第1个碱基T置换A后,苏氨酸347→丝氨酸的变异即发生。关于这两种ApoAⅣ基因多态性对脂类代谢的影响尚无一致的结论。另一种突变,即密码子127的突变可致HincⅡ酶切位点的丧失。最近Kamboh等人对西伯利亚中部的驯鹿牧民检测中发现,没有HincⅡ酶切位点等位基因的携带者血浆甘油三酯水平高于HincⅡ酶切位点等位基因的携带者。
5.ApoCⅡ基因的多态性
载脂蛋白CⅡ基因的突变有四种类型被鉴定:a.无义突变;b.起动密码子的碱基突变;c.第2内含子剪切供体部位突变;d.由碱基插入或缺失所致的移码突变。这些突变患者的血浆ApoCⅡ水平显著降低或缺失。其遗传方式为常染色体隐性遗传。
6.ApoCⅢ基因的多态性
已发现有三种ApoCⅢ基因多态性与高甘油三酯血症有关:a.3175核苷酸C颠换成G;b.3206核苷酸T颠换成G;c.3206G等位基因。Li等人不久前在临床研究杂志上报道,ApoCⅢ基因启动子内-482与-455碱基的突变与发生高甘油三酯血症有关。作者推测这种突变正发生在受胰岛素抑制DNA序列范围内。突变后的ApoCⅢ基因启动子摆脱了胰岛素的抑制调控,ApoCⅢ的转录大大加强,ApoCⅢ的合成增加。这可能是人群中发生高甘油三酯的一个主要因素。
7.ApoD基因的多态性
Vijayaraghavan等人检测了57个肥胖病人57名对照者ApoD基因TaqⅠ酶切位点限制性片段长度多态性:2.2与2.7Kb等位基因。他们发现2.2Kb等位基因在肥胖者中的分布显著地高于正常者。这包括含有2.2Kb等位基因的杂合子与纯合子,提示显性遗传方式。作者认为,ApoD基因TaqⅠ限制性片段长度多态性可作为研究肥胖病的一个遗传标志。
8.ApoH基因的多态性
ApoH基因第247密码子突变,致使第247个氨基酸缬氨酸被亮氨酸取代。因为此突变使RasⅠ酶切位点丧失,故这种限制性片段长度多态性很易检测。最近Kamboh等调查西伯利亚中部驯鹿牧民中三种ApoH等位基因ApoH1、ApoH2、与ApoH3的分布与血浆脂质水平的关系,他们发现ApoH等位基因与男子低甘油三酯水平相关。而与女子高甘油三酯水平相关。而女子高甘油三酯水平相关。ApoH基因的多态性与脂质代谢的关系还有待于更广泛地、更深入地探讨。
9.ApoJ基因的多态性
Kamboh暨同事报道,在对美国白种人、黑人、美洲印第安人、爱斯基摩人、新几内亚人及尼日利亚人6个民族共985名受试者的检测中。他们发现了ApoJ有三种多态型,即ApoJ1、ApoJ2和ApoJ3。ApoJ1存在于所有受试者基因内。ApoJ2仅存于美国黑人与尼日利亚人黑人,出现频率分别为24%与28%。ApoJ3仅从一美国黑人受试者测出。造成此多态性的突变尚未见报道。这三种“等位基因”似乎对总胆固醇、LDL胆固醇、HDL胆固醇、VLDL胆固醇、甘油三酯的水平没有显著的影响。
结论
随着分子生物学技术应用于脂类代谢与动脉粥样硬化的研究领域,几乎所有被命名的载脂蛋白的cDNA与基因被分离与鉴定。有关载脂蛋白基因多态性的报道与日俱增。人们对脂蛋白代谢紊乱从分子缺陷的水平进行认识取得了长足的进展。然而,各种载脂蛋白的生理功用尚未完全阐明。近年来发现ApoE4与老年性痴呆有关,揭示了ApoE的新的功用就佐证了这一点。对各种载脂蛋白的基因的各种多态性在所有种族间的分布进行系统的检测与分析还有待于进一步努力。一些新的、简易的、准确的检测方法也有待于开发。这些研究可望为载脂蛋白与动脉粥样硬化发病机制的探讨以及对动脉粥样硬化与冠心病的防治寻求新的措施开拓新的前景。
(叶永清)
(载脂蛋白基因结构及其基因型)参考文献
1.Li WH, Tanzmura M, Luo CC, etal Datta, S,and Chan L, The apolipioprotein multigene family:biosynthesis,structue,structure-function relationships, and evolution.J LipidRes,1988,29:245-271
2.Chan,L,The,apolipoproteinmultigene family: structure,express evolution and moleculargenetics.Kin.Wochenschr,1986,67:225-237
3. Young S G.Recent progress inunderstanding apolipoprotein B.Circulation,1990,82:1574-1594
4.Mclean JW ,Tomlinson JE,KuangWJ,et al cDNA sequence of hunan apoliporpotein(a) is homologous toplasminogen.Nure 1987,330:132-137
5. Ichinosie A.Multiple membersof the plasminogen,apolipoprotein(a) gene family associated withthromboses.Biochemistry 1992,31:3113-3118
6.Shoulders CC,KornblihttAR,Munro BS,et al Gene structure of human apolipoprotein AI.Nucleic AcidRes,1983,88;2827-2837
7. Tsao YK,Wei CF,Robberson DL,etal.Isolation and chraacterization of the human apolipoprotein AⅡgene.Electronmicrosscoic analysis of RNA:DNA hybrids,nucleotide sequence ,identification ofa polymorphic MspI site and general structural organization of apolipoproteingenes J Biol Chem,1985,260:15222-15231
8. Karathanasis SK,YunisI,Zannis,VI.Structure,evolution and tissue apecific synthesis of humanapolipoprotein AIV.Bochem,1986,25:3962-3970.
9.Blackhart BD,Ludwlg EM,PierottiVR,et al Structure of the Human apolipoprtein B gene.j BiolChem,1986,261:15264-3970
10. Knott TJ,RobertsonME,Priestley LM,et.al Characterization of mRNAs encoding the precursor forhuman apoliporpotein CI.Nucleic Acid Res,1984,12:3909-3915
11. Wei CF,Tsao YK,RobbersonDL,et al.The structure of the human apolipopretinCⅡ gene.Electron microscopicanalysis of RNA:DNA hybrids complete nucleotide sequence and identification of5’homologous sequences among apolipoprotein genes J BiolChem.1985,260:15211-15221
12.a Protter AA,Levy WilsonB,Miller J,et al Isolation and sequence analysis of the human apolipoproteinC-Ⅲgene an dthe intergenic region between AopAI and ApoC-Ⅲ genes and theintergenic region between ApoAI and ApoC-Ⅲ genes..DNA,1984,3:449-456
13.b Allan CM,Wallker D,SegrestJP,et al Identification and characterization of a new human gene (APOC-Ⅳ)in theapolipoprotein E,C-I,and C-Ⅱgene locus .Genomics ,1995,28291-300
14.Drayna DT,McLean JW,Wion KL,etal Human apolipoprotein Dgene:gene sequence,chromosome localization andhomology to the ? globulin –globulin superfamily ,DNA,1987,6:199-124
15.Das HK,McPherson J,BrunsGAP,et al.Isolation and characterzation and mapping to chromosome 19 of thehuman apolipoprotein E.Cene,J Biol Chem,1985,260:6240-6247
16. Day JR,Albers JJ,GilbertTL,et al Purification and molecular cloning of human apolipoprotein F.BiochoimBiophgys Res Commun,1994,203:1146-1151
17. Steinkasser A,EstallerC,Weiss EH,et al Complete nucleotide and deduced amion acid sequence of human humanβ2-glycoprotein I.Biochem J,1991,227:387
18.De Silva HV,Harmony JAK,StuartWD,et al Apolipoprotein J:struture and tissue distrbutionBiochem,1990,29:5380-5389
19.Kao FT,Chan L.Ghromosomal finemapping of apolipoprotein genes in the human genome by somatic cell hybridsMethods Enzymol,1986,128:851-863
20.Harper ME,Chan L,Chromosomalfine mapping of apolipoprotein genes by in situmucleic acid hybridization tometaphase chromosomes Metthods Enzymol,1986,128:863-786
21. Karathanasis SK .Apolipoproteinmutligene family and tandem organization of human apolipoprtein A-I,C-Ⅲ and A-Ⅳgenes .Proc Natl Acad Sci USA,1985,82:6374-6378
22.Lusis AJ,Heinzmann C,SparkesRS,et al.Regional mappoing of human chromosome 19:organization of genes forplasma lipid transport(APOC1,-C2,and-E and LDLR)and the genes C3,PEPD,andGPI.Proc Nat Acad Sci USA ,1986,83:3929-3933
23. Spardes RS.Winokur S,LusisAJ,et al Regional assignment of the apolipoprotein A I gene by in situhybridization to human chromosome iiq-qter.Cytogenet Cell Genet,1987,46:697
24 .Middleton-Price HR,VandenBerghe JA,Scott J,et al.Regional chromosomal localisation of ApoAⅡ tolq21-lq23.Hum Genet,1988,79:283-285
25. Law SW,Lee N,Monge JC et alHuman ApoB100 gene resides in the P23→pter region of chromosome 2.BiochimBiophys Res Commun,1985,131:1003-1012
26. Olaisen B,TeisbergP,Gedde-Dahl T,et al. The apolipoprotein E(ApoE)locus on human chromosome19.Cytogenet Cell Genet,1984,37:559
27. Steindasserer A,CockbarnDJ,Black DM,et al.Assignment of apolipoprtoein H(ApoH:beta-2glycoprotein I)tohuman chromososme 17q23→qter;determination of the major expression siteCytogenet Cell Genet .1992,60:31-33
28. Fink TM.Zimmer M.Tschopp J,etal Human chusterin(CLI)maps to 8p21 in proximity to the lipoproteinlipase(LPL)gene.Genomics,1993,16:526-528
29. Walden CC,HegeleRA.Apolipoprotein E in Hyperlipdemia Am Intem Med,1994,120:1026-1036
30.Kane JP,Havi RJ.Disorders ofthe biogenesis and secretion of lipoproteins containing the B apoliprproteinsIn:The metabolic and molecular bases of inherited disease edsScriver,C,R,Bearder AL,Sly W S,and Valle D,7thedition,Voll,1995,1583-1885,McGraw-Hill,Inc, New York,U.S.A
31.Brom MS,Goldstein JL,Areceptor-mediated pathway for cholesterol homeostasis ,Science,1986,232:34-47
32. Soria LF,Ludwig EH,ClarkeHRG,et al.Association between a specific apolipoprtein B mutation and familialdefective apolipoprotein B-100,Proc Natl Acad Sci USA,1989,86:587-591
33. Hegele RA,Huang LS,HerbertPN,et al Apolipoprotein B gene DNA polymorphipms associated with myocardialinfarction .N Engl j Med,1986,315:1509-1515
34.a.Visvik S,Cambou JP,ArveilerD et al.Apolipoprotein b signal peptide poly morphism in patients with myocardial infartions and controls, Hum Genet,1993,90:561-565
35.b.Kammerer CM,VandebergJL,Haffner SM,et al Apolipoprotein B(ApoB)signal peptide length polymorphismsare associated with ApoB.low density lipoprotein cholesterol and glucose levelsin mexican Americans.Atherosclerosis,1996,120:37-45
36.Kinjff PD,Van den MaagdenbergAMJM,Frants RR.et al Genetic heterogeneity of apolipoprotein Eand its influence on plasmea lipid and lipoprotein levels Hum Mutation,1994,4:178-194
37. Mahley RW,Stanley CrallJr,TypeⅢhyperlipoproteinemia(Dysbetalipoproteinemia)The role of apolipoproteinEin normal and abnormal ilpoprotein metabolism In:The metabolic and molecularbases of intherited disease,7thed eds Scriver C.R,Beaudet A L,Sly W S,and ValleD Vol Ⅱ,pp1953-1980,McGraw-Hill,Inc,New Your,1995
38.Rose AD Apolipoprotein Ealleles as risk factors in alzheimers disease .Am Rev Med ,1996,47:387-400
39.Utermann G,Menzel HJ,KraftHG,et al Lp(a) glycoprotein phenotypes ,Inheritance and relation toLp(a)lipoprotein concentrations in plasma.Jclin Invest.1987.80:458-465
40.Utermann G.Lipoprotein(a)In:The metabolic and molecular bases of inherited disease.7th ed ,Vol.Ⅱ,eds.Scriver C R.Beandet A L.Sly W.S,Valle,D.pp1887-1912,McGraw-Hill,Inc,NewYour,1995
41.Scanu AM,EdelsteinC.Kringle-dependent structural and functional polymorphism ofapolipoprotein(a).Biochim Biophys Acta,1995,1256:1-12
42. Mooser V,Mancini FP,Bopp S etal Sequence polymorphisms in the Apo(a)gene associated with specific levels ofLp(a)in plasma.Hum Mol Genet,1995,209:372-378
43.Ichinose A,KuriyamaM.Detection of polymorphisms in the 5’flanding region of the Gene forapolipoprotein(a),Biochim biophys Res Commam,1995,209:372-378
44. Breslow JL Apoipoproteingenes and atherosclerosis.Clin Investig,1992,70:377-384
45.Von eckardstein A,FunkeH.Walter M,et al.Structural analysis of human apolipoprotein AI variants JbiolChem,1990,265:8610-8617
46.Talmud PJ,Ye S.HumphriesSE,Polymorphism in the promotor region of the apolipoprotein AI gene associatedwith differences in apolipoprotein AI levels:The European AtherosclerosisResearch Study.Genet Epidemiol,1994,11:265-80
47.Saha N,Tay JS,Low PS,et alGuanidine to adenine(G/A)substitution in the promoter region of theapoliprotein AI gene is associated with elevated aerum apolipoprotein AI levelsin Chinese non-smoders Genet Epikemiol,1994,11:255-64
48.Wang XL.Badenhop R,HumphreyKE,et al.New Mspl polymorphism at +83 BP of the human apolipoprotein AIgene-Association with increased circulating high density lipoprotein cholesterollevels.Genet Epidemid,1996,13:1-10
49.Humphries SE.DNA polymorphismsof the apolipoprotein genes-their use in the investigation of the geneticcomponent of hyperlipidaemia and atherosclerosis.Atherosclerosis,1988,72:89-108
50.Dallinga-Thie GM,Bu XD,TripMV,LS,et al.Apolipoprotein A-Ⅰ/CⅢ/A-Ⅳgene cluster in familial combinedhyperlipidemia:effects on LDL-cholesterol and LDL-cholesterol andapoplipoproteins B and CⅢ,J Lipid Res,1996,37:136-147
51.Klasen EC,Talmud PJ,HavekesL,et al.A common restriction fragment length polymorphism of the humanapolipoprotein E gene and its relationship to type Ⅲ hyperlipidaemia HumGenet,1987,75:244-247
52.Deeb SS,Takata K,Peng RL,et alA splice-uunction mutation responsible for familial apolipoprotein A-Ⅱdeficiency Am J Hum genet,1990,46:822-827
53.Zaiou M,Visvidis S,GueguenR,et al DNA polymorphisms of human apolipoprotein A-Ⅲ gene frequency andeffects on lipid,lipoprotein and apolipoprtein lkevels in a French populationClin Genet.1994,46:248-254
54. Kamboh MI,Crawford MH,AstonCE Population distributions of ApoE,ApoH,and ApoaⅣ poly morphisms and theirrelationships with quantetative plasma lipid levels among the Evenki herders ofSiberia .Hum Biol,1996,68:231-243
55.Brunzell JD.Familialilpoprotein lipase deficiency and other carses of the chylomicronemia syndrome.In:Themetabolic and molemlar bases of inherited disease.7th ed ,Vol Ⅱ,edsScriver C R,Beandet A L,Sly W S,Valle D,pp1913-1932,McGraw-Hill,Inc,NewYourk,1995
56.Beheshti I,Hanson NQ,CopelandKB,et al. Single strand conformational polymorphisms(SSCP):Studies of thegenetic polymorphisms of exon4of apolipoprotein CⅢ,Clin Biochem,1995,28:303-307
57.li WW,Dammerman MM.Smith JD,etal Common genetic varation in the promotor of the human ApoCⅢ gene abolishesregulation by insulin and may contrbute to hypertriglyceridemia.J ClinInvest,1995,96:2601-2605
58.Vijayaraghavan S,HitmanGA,Kopelman PG,Apolipoprotein-d polymorphism:A genetic marker for obesity andhyperinsulinemia.J Clin Endocrinol Metab,1994,79:568-570
59.Roberts SB,Greenberg AS Thenew obesity genes .Nutrition Reviews ,1996,54:41-49
60.Steindasserer A,DornerC.Wurzner Ret al.Human β-glcoprotein Ⅰ:molecular analysis of DNA and amino acidpolymorphism.Hum Genet,1993,91:402-402
61.Kamboh MI,HarmoryJAK.Sepehrnia B,et al Genetic studies of human apolipoproteins XX.Geneticpolymorphism of apolipoprtein J and its impact on quantitative lipid traits innormolipidemic subjects Am J Hum Genet,1991,49:1167-1173
第五章 脂类代谢有关酶类
参与脂质代谢的酶有许多种,其中关键酶有LPL、HTGL、ACAT、HMGCoA还原酶,HMGCoA合成酶。
第一节 脂蛋白脂肪酶
脂蛋白脂肪酶(liportein lipase, LPL)是脂肪细胞、心肌细胞、骨骼肌细胞,乳腺细胞以及巨噬细胞等实质细胞合成和分泌的一种糖蛋白,分子量为60kD,含3%~8%碳水化合物。活性LPL以同源二聚体形式存在,通过静电引力与毛细血管内皮细胞表面的多聚糖结合,肝素可以促进此结合形式的LPL释放入血,并可提高其活性。LPL生理功能是催化CM和VLDL核心的TG分解为脂肪酸和单酸甘油酯,以供组织氧化供能和贮存;LPL还参与VLDL和HDL之间的载脂蛋白和磷脂的转换,ApoC-Ⅱ为其必需的辅因子,其中的C端第61~79位氨基酸具有激活LPL的能力。
一、LPL结构与合成
比较不同种类包括人类脂肪组织、牛乳腺、鼠巨噬细胞、猪脂肪组织和禽类的LPL一级结构,发现人类LPL氨基酸序列与哺乳类动物有87%~94%同源性,与禽类比较也有70%同源性,表明LPL在进化过程中的高度保守性。人类LPL、肝脂酶(HL)以及胰脂酶(PL)具有高度相似的氨基酸序列,推测三者可能起源于同一个基因家族,具有共同的作用机制。
目前人类LPL二级结构尚未阐明,推测LPL分子可能由两个结构区域构成:N端区的和C端区,N端区包括1~315位氨基酸,形成一个以β折叠为主的近球形结构,它是LPL重要的功能区,催化活性中心就位于此区。构成LPL催化活性中心的三个氨基酸分别为Ser132、His241和Asp156,用中性氨基酸取代活性中心附近的氨基酸,LPL活性明显下降或消失。Asn43是N端区一重要的糖基化位点,它起着维持LPL正常三维结构的作用。对正常分泌的LPL活性功能具有重要意义。此外,N端区第279~282位和292~309位氨基酸介导LPL与肝素结构。C端区呈一个折叠的柱状连接在球形的N端区,C端区的功能尚有争议,多数认为与介导酶与底物接触,形成活性的LPL同源二聚体以及间接参与酶解过程。
LPL在实质细胞的粗面内质网合成,新合成的LPL留在核周围内质网,属于无活性酶,由mRNA翻译合成的无活性LPL,称为酶前体,再糖基化后,才转化成活性LPL酶,如图5-1所示。从细胞中如何分泌;目前认为有两种机制,其一是细胞合成的LPL后直接分泌,不贮存于细胞内,即称为基本型分泌;其二是调节型分泌,某些细胞新合成LPL贮存于分泌管内,一旦细胞受到一个合适的促分泌剌激。LDL即分泌,此时分泌往往大于合成。所有细胞都具备基本型分泌,只有少部分细胞兼有两种分泌形式。Vannier提出,LPL是结合在插入细胞内分泌器并存在于细胞膜外表面的硫酸肝素糖蛋白(heparin sulphate protoglycans, HSPG),致使酶保持一种无活力的浓缩状态,然后通过一个尚未阐明的机制由肝素促使分泌,即肝素后血浆中得到活化的LPL,分布在含甘油三酯的脂蛋白中,并主要是分解CM和VLDL的甘油三酯并结合附着在这些脂蛋白残粒中,可能形成肝摄取这些颗粒的信号。
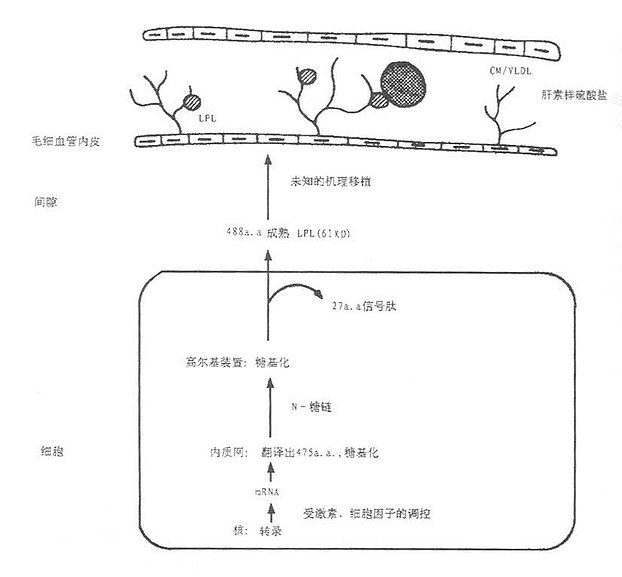
图5-1 LPL的合成
二、LPL基因及其多态性
LPL基因位于8P22,长约35kb,由10个外显子和9个内含子组成,编码475个氨基酸的蛋白质,包括27个氨基酸残基的信号肽。现已查明外显子1长273kp,编码5端非翻译区和信号肽区。外显子2~5长度分别为161、180、112和234bp,其中外显子2所编码的Asn43糖基化位点为LPL催化活性必需的,外显子4编码脂质结合区。外显子6包含243bp。编码肝素结合区。外显子7~9长度分别为121、183和105bp。编码结构参与与ApoCⅡ结合。外显子10是LPL基因中最大的外显子,长1950bp,编码整个3端非翻译区。LPL内含子7第序列尚未弄清,报道其中存在Alu重复序列和多态位点。Jurke等研究发现LPL内含子7中有一完整的Alu序列,长282bp,位于内含子7第1027~746位。Delin报道内含子6中也存在Alu序列。Alu序列在人类基因组中约占3%-6%,推测其功能与基因转录的调节,hnRNA的加工以及DNA复制的启动有关,并且是基因重排的热点位置。利用限制性片段长度多态性(RFLPS)技术检测出LPL基因位点存在多态性,主要分布在LPL基因内含子和侧翼序列中,其中内含子6中的PvuⅡ多态位点(图5-2)和内含子8中的HindⅢ(图5-3)多态位点与高脂血症有关,这为高脂血症的家系连锁分析提供遗传标记。LPL基因转录起始点上游730bp区域是转录因子结合部位,5侧翼区一27位有“TATA”框,是LPL基因启动子所在部位。
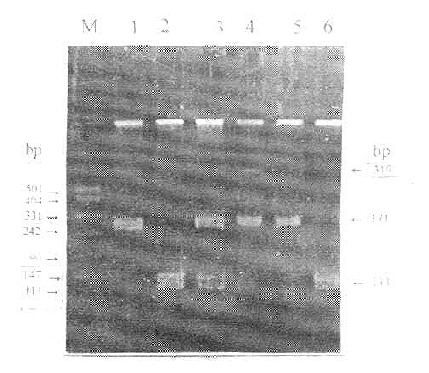
图5-2 LPLPvuⅡ-RFLP
M:DNA marder
1:DNA-PCR产物(319bp)
2-6:分别为P+P+、P+P-、P+P-、P-P-、P--、P+P+、H+H+基因型
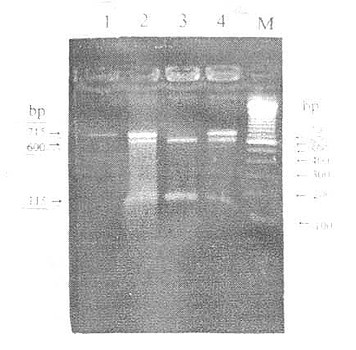
图5-3 LPL HindⅢ-RFLP
M:DNA marker
1~4:分别为H-H-、H-H+、H+H+、H+H-基因型
三、LPL与Ⅰ型高脂血症
Ⅰ型高脂血症为常染色体隐性遗传病,具有家族性。主要临床症状为阵发性腹痛,疹状皮肤黄色瘤和肝脾肿大,生化特征为含高甘油三酯的乳糜微粒在因浆中大量堆积,脂肪耐量显着异常,LPL活性下降,这种患者体内的LPL含量可能完全缺陷,用目前的检测方法测不出LPL存在,也不可能在肝素注射后使血浆LPL活性下降,推测可能是一种异常LPL翻译后修饰所致。
引起Ⅰ型高脂血症常见的LPL基因突变有三类:一是碱基置换突变。按性质又可分为错义突变和无意义突变,错义突变是指基因结构中某个碱基为另一个碱基取代,导致蛋白质分子中相应位置氨基酸改变,这类突变多集中在LPL活性中心所在的N端区,如Gly142、Ala176、Gly188、IIe194、Leu207、Arg243等,这些氨基酸被取代则LPL活性显著降低;无意义突变是指基因编码区发生突变后形成终止密码子,使翻译过程提前终止;导致合成肽链变短,Ⅰ型高脂血症发生与此类突变位点有关,若突变位点在第106位氨基酸的编码基因上,产生出来的短肽链产物不具有LPL催化功能,导致Ⅰ型高脂血症发生;突变位点在第447位氨基酸的编码基因(Ser447-Thr),其产物C端缺失2个氨基酸,不影响LPL活性:二是移码突变。是指在DNA分子中插入或缺失一个或几个核苷酸(但不是3个或3的倍数)造成这一位置以后的一列编码发生移位错误的突变,这种突变有的会生成终止密码而使翻译过程提前终止。有报道1例Ⅰ型高脂血症患者,其G916位碱基发生缺失,产生一个提前终止码,利用Northern印迹技术未检测到可测水平的LPLmRNA,推测此移码突变可能导致LPLmRNA稳定性下降;三是基因重排。表现为大片段缺失或插入,目前发现外显子6中2kb插入,外显子9中3kb缺失,均导致I型高脂血症。
近年研究发现,1例Ⅰ型高脂血症患者脂肪组织中存在正常活性的LPL,肝素后的血浆中检测不出LPL存在,分析其脂肪组织中LPL化学组成,发现这种LPL的寡糖链含有较高水平的果糖,影响了LPL细胞内外的转运,提示翻译后的修饰异常也可影响LPL活性发挥。
脂蛋白脂肪酶基因突变点如表5-1所示。
表5-1 脂蛋白脂肪酶基因突变
| 突变点 | 位 置 | 氨基酸异常 |
| (1)剪接突变 | ||
| GT→AT | 内含子2 | 异常的mRNA生成 |
| AG→AA | 内含子2 | 异常的mRNA生成 |
| (2)错义突变 | ||
| T→C | 外显子3 | Trp96→Arg |
| A→G | 外显子4 | His136→Arg |
| G→A | 外显子4 | Gly142→Clu |
| A→G | 外显子5 | Asp156→Gly |
| G→A | 外显子5 | Asp156→Asn |
| C→G | 外显子5 | Ala157→Arg |
| G→A | 外显子5 | Gly176→Thr |
| G→A | 外显子5 | Gly186→Glu |
| T→C | 外显子5 | Ile194→Thr |
| C→G | 外显子5 | Asp204→Glu |
| C→T | 外显子5 | Pro207→Leu |
| T→A | 外显子5 | Cys216→Ser |
| G→A | 外显子6 | Arg242→His |
| T→A | 外显子6 | Ser244→Thr |
| G→A | 外显子6 | Asp250→Asn |
| T→C | 外显子6 | Tyr252→His |
| (3)无义突变 | ||
| T→A | 外显子3 | Tyr61→Stop |
| C→T | 外显子3 | Gln165→Stop |
| C→(A/G) | 外显子6 | Tyr282→Stop |
| G→A | 外显子6 | Trp282→Stop |
| (4)插入 | ||
| 2kb插入 | 内含子6 | 无效等位基因 |
| 5kb插入 | 外显子3 | 外显子4的stop |
| (5)缺失 | ||
| 6kb的缺失 | 内含子2~5 | 无效等位基因 |
| 1bp的缺失 | 外显子5 | 外显子5的stop |
第二节 肝脂酶
Hahn最早观察到,对患高脂血病的狗进行静脉注射肝素,即引起患狗混浊的血浆变清,这是由于一种具有脂解活性的酶从组织的肝素结合位点上释放到血液中所致。据此推测,这种脂酶是结合在细胞表面作为肝素受体的蛋白多糖,肝素竞争性地结合到细胞表面的蛋白多糖分子后。脂酶被置换下来进入血液中,把引起血浆混浊的酯类物质水解,于是血浆由混浊而变清。后来通过Sepharose-肝素亲和柱层析纯化,可从人的注射肝素后的血浆中得到两种不同的脂酶,一种被0.6~0.8mol/l NaCl液洗脱,不被高离子强度溶液抑制,不需要血浆辅助因子活化,肝脏切除动物的肝素灌注血浆中则不存在,因此,将此酶称之为肝脂酶(hepatic lipase,HL),此酶与早年Hahn观察到的脂酶是一致的。另一种被1.2~1.5mol/l NaCl液洗脱的部分则具有LPL的性质。
肝脂酶 (hepatic endothelail lipase, HL或HTGL)是肝素化血浆中存在的另一种脂酶,属于与血液循环中内源性TG代谢有关的酶之一。与LPL在功能上有相似之处,然而却是两种不同性质的酶,其特点是:①HL活性不需要ApoC-Ⅱ作为激活剂;②SDS可抑制HL活性,而不受高盐及鱼精蛋白抑制;③主要作用于小颗粒脂蛋白,如VLDL残粒,HDL同时又调节胆固醇从周围组织转运到肝,使肝内的VLDL转化为LDL。经人及鼠cDNA克隆的DNA序列探明HLcDNA编码。HL是共有2个N连接多聚糖链的糖蛋白,含有499个氨基酸残基,分子量53kDa,基因位于第15号染色体上,有合成氨基酸残基信号肽和476氨基酸残基的成熟肽的密码。与分解代谢有关的丝氨酸位于145位。LPL和HL的基因同属一组基因族,在进化上较为保守。HL、LPL和胰脂酶(pancereaticlipase,PL)的性质有相似之处,也有不同点,如表5-2所示。
表5-2 LPL、HL和PL的异同点
| LPL | HL | PL | |
| 底物 | CM、VLDL中的TG | CM、VLDL代谢残粒和HDL的TG和磷脂 | 胆汁酸乳化液中的TG |
| 辅因子 | 血浆辅因子 | 不需要 | 辅脂肪酶 |
| 合成部位 | 脂肪组织、心肌和肌肉 | 肝脏 | 胰腺 |
| 定位 | 脂肪组织、心脏、肌肉血管的内皮细胞 | 肾脏、肾上腺和卵巢血管的内皮细胞 | 肠 |
HL是肝实质细胞中合成,在合成过程中,酶蛋白的糖化及紧随着的低聚糖化修饰过程是分泌HL必要条件。免疫电镜观察到HL位于肝窦状隙内皮细胞表面,在肝素化后,HL可释放到血浆,激素可调节HL的释放,主要是类固醇激素,如雄性激素可升高HL酶活性,而雌性激素则相反。当怀孕或泌乳时,肝素后血浆中HL活力与血浆的游离胆固醇或类固醇呈负相关,肾上腺素抑制HL酶活性,另外胰岛素和甲状腺素在控制HL活力也亦有作用。
第三节 卵磷脂胆固醇酯酰转移酶
卵磷脂胆固醇酯酰转移酶(lecihin:cholesterolacyl transferase,LCAT)由肝脏合成释放入血液中,是一种在血浆中起催化作用的酶,其作用是将HDL的卵磷脂的C2位不饱和脂肪酸转移给游离胆固醇,生成溶血卵磷脂和胆固醇脂。血浆胆固醇中几乎70%~80%是胆固醇酯,均是LCAT催化生成所致。LACT常与HDL结合在一起,在HDL颗粒表面活性很高并起催化作用,对VLDL和LDL的颗粒几乎不起作用。在人工基质中添加ApoA-Ⅰ,促使LCAT的活性升高。LCAT在磷脂代谢中起重要的作用。
LCAT由416个氨基酸组成。分子量为6.3kDa,属糖蛋白。糖蛋白,糖链约占24%,是维持其活性必不可少的组分。富含Glu、Gly、Pro和Leu。每一酶分子含Cys,其中两个连成二硫键。根据与胰脂酶序列的同源性比较,推测六肽:I178-G-J-S-L-G183可能是酶的活性中心。LCAT中蛋白质α螺旋、β-折叠和其他的结构分别占21%、24%和55%。LCAt mRNA约为1400bp组成,其信号肽是440个氨酸组成的密码子。
LCAT由肝脏合成并分泌至血浆,以游离或与脂蛋白结合的形式存在。LCAT选择性底物是HDL,特别是新生盘状或小球形HDL3。HDL核心是LCAT酶反应产物胆固醇的贮存库,并通过胆固醇酯转移蛋白将CE转移至其他脂蛋白和细胞膜,并与其交换。
LCAT除细胞合成外,在小肠、脾、胰、胎盘、肾上腺等组织发现有LCAT的mRNA,推测也可合成LCAT。LCAT基因定位于16q22。全长约4600kb,由6个内函子组成。
第四节 HMGCoA还原酶
HMGCoA还原酶(HMGCoa reductase)是胆固醇合成的限速酶,存在于小胞体膜,催化合成甲基二羟戊酸(mevalonic acid),并生成体内多种代谢产物,称之为甲基二羟戊酸途径。细胞内胆固醇水平调节主要信赖于内因性胆固醇合成途径和LDL受体摄取细胞外胆固醇的外因途径两条。Goldstein ,Brown阐明其抑制机制认为,细胞内ch作为HMGCoA还原酶抑制剂使其活性降低,肝细胞膜上的LDL受体增加,从血中摄取ch增加,使血中胆固醇水平降低,设想HMGCoA还原酶活性降低的药物可使血中胆固醇水平下降,尤其是对FH的杂合子患者,LDL受体数锐减者可起治疗作用。
Kovanen等报导以merinolin的HMGCoA还原酶抑制剂投入,使狗血中LDL消失速度上升,LDL产生速度下降,肝移植的小儿FH纯合子患者,用梅维诺林治疗可使LDL胆固醇降低40%,而LDL产生速度下降35%,LDL合成减少的机制,有两种可能,一是胆固醇合成减少使VLDL生成量降低;第二是HMGCoA还原酶抑制剂使VLDL残粒或βVLDL异化增加,转变成LDL减少,体外实验也证实,从VLDL残粒到LDL的速度比正常状态下小20倍,与此同时LDL受体的亲和力也增加。
仓鼠HMGCoA还原酶基因长30kb,由20个外显子组成,在启动子5端富含GC碱基。HMGCoA还原酶,从转录水平作为胆固醇代谢的调节点,与LDL受体基因启动子,HMGCoA合成酶,从转录调节域存在有相同的碱基系列,即CACCCC(或GT)AC的胆固醇调节元件(sterol regulatory element,SRE)存在,如图5-5所示。
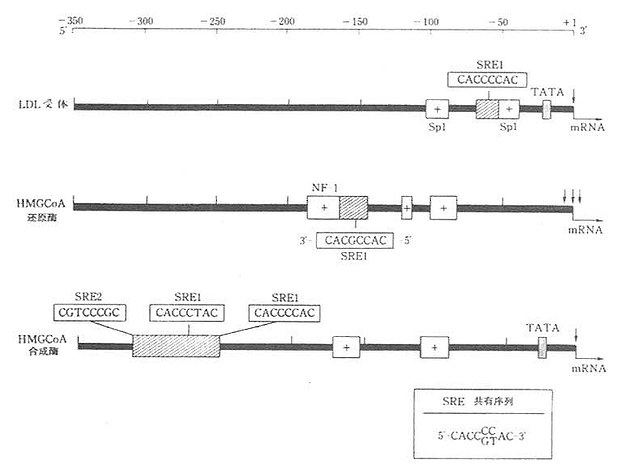
图5-5 胆固醇代谢调节的启动子与SRE
第一条线的数字为从转录开始的距离(碱基对数)
(董学梅)
(脂类代谢有关酶类)参考文献
1.杨振华,酶的测定,见:叶应妩,李健斋,王玉琛主编。临床实验诊断学,北京:人民卫生出版社,1991,588~466
2.Paltarf F,Wagner E,Stereospecificity of Lipaseenzymatic hydrolyosis of enantiomeric aldyldiacyl and dialdylacylglyerols bylipoprotein lipase.Biochim Biophys Acta,1976,431:359-362
3.DeebSS.Peng R.Structure of the human lipoprotein lipase gene.Biochemistry,1989,1169:582-4134
4.GotodaT,et al.Anewly identified null allelic mutation in the human lipoproteinlipase(LPL)gene of a compornd heterozygote with familial LPLdeficienacy,Biochys Acta,1992,1169:582-586
5.OkabeT,Yorifaji H,et al .Pulmonary macrophage:Amajor source of lipoprtein lipase inthe lung.Biochim Biophys Res Commun,1984,125:273-278
6.OkaK,George T,Stocks J,et al.Nucleotide sequence of PvuⅡpoolymorphic site at the humanlipoprotein lipase gene locus .Nuceic Acids Research,1990,18:5407-5411
7.ChuatJ,Raisonnier A,Etienne J,et al.The lipoprotein lipase-encodigng humangene:sequence from intron-6 to intron-9 and presence in intron-7 of a40-million-year-old Alu sequence.Gene,1992,110:257-261
8.GotodaT,Yamada N,Murase T,et al .Detection of three separate DNA polymorphisms in thehuman lipoprotein lipase gene by gene amplfication and restriction endonucleasedigestion.J Lipid Res,1992,33:1067-1072
9.RajK,Edward W,Ruth M,et al .DNA variants at the LPLgene locus associate withangiographically defined severity of atherosclerosis and serum lipoproteinlevels in a welsh poprlation.Arteriosclerosis and Thrombosis,1994,14:1090-1097
10.RobertA,Andrew J,Liling T,et al .Agene-gender interaction affecting plasmalipoproteins in a genetic isoalate,Arteriosclerosis andThrombosis,1994,14671-677
11.YangC,et al.Lecithin:cholesterol acyltransferase.J Biol Chem,1987,262:3086-3091
12.Alberts J,Adolphson J,Chen C,et al.Radiommunoassay of human plasma lecithincholesterol acyltransferase.J Clin Invest,1981,67:141-148
13.McleanJ et al .Cloning and expression of human lecithin cholesterol transferase cDNA,Proc Natl Acad Sci USA ,1986,83:2335-2339
14.Glomset.J.Norum K,Gjone E,et al.Lecithin:cholesterol acyltransferase deficiency.In:TheMetabolic Basis of Inherited Disease.McGraw Hill ,New Youk,1983,643-654
15.GlomsetJ.The plama lecithin cholesterol acyltransferase reaction.J LipidRes,1968,9:156-167
16.HolmqusitZ,Carlson L.Normalization of high density lipoprotein in fish eye diseaseplasma by purified normal human lecithin cholesterol acyltransferase .Lipids,1988,23:225-229
17.ZilversmitD B.Atherogenic nature of triglycerides .postprandial lipidemia andtriglyceride-rich remnant.Clin Chem,1995,41:153-158
18.TakagiA, et al.Molecular strdies on primary lipoprotein lipase(LPL)deficiency:onebase deltion (G916)in exon 5 of LPL gene causes no detectable LPL protein dueto the absence of LPLmessenger RNA transcript.Jclin Invest,1992,41:153-158
19.JingamiR,Brown M,Goldstein J,et al .Partial deletion of membrane-bound domain of3-hydroxy-3methylglu-taryl coenzyme a reductase eliminates sterol enhanceddegradation and prevents formation of crystalloid endoplasmic reticulum,JcellBiol,1987,104:1693
20.GoldsteirJ,Brown M,Regulation of the mevalonate pathway.Nature ,1990,343:425-430
21.EastC,Grundy S,Bilheimer D,et al.Preliminary report:Treatment of ytpe 3hyperlipidemia with mevinolin.Metabolism,1986,35:97098-,104:1693
22.阵上久人,HMGCoa Reductaseとそのinhibiter .最新医学,1992,47:82-90
第六章 脂蛋白受体
脂类在血液中以脂蛋白形式进行运送。并可与细胞膜上存在的特异受体相结合,摄取进入细胞内进行代谢。迄今为止,报道的受体已有很多种,研究最详细的是LDL受体,其次是清道夫受体,再就是VLDL受体,这三种受体的氨基酸序列。构象及与配体的结合部位都已阐明,并且已成功地得到cDNA。Brown和Goldstein于1974年研究家族性高胆固醇血症(familial hypercholesterolemia,FH)患者代谢缺陷时,在成纤维细胞膜上发现了LDL受体(LDl receptor,LDL-R)的存在。以后相继发现有VLDL受体和清道夫受体。脂蛋白受体在决定脂类代谢途径、参与脂类代谢,调节血浆脂蛋白水平等方面起着重要的作用。脂蛋白受体的发现,是脂类代谢研究的里程碑,推动了脂蛋白、载脂蛋白的深入研究。
第一节 低密度脂蛋白受体
Schneider等于1982年从牛肾上腺分离出LDL受体,以后又分离出编码牛LDL受体羧基末端1/3氨基酸的cDNA,并初步阐明了牛LDL受体cDNA,推导出人LDL受体的氨基酸序列。
一、LDL受体结构
LDL受体是一种多机能蛋白,由836个氨基酸组成的36面体结构蛋白,分子量约115kD。由五种不同的区域构成(见图6-1),各区域有其独特的功能。
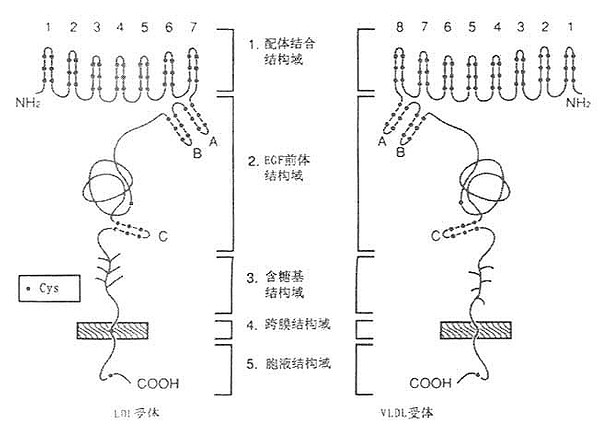
图6-1 LDL受体与VLDL受体结构
1.配体结合结构域配体结合结构域由292个氨基酸残基组成,其中共有47个半胱氨基酸,含有七个由40个氨基酸残基组成的与补体CB、Cq类似的重复序列,每个重复系列中有6个Cys残基,所有42个Cys残基均已构成二硫键,重复序列2、3、6、7是结合LDL所必需的,其中任何一种发生突变,均使受体丧失结合LDL的能力。重复序列5则与结合β-VLDL有关,若该序列突变时,该受体结合β-VLDL的能力丧失60%。该受体不仅能结合LDL,还能结合VLDL、β-VLDL和VLDL残粒;它不仅能识别ApoB100,也可识别ApoE的脂蛋白。ApoE、B100为LDL受体的配体,因此,LDL受体又称为ApoB100,E受体。
2.EGF前体结构域 约由400个氨基酸残基组成的肽段,有5个重复序列,每个重复序列包括25个氨基酸残基。EGF前体结构域与小鼠上皮细胞生长因子(epidermal growth factor,EGF)前躯体有同源性,这一区域因此而得名,Mutagenisis等在体外实验证实,这个区域的肽段,属于细胞膜外结构蛋白,起着支撑作用。
3.含糖基结构域 由58个氨基酸残基组成,是紧靠细胞膜面的肽段,由18个丝氨酸或苏氨酸构成0-连接糖链,对LDL受体起着支撑作用。
4.跨膜结构域 由22个氨基酸残基组成,富含疏水氨基酸残基,属于跨膜蛋白,起着固系于细胞膜中的抛锚作用。这个区域缺陷,影响受体的细胞外分泌。
5.胞液结构域 位于细胞膜的胞浆侧,由50个氨基酸残基组成,C-末端位于胞浆并“深埋”于胞浆之中。
二、LDL受体基因结构
人LDL受体基因长度45kD,由18个外显子和17个内含子组成共长达2535bp。LDL受体基因如图6-2所示。
外显子1编码短的5侧序列及信号肽。内含子1在信号肽远端2个氨基酸处中断编码序列。配体结合域中的7个由40个氨基酸残基组成的重复序列中,第Ⅰ、Ⅱ、Ⅴ、Ⅵ、Ⅶ残基序列均由各自的外显子编码,Ⅲ、Ⅳ和Ⅴ则由同一个外显子编码。
EGF前体结构域由外显子7至14编码其蛋白的290~690氨基酸残基。外显子15则编码LDL受体C末端的50个氨基酸。
LDL受体基因突变时可引起多种遗传疾病,典型遗传病有定族性高胆固醇(FH)。LDL受体基因突变种类包括基因大片段的缺失或插入或仅有1个碱基的改变而导致形成错误或无意义的密码(见图6-2)。
通过基因水平分析,LDL受体基因突变不外乎下列几种类型:①一类是因基因突变使LDL受体蛋白无法检出或其活性丧失,这种突变涉及到mRNA转录水平变异。如外显子1中缺6~10kb或外显子13~15kb缺失4~5kb;②另一类是因突变使分子量为120kD和ECG前驱体结构域抑制通过小胞体进入高尔基氏体的转送作用;③第三种是突变结果使LDL受体的结合LDL的能力降低;④第四种是受体结合LDL后不能内移,这种突变点在外显子16~18kb,即编码跨膜结构域的一段基因。LDL受体的四种级别变异类型如图6-3所示。
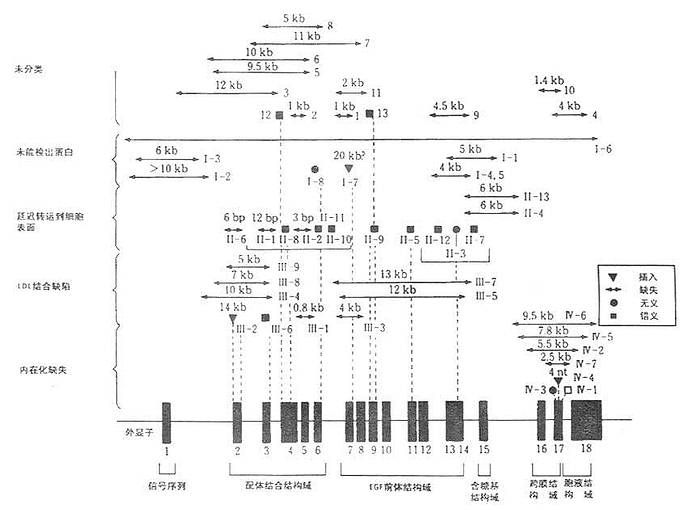
图6-2 LDL受体基因结构及其家族性高胆固醇血症的基因突变和受体蛋白变异
(引自 KajinamiK. Mabuchi H, Michishita I et al.Arteriosclerosis 8.187.1988)
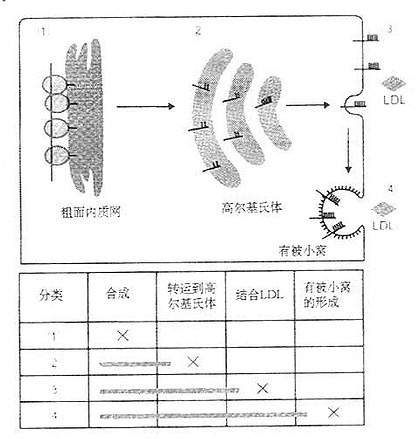
图6-3 LDL受体的生物合成与四种级别的变异类型
(源自Brown MS, et al.1986)
三、LDL受体功能
LDL受体广泛分布于肝脏、动脉壁平滑肌细胞、肾上腺皮质细胞、血管内皮细胞、淋巴细胞、单核细胞、巨噬细胞,各组织或细胞的LDL受体活性差别很大。
含ApoB100的脂蛋白可以与LDL受体以高亲和力结合转运到肝脏,肠道分泌的ApoB48不是LDL受体配体。所以肝脏不能清除完整的CM。
LDL或其他含ApoB100,E的脂蛋白如VLDL、β-VLDL均可与LDL受体结合,内吞入细胞使其获得脂类,主要是胆固醇,这种代谢过程称为LDL受体途径(LDl receptor pathway),该途径依赖于LDL受体介导的细胞膜吞饮作用完成,如图6-3所示。当血浆中LDL与细胞膜上有被区域(coated region)的LDL受体结合(第1步),使其出现有被小窝(coated pit)(第2步),并从膜上分离形成有被小泡(coated vesicles)(第3步),其上的网格蛋白(clathrin)解聚脱落,再结合到膜上(第4步),其内的pH值降低,使受体与LDL解离(第5步),LDL受体重新回到膜上进行下一次循环(第6、7步)。有被小泡与溶酶融合后,LDL经溶酶体酶作用,胆固醇酯水解成游离胆固醇和脂肪酸,甘油三酯水解成脂肪酸,载膜蛋白B100水解成氨基酸,见图6-4。LDL被溶酶体水解形成的游离胆固醇再进入胞浆的代谢库,供细胞膜等膜结构利用。胞内游离胆固醇在调节细胞胆固醇代谢上具有重要作用:若胞内浓度升高,可能出现下述几种情况:①抑制HCGCoA还原酶,以减少自身的胆固醇合成;②抑制LDL受体基因的表达,减少LDL受体的合成,从而减少LDL的摄取,这种LDL受体减少的调节过程称为下调(down regulation);③激活内质网酰基CoA胆固醇酰基转移酶(acyl-Coa cholesterolacyltransferase,ACAT),使游离胆固醇在胞浆内酯化成胆固醇酯贮存,以供细胞的需要。经上述三方面的变化,用以控制细胞内胆固醇含量处于正常动态平衡状态。血浆中胆固醇主要存在于LDL中,而65%~70%的LDL是依赖肝细胞的LDL受体清除。肝脏的LDL受体还影响LDL的合成速率及VLDL代谢。曾经认为人VLDL几乎全部在血循环中转变为LDL,LDL再被肝外组织摄取,现在经大鼠和兔实验研究表明,VLDL仅有15%以下转变为LDL,人则有<50%的VLDL转变为LDL,大部分VLDL是以VLDL或VLDL残粒的形式被肝脏摄取。VLDL残粒与肝脏受体的亲和力比VLDL大很多,VLDL中虽有少量ApoE,因含有丰富的ApoC,可掩盖ApoE,而阻碍其与肝脏的ApoE、E受体结合,因VLDL转变成VLDL残粒时,随着甘油三酯水解而丧失ApoC,暴露出ApoE,因此,VLDL残粒被肝清除的速率比VLDL快。VLDL残粒大部分被肝脏清除,一小部分在肝脂酶作用下水解除去甘油三酯而转变成LDL。LDL受体还在乳糜微粒代谢中起有一定作用。由于乳糜微粒中的ApoB48不能识别ApoB100,E受体。所以肝脏不能清除完整的乳糜微粒。但是血管中乳糜微粒被脂蛋白脂肪酶水解去除其大部分甘油三酯核心后,同时丧失部分ApoC、A,生成乳糜微粒残粒除去了阻碍ApoE与受体结合的因素,故可迅速被肝脏清除。LDL约有一半是通过LDL受体,另一半通过LDL受体相关蛋白进行代谢,其半寿期短,
总之,LDL受体主要功能是通过摄取胆固醇进入细胞内,用于细胞增殖和固醇类激素及胆汁酸盐的合成等。
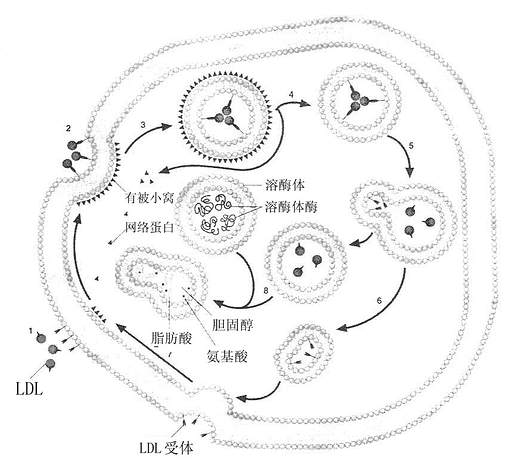
图6-4 LDL受体胞吞作用示意图
第二节 极低密度脂蛋白受体
在ApoB100存在下,LDL受体可结合LDL;在ApoE存在下,既可结合LDL,又可结合VLDL、β-VLDL。与LDL受体不同,还有一种仅与ApoE脂蛋白结合的特异受体存在,据以下临床现象及实验结果推测还有另一种受体的存在:①纯合子FH,患者血中乳糜微粒残粒并不增加;②LDL受体缺陷的WHHL兔乳糜微粒残粒仍正常地被肝脏摄取;③LDL受体下调状态下,乳糜微粒残粒可在肝脏异化,FH的LDL受体缺陷者或WHHL兔巨噬细胞不能利用LDL使其泡沫化,但可利用含ApoE脂蛋白的乳糜微粒残粒及β-VLDL使其泡沫化,所以推测有对ApoE特异结合的第二种受体存在,即极低密度脂蛋白受体(VLDl receptor, VLDL-R)。
利用cDNA单克隆已证明有VLDL受体存在,其结构与LDL受体类似,如图6-1所示。有与LDL受体相同的五部分组成,即配体结合结构域,EGF前体结构域,含糖基结构域、跨膜结构域和胞液结构域。然而并非完全相同,配体结构域,有55%相同性(图6-4);EGF前体结构域有52%的相同性;含糖基结构域仅有19%相同性;跨膜域有32%相同性;胞浆域有46%的相同性,如图6-5、6-6所示。LDL受体对含ApoB100的LDL,含ApoE的VLDL,β-VLDL,VLDL残粒有高亲和性。VLDL受体仅对含ApoE的脂蛋白VLDL,β-VLDL和VLDL残粒有高亲和性结合并摄入细胞内,对LDL则为显著的低亲和性。VLDL受体在能量代谢活跃的心脏、肌肉、脂肪等组织细胞存在,肝脏几乎未发现,这是因为与提供组织脂肪酸机能由LPL单独承担有关。即①LPL分解结合在受体上的VLDL,水解得到的游离脂肪酸扩散通过细胞膜入细胞内,以提高利用率;②VLDL受体与LPL的mRNA有同一组织的特异性;③VLDL受体结合含ApoE的TG脂蛋白能力很强;④LPL缺损者皮下脂肪的蓄积不正常。从这几方面去考虑,VLDL受体对富含TG脂蛋白代谢起有重要作用。人VLDL受体与兔VLDL受体有97%的同源性,同人LDL受体有76%的同源性。已证实它的mRNA在组织中高度表达的结果,对这些组织细胞的脂肪酸代谢功能具有重要的意义,如肌细胞、脂肪细胞、心脏、脑和胎盘细胞等。
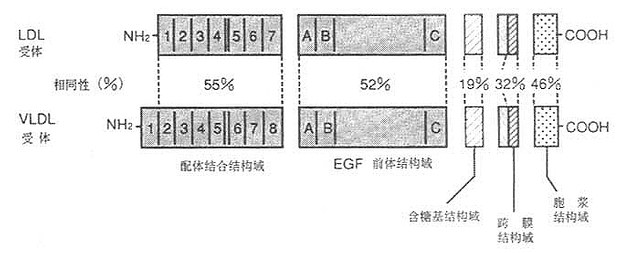
图6-5 LDL受体与VLDL受体基因结构的异同示意图

图6-6 LDL受体与VLDL受体的配体结合结构域及胞液结构域的比较
配体结构域的VLDL受体和LDL受体均保留有SDE(Ser-Asp-Glu)序列,LDL受体有7个突变序列,VLDL受体则有8个重复系列。以胞液结构域比较,LDL受体与VLDL受体均有被小窝信号肽(coated pit signal)的FDNPVY结构,其功能是与配体结合摄取进入细胞内。另外LDL受体胞液结构域,在肝细胞内侧存在向基运输小窝(basipetal translocation pit)的[RNxDxx(S/T)xxS]结构,VLDL受体则无此小窝,如图6-6所示。
LDL受体受细胞内胆固醇负反馈抑制,VLDL受体则不受其负反馈抑制,当VLDL受体的mRNA量成倍增加时,不受LDL乃至β-VLDL的影响。这是因为VLDL的配体关系使β-VLDL的摄取不受限制。这一点,对由单核细胞由来的巨噬细胞的泡沫化在早期动脉粥样硬化的斑块形成中有重要意义。
VLDL受体在脂肪细胞中多见,可能与肥胖成因有关。
第三节 清道夫受体
遗传性的LDL受体缺陷的杂合子是不能摄取LDL的,但动脉粥样硬化斑块的巨噬细胞有从LDL来的胆固醇酯大量蓄积并泡沫化,其原因用LDL受体途径无法解释,因为从这条途径不能摄取对过多的脂质。同时经LDL受体摄入脂类的量是受细胞内胆固醇水平的调节。Brown与Goldstein等使LDL乙酰化,从而导致不受细胞内胆固醇调节的过剩脂质也摄入并出现异常蓄积,进而推测存在一种LDL受体途径以外的脂质摄取途径,使巨噬细胞摄取乙酰化LDL。Brown等人提出这种设想并定名为清道夫受体(scarenger receptor)。以后许多实验证明了这种推测。1984年Heinecke等人在细胞培养液中添加氧化剂使LDL氧化修饰,其结果使巨噬细胞摄取了这种变性LDL。现在认为,人体内脂质过氧化反应导致的变性LDL,可被巨噬细胞无限制地摄人细胞内,这是因为变性LDL上带有各种分子的负电荷而与清道夫受体结合。
一、清道夫受体结构
Komada等于1990年用配体亲和层析和免疫亲和层析,将牛肺巨噬细胞清道夫受体纯化,并由其部分氨基酸序列(见图6-7)克隆得到Ⅰ型、Ⅱ型清道夫受体cDNA,以后相继将人、兔和小鼠的清道夫受体cDNA克隆成功。该受体C-末端为半胱氨酸的为Ⅰ型,具有短肽结构的为Ⅱ型清道夫受体。以三聚体形式存在,分子量为22kD的膜糖蛋白。N末端在细胞膜内侧,C末端在膜外侧存在,是“inside out”型的受体。该受体的Ⅰ、Ⅱ型均由6个区域部分组成,如图6-8所示。
1.N-端胞浆域 由50个氨基酸残基组成,可能与包涵素结合,类似LDL受体结构。其中央部分是磷酸化部位,摄取配体的最重得要的部位。
2.跨膜域(transmembrane) 由第51~76氨基酸残基构成。为疏水性氨基酸组成的单一结构,“抛描”固定于细胞膜上。
3.间隔域 由第77~150氨基酸残基构成。
4.α-螺旋卷曲螺旋域(α-hericalcoiled-coil)由第151~271共121个氨基酸残基组成。在这段蛋白中,其中含糖基结构域中有7个氨基酸残基组成的一含疏水性氨基酸的高氨酸拉链(leucine-zipper-helix)结构或者称为“七联体”,如图6-9所示,这种结构可以多达23个。

图6-7 清道夫受体氨基酸序列比较
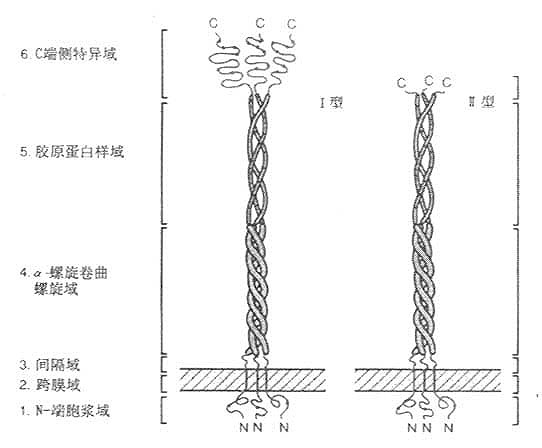
图6-8 清道夫受体结构模式图
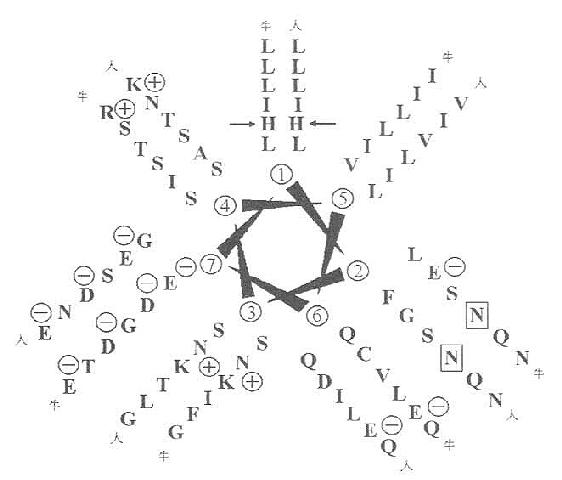
图1-9 清道夫受体的亮氨酸拉链结构
图中为α-螺旋卷曲螺旋域中的螺旋轮示意图(人与牛)
亮氨酸拉链结构的肽段先叠成右手α-螺旋,每一圈含3.5个氨基酸。尔后这些α-螺旋以疏水氨基酸中心构成的平行的三聚体结构。该结构域内,亮氨酸与异亮氨酸残基出现部分对人则是分别为155~203和240~272氨基酸残位置。
5.胶原蛋白样域 属第273-343个氨基酸残基肽段,这种序列与胶原蛋白非常相似,推测这段肽链为右手胶原蛋白样三联体螺旋。
6.C端侧特异域 属第344~453个氨基酸残基肽段,为羧基末端。该段富含半胱氨酸。清道夫受体的8个Cys有6个在此域范围,所以称为清道夫受体富半胱氨酸域(scavenger receptor cystein rich domain like, srcR域)。半胱氨酸的二硫键交联而成的区域非常紧密,牢固,形成球状,足以经受细胞外环境的变动,属于细胞外区域。
srcR域长约430nm,犹如三朵郁金香的“花苞”,有由间隔域到α-螺旋卷曲螺旋域构成的“花茎”为支撑,这一“花茎”约占总长度的52%或胞外部分的62%。Ⅱ型清道夫受体没有srcR域,代之以6个氨基酸残基,所以是“截短”的清道夫受体。但Ⅱ型清道夫受体比Ⅰ型清道夫受体具有高亲和力结合和介导内移修饰LDL作用。
二、清道夫受体配体
清道夫受体配体广泛,有:①乙酰化或氧化LDL等修饰的LDL;②多聚次黄嘌呤核苷酸和多聚鸟嘌呤核苷;③多糖如硫酸右旋糖酐;④某些磷脂,如丝氨酸磷脂,但卵磷脂不是配体;⑤细菌脂多糖,如内毒素等。这样广泛的配体谱的共同特点是多阴离子化合物。Ⅱ型清道夫受体没有srcR域,但仍具有Ⅰ型相同的功能,显然配体结合域不在srcR域,推测其结构域在胶原蛋白样域C末端的22个氨基酸残基作为配体识别位点。是结合多阴离子配体所必需的位点。
三、清道夫受体功能
目前对于清道夫受体的功能还不十分清楚,是人们在研究巨噬细胞转变成泡沫细胞的机制时发现的。近年来大量实验证明LDL可被巨噬细胞、血管内皮细胞和平滑肌细胞氧化成氧化LDL,可通过清道夫受体被巨噬细胞摄取,形成泡沫细胞,氧化LDL还能吸引血单核细胞粘附于血管壁,对内皮细胞有毒性作用等,从而促进粥样斑块形成。这些研究无疑阐明了巨噬细胞的清道夫受体在粥样斑块形成机制中起有重要的作用,另一方面,也推测巨噬细胞通过清道夫受体清除细胞外液中的修饰LDL,尤其是氧化的LDL,是机体的一种防御功能。可清除血管壁过多脂质;清除病菌毒素,摄取内毒素多方面的功能。
清道夫受体分布于胎盘,肝脏、脾脏等网状内皮系统,脑组织也有Ⅰ型和Ⅱ型。
清道夫受体不仅在组织巨噬细胞内发现有,在单核细胞分化由来的巨噬细胞侵入内皮的过程中也见有该受体。兔、大鼠高脂肪膳食模型制作过程中,喂饲高胆固醇开始的的几天见到LDL样粒子附着于血管壁,其后有单核细胞附着于内膜、巨噬细胞导致脂肪线条病巢形成并出现成百成千巨噬细胞簇出现,此时发现有大量的清道夫受体,病灶逐步进入平滑肌细胞内膜,然而其深部巨噬细胞仅有少量残存受体,其量也逐渐减少。当变性LDL显著增加时,清道夫受体摄取的脂质则不受制约,目前认为这是脂质沉积的重要原因,也是动脉粥样硬化发病的重要机制。使LDL变性的主要因素是脂质的过氧化,而何种原因引起脂质过氧的,有待进一步研究。
(周新)
(脂蛋白受体)参考文献
1.刘秉文.脂类代谢Ⅱ:磷脂、胆固醇及血浆脂蛋白代谢.见顾天爵主编,生物化学.北京:人民卫生出版社,1995
2.冯宗忱,低密度脂蛋白受体家族及清道夫受体,见:王克勤主编,脂蛋白与动脉粥样硬化,北京:人民卫生出版社,1995:278-317
3.Hobbs H H,Brown M S,Goldstein JL.et alDeletion of exon encoding cystein-rich repeat of LDL receptor alters itsbinding specificityin subject with familial hypercholesterolemia.J BiolChem,1986,261l:13114-13120
4.BrownM S,Godlstein J L.Binding Comparision of cells from a normal subject and from apatient with homozygous familial hypercholesterolemiaJ.Biol.Chem,1974,249:5153-5162
5.YamamotoT,Davis C G,Brown M S,et al.The human LDl receptor:A cystein-rich proein withmultiple Alusequences in its mRNa .Cell,1984,39:27-38
6.BrownM S,Goldstein J L.A receptor-mediated pathway for cholesterolhomeostasis.Science,1986,232:34-47
7.MulerC.Xanthomata,hypercholesterolemia,angina pectoris Acta Med Scod ,1938,89(suppl):75-84
8.YamamotoT.Bishop R W,Brown M S,et al.Deletion in cystein rich region of LDL receptorimpdees transport to cell sruface in WHHL rabbit .Science,1986,232:1230-1237
9.RussellD W,Lehrman M A,Sudhof T C.et al ,The LDL receptor in familialhypercholesterolemia:Use of human mutations to dissect a membrane protein .ColdSpring Harbor Symp Quant Biol.1987,51:811-819
10.GoldsteinJ L,Brown M S.Reguation fo the mevalonate pathoay .Nature,1990,343:425-430
11.ChenW-J,Goldstein JL.Brown M S.NPXY,a sequence often fornd in cytoplasmic tails ,isrequred for coated pit-mediated internalization of the low density lipoproteinreceptor J Biol Chem,1990,265:3116-3123
12.EsserV,Limbird L E,Brown M S,et al.Mutational analysis of ligand binding domain ofthe low density lipoprotein receptor.Jbiol Chem.1988,263:13282-13290
13.RussdllD W,Brown M,Coldstein J L.Different combinations of cystein rich receptor totwo different proteins.J.Biol.Chem,1989,264:21682-21688
14.WatanabeY.Serial inbreeding of rabbits with herediataryhyapelipidemia(WHHL-rabbit),Incidence and development of atheroclerodisAlow density lipoprotein receptor-like protein with distinct ligand specificity.Proc Natl Acad Sci USA ,1992,89:9252-9256
23.Kita ,T Nagano Y,Yokode M,et al Probucol prevents the progression ofatherosclerosis in Watanabe heritable hyperlipidemic rabbit ,an animal modelfor familial hypercholesterolemia.Proc Natl Acad Sci USA,1987,84:5928-5931
24.Kita T,Brown M,Sbilheimer D W,et al .Delayed clearance of very low density andintemediate density lipoproteins with enhanced conversion to low densitylipprotein in WHHL rabbits Proc Natl Acad Sci USA,1982,79:5963-5997
25.Van Lenten B J,Fogelman A M,Jacdson R L,et al.Receptor-mediated uptade ofremnant lipoproteins by cholesterol-loaded human monocyte-macrophages .J BiolChem,1985,260:8783-8788
26.WillnowT,Goldstein J,Orth K,et al Low density lipoprotein receptor related protein andgp330 bind similar ligands including plasminogen activator-inhibitor complexesand lactoferrin,an inhibitor of chylomicron remnant clearance.J BiolChem,1992,267:2172-26180
27.InabaT,Gotoda T,Shimano H,et al. Platelet-derived growth factor induced c-fms andscavenger receptor genes in vascular smooth cells J BioChem,1992,267:1307-13112
28.Resnicd D,et al The srcR superamily .Trends Biochem Sci,1994,19:5
29.酒井寿郎,山本德男.LDL,VLDL,
30.広濑信羲,小宫山一雄,清水健一郎,他.LDl Recepter-related Proteinの脈硬化巢の发现I.
第七章 脂类代谢有关的特殊蛋白质
脂类代谢过程中的非极性CE和TG以及载脂蛋白,在脂蛋白之间进行转运和交换。这种交换转运是否需要载体,如何转运,各脂蛋白之间的脂质和蛋白又如何达到平衡,早在60年代,人们已开始了饶有兴趣的研究。1968年Akenumz与Glomset等发现血浆中有LCAT能催化HDL上Ch变成CE,转运到CM及VLDL或其他脂蛋白上,并很快达到平衡。其后陆续有多种参与脂蛋白代谢的蛋白质因子被发现。从蛋白质的生物学性质及功能看,这类蛋白因子似乎是酶,但又不具备酶学特征;似乎是受体,也不具备作为受体的特点,这种似酶非酶,是受体非受体的蛋白质,本章只好暂且称其为脂类代谢有关的特殊蛋白质。
第一节 胆固醇酯转移蛋白
早在1975年,Zilvermit等发现兔血浆无脂蛋白部分含有使胆固醇酯转运的特殊蛋白质。Barter等报道兔血浆d>1.21g/ml部分存在有促进脂蛋白和TG交换的蛋白因子,其后从高胆固醇血症兔血浆中分离得到这种活性蛋白,能促使HDL与LDL和VLDL之间进行CE交换,以后的研究中又发现这种质白质与动脉粥样硬化发生密切相关,这种特殊蛋白被之谓胆固醇酯转移蛋白(cholester ester transfer protein, CETP)。
一、CETP结构
CETP又称为脂质转运蛋白(lipid transfer protein, LTP),从血浆d>1.21g/ml组份中精制得到,是由467个氨基酸残基组成的单链多肽,其中非极性氨基酸残基高达45%,是一种疏水性蛋白质,很容易被氧化而失活。CETP由肝脏、小肠、肾上腺、脾脏、脂肪组织及巨噬细胞合成,细胞内成熟蛋白分子量为74000。最近已阐明其结构编码基因存在于第16染色体。与LCAT的基因靠近。CETP基因由16个外显子和15个内含子约20.5kb组成。
二、CETP生理功能
CETP促进各脂蛋白之间脂质的交换和转运。他催化HDL3上的胆固醇酯转运到富含ApoB的脂蛋白VLDL和LDL上,其中的TG经HTGL作用水解,使HDL颗粒缩小,CETP在完成和促进胆固醇逆转运过程中充当重要角色。周围组织细胞膜的游离胆固醇与HDL结合后,被LCAT酯化成胆固醇酯,移入HDL核心,并可通过CETP转移给VLDL,LDL,再被肝脏的LDL及VLDL受体摄取入肝细胞,至此,完成了胆固醇从周围末梢组织细胞经HDL转运到肝细胞的过程,称之为胆固醇的逆转运,如图7-1所示。
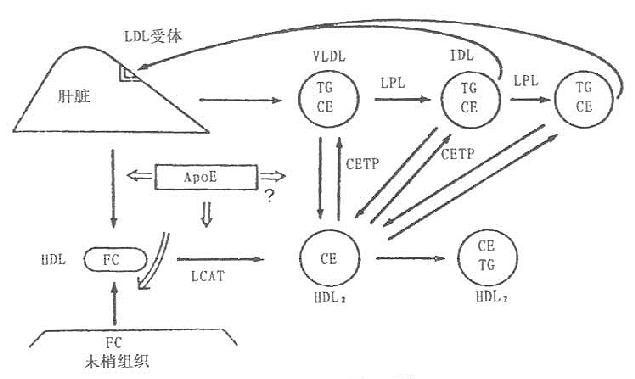
图7-1 胆固醇逆转运系统
目前认为,血浆中各脂蛋白的胆固醇酯主要通过LCAT和CETP的共同作用生成。CETP与LCAT一样也常与HDL结合在一起。
三、CETP缺乏症
血浆中CETP缺乏,HDL中CE蓄积TG降低,无法转运给VLDL及LDL,出现高HDL血症,从而使VLDL、LDL的CE减少及TG增加。这是因为从HDL将CE转运给含ApoB脂蛋白的途径出现障碍所致。利用酶联免疫方法检测血浆中CETP活性,其活性很低。
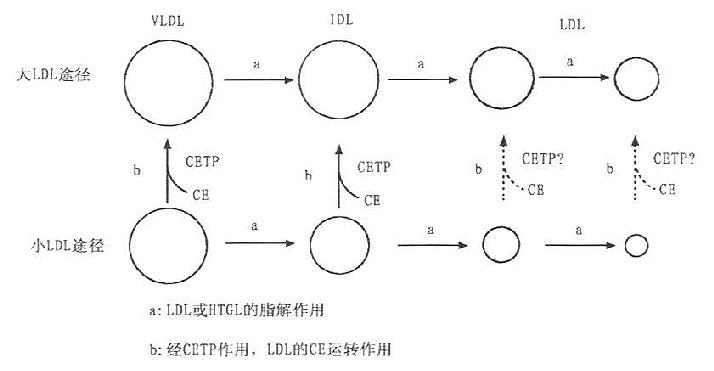
图7-2 LDL形成的两条途径
因CETP的缺陷可引起高HDL血症,其中出现有富含ApoE和CE的类似于HDLc的多相分散LDL(polydisperse LDL)。利用平衡密度梯度超速离心可使这种多相分散LDL显示出16个亚组份。采用聚丙烯酰胺梯度凝胶电泳,血胆固醇水平正常的人LDL仅显示一个单一的区带。若CETP缺乏者,LDL可显示两条区带,其后进一步阐明,这两个区带是属于密度相同,其理化性质有差异的大小两种颗粒的LDL。究其原因,是因为LDL的成熟过程有大LDL和小LDL途径,如图7-5所示。ECTP的作用是促使HDL的CE转运到LDL中,使其形成成熟均一的LDL,CETP是LDL成熟的必]需因素。
利用酶联免疫法测定CETP缺陷者,血清CETP水平低于健康人,其量与HDL-C呈负相关。实验证明,CETP缺陷的纯合子,转运CE的作用完全丧失。经PCR及DNA测序确认,CETP缺陷常在基因内含子14的剪接供体位点上易发生G→A突变。据报道,CETP缺陷者可出现于杂合子,又可出现于纯合子。据此推测,CETP缺陷者可能是一种复合型异型合子(compound heterozygote)。
CETP缺陷是引起高HDL血症的原因,然而血浆中CETP的活性差异很大。血浆CETP活性低的动物,胆固醇负荷实验发现,很易引起动脉粥样硬化,而HDL-C呈高值;CETP活性高的动物进行胆固醇负荷实验发现,也很容易引起动脉粥样硬化,然而HDL-C为低值。这种有趣的现象令人费解。然而最大的可能是,CETP以几种不同的表型发挥着不同的生理功用之故。因此,与其说CETP的某一表型是CE转运蛋白还不如说是致动脉粥样硬化的因子。
总之,CETP缺陷是引起动脉粥样硬化的重要因素之一。
第二节 血清碱性蛋白
高载脂蛋白β脂蛋白血症(hyperapo beta lipoproteinemia ,HyperApoB)属遗传性脂代谢紊乱性疾病,以小而致密的低密度脂蛋白(LDL)微粒升高为主要特征,后者是冠心病的重要危险因素之一。HyperAopB的代谢缺陷为:①肝组织大量合成VLDL,致使小而致密的LDL水平升高;②餐后TG水解延迟,大量游离脂肪酸堆积在血液中。到目前为止,用ApoB基因缺陷或突变无法解释HyperAopB的各种表型,已发现来源于该病患者的脂肪细胞和成纤维细胞对游离脂肪酸的吸收和代谢存在明显障碍。Kwiterovich等正常人血清中分离出三种碱性蛋白质分子(basicproteins,BPs)-BPⅠ(Mr14.0kD,pI9.10),BPⅡ(Mr 27.5kD,pI8.48),BPⅢ(Mr55.0kD,pI8.73),并认为BPⅠ同Cianflone等人分离纯化的酰化作用剌激蛋白(acylation-stimulating protein,ASP)系 同一种蛋白质。同正常人成纤维细胞相比,BPⅠ使HyperApoB患者成纤维细胞合成甘油三酯和胆固醇酯的能力下降约50%,而BPⅡ则明显促进患者成纤维细胞合成胆固醇酯,BPⅢ对这两种不同来源的成纤维细胞的代谢没有影响。然而,与BPⅠ和BPⅡ不同的是,BPⅢ能显著促进正常人单核源性巨噬细胞合成胆固醇酯。BPⅠ和BPⅡ主要通过蛋白激酶C(PKC)和酪氨酸蛋白激酶(TPK)途径传递信息和发挥生物效应。由于BPs与正常人脂质、脂蛋白和游离脂肪酸的代谢以及HyperAopB的病理生理变化密切相关,受到人们的普遍关注,尤其是血浆脂质代谢与补体系统之间的关系已成为许多实验室研究的热点。
一、血清碱性蛋白质的分离及其氨基酸的组成分析
最初在培养离体成纤维细胞和脂肪细胞时,偶然发现培养基中加入血清可使细胞甘油三酯(TG)的合成量增加,后来证明这是因为血清中含有一种呈碱性的蛋白质分子,根据这一特性,1988年,Cianflone采用层析法将这种蛋白质分离出来,并依据其生理功能命名为酰化作用剌激蛋白,该蛋白质分子量为14.0kD,等电点为9.10。1989年Kwiterovich采用IEF和SDS/PAGE技术从人血浆中分离纯化三种碱性蛋白质分子,并测得其分子量和等电点分别为:碱性蛋白Ⅰ(BPⅠ)14.0kD,9.10;碱性蛋白Ⅱ(BPⅡ)27.5kD,8.48;碱性蛋白Ⅲ(BPⅢ)55.0kD.8.73。分析这三种碱性蛋白质,发现他们分别由不同的氨基酸组成:BPⅠ精氨酸的含量约为BPⅡ、BPⅢ的两倍,半胱氨酸含量为BPⅢ的三倍;BPⅡ不含半胱氨酸而富含脯氨酸;BPⅢ蛋氨酸的含量是BPⅠ、BPⅡ的2~3倍,而组氨酸的含量只有BPⅠ、BPⅡ的一半,BPⅢ还富含丝氨酸。另外,这三种蛋白质都含有较丰富的非极性氨基酸,因此当用葡聚糖或聚丙烯酰胺对其进行层析法分离时,观察到的相反的现象可能是这些氨基酸在水相中相互作用的结果。而组成该蛋白质分子的Asn/Asp和Gln/Glu都以酰胺基团形式存在,保证了这些蛋白质分子的等电点呈碱性。
Kwiterovich采用免疫印迹分析表明:BPⅠ只能同抗ASP免疫血清发生特异性反应,与免疫前血清无反应。而BPⅡ和BPⅢ都能与抗ASP免疫血清和免疫前血清发生反应,因此没有理由相信BPⅡ和BPⅢ与ASP是同一种物质,但Kwiterovich认为BPⅠ和ASP为同一种物质,因为许多实验结果也显示BPⅠ和ASP具有相似的等电点、分子量和氨基酸组成,而且都具有酰化作用激活性,但目前还没有BPⅠ和ASP分子克隆的结果证实这一结论,见表7-1所示。
表7-1 碱性蛋白Ⅰ和酰化作用剌激蛋白氨基酸组成分析
| 残 基 | 碱性蛋白Ⅰ | 酰化作用剌激蛋白 | ||
| 摩尔组分 | 整 数 | 摩尔组分 | 整 数 | |
| Asp/Asn | 9.47 | 12 | 10.3 | 14 |
| Clu/Gln | 11.76 | 15 | 14.1 | 19 |
| Ser | 5.75 | 7 | 6.6 | 9 |
| Gly | 9.11 | 12 | 11.7 | 16 |
| Arg | 8.25 | 10 | 5.8 | 8 |
| Cys | 3.01 | 4 | 5.4 | 7 |
| Thr | 5.16 | 7 | 4.9 | 7 |
| Ala | 7.54 | 10 | 8.2 | 11 |
| Val | 5.23 | 7 | 4.8 | 6 |
| Met | 1.59 | 2 | 1.5 | 2 |
| Ile | 3.61 | 5 | 2.7 | 4 |
| Leu | 8.03 | 10 | 6.2 | 8 |
| Phe | 3.61 | 5 | 3.2 | 4 |
| His | 2.95 | 4 | 1.4 | 2 |
| Lys | 6.75 | 9 | 5.2 | 7 |
| Pro | 5.02 | 6 | 5.2 | 7 |
| Trp | ND | ND | ||
| 残基总数 | 129 | 135 | ||
| 分子量 | 14335Da | 14514Da | ||
| 等电点 | 9.10 | 9.10 | ||
氨基酸组成分析也证实BPⅠ和ASP都含有丰富的半胱氨酸,可以凭借其形成二硫键产生广泛的生物学效应,一般这些半胱氨酸残基都以氧化的形式存在,当采用含β-巯基乙醇的缓冲液来纯化ASP时,其生物活性会完全丧失,可见半胱氨酸的存在对维持其酰化作用剌激活性很有必要.现已证明,BPⅠ、BPⅡ、BPⅢ的生理功能不同于胆固醇转运蛋白(sterol carrier protein ,SCP)和脂肪酸连结蛋白(fatty-acidbinding protein ,FABP),也不同于其他碱性蛋白如髓鞘碱性蛋白(MBP)。
二、血浆碱性蛋白对细胞脂质代谢的影响
碱性蛋白Ⅰ、Ⅱ、Ⅲ都具有酰化剌激活性,能剌激成纤维细胞合成TG,胆固醇酯(ChE)和磷脂(PL)。1994年,Peter分别采集了6个健康成人和6个家族性高载脂蛋白β脂蛋白血症患者的成纤维细胞进行细胞脂质代谢的研究:在正常人培养的成纤维细胞中,BPⅠ、BPⅡ和BPⅢ分别使其细胞内甘油三酯(TG)的含量增加2、1.5和1.4倍;但在HyperApoB患者成纤维细胞中,BPⅠ的作用下降了50%,而BPⅡ和BPⅢ仍能发挥其有效的酰化作用剌激活性。
在正常成纤维细胞,BPⅠ也有剌激胆固醇酯合成的能力,而在HyperApoB患者成纤维细胞,BPⅠ的这种作用基本上消失了。但BPⅡ能使HyperApoB患者成纤维细胞内胆固醇酯的含量异常升高至正常细胞含量的六倍,而且BPⅡ对胆固醇酯和总胆固醇的影响是平行的,游离胆固醇未发现有何变化。BPⅠ还可使正常细胞总磷脂含量升高约两倍,而在HyperApoB患者成纤维细胞,BPⅠ对磷脂的合成代谢影响甚微,只相当于正常细胞约三分之一的能力。
已有研究表明,未用碱性蛋白(BPs)处理的正常细胞和HyperApoB患者细胞,其脂质代谢无显著性差异,表明碱性蛋白(BPs)的作用机制可能是加速细胞合成脂质或抑制细胞内脂质的水解。Teng等发现在正常人脂肪细胞,ASP(或BPⅠ)的作用是促使甘油三酯(TG)合成增加而不是抑制了细胞内甘油三酯的水解,同样,在HyperApoB患者脂肪细胞内甘油三酯的减少不是由于(BPⅠ)使甘油三酯水解增加而是使其合成减少。因此Kwiterovich认为BPⅠ促进正常细胞合成甘油三酯,而HyperApoB由于存在某些缺陷限制了BPⅠ的酰化剌激活性。
三.不同脂质、脂蛋白和LDL-ApoB浓度下碱性蛋白对细胞代谢的影响
Kwiterovich 选择正常人和家族性高载脂蛋白β脂蛋白血症患者成纤维细胞进行培养,分别观察碱性蛋白Ⅰ、Ⅱ在不同脂质、脂蛋白和LDL-ApoB浓度下对细胞油酸代谢的影响,结果发现BPⅠ剌激油酸转化为甘油三酯的比率与血浆总胆固醇、甘油三酯、LDL-C和LDL-ApoB水平呈显着性相关(P<0.01),同血浆高密度脂蛋白浓度正相关(P<0.05),相似的关系也见于油酸转化为胆固醇酯的过程中。因此认为BPⅠ可能影响HyperApoB的病理生理过程,对各种表型的形成起重要作用。如总胆固醇、甘油三酯、LDL-ApoB浓度越高,则高密度脂蛋白浓度越低。而Cianflone则认为,除了家族性高胆固醇血症,酰化作用剌激蛋白(ASP)诱导成纤维细胞合成甘油三酯的量与血浆低密度脂蛋白水平呈负相关,与血浆高密度脂蛋白和极低密度脂蛋白水平无关。
同BPⅠ相反,BPⅡ诱导胆固醇酯合成的量同血浆总胆固醇、LDL-C和LDL-ApoB的浓度呈显著性正相关(P<0.01),同血浆高密度脂蛋白水平呈负相关(P=0.06),同血浆甘油三酯的浓度有正相关趋势(P=0.01)。同样,BPⅡ剌激高载脂蛋白β脂蛋白血症患者成纤维细胞合成胆固醇酯的能力与血浆高水平的LDL-C和LDL-ApoB密切相关,血浆高水平的LDL-C和LDLApoB为BPⅡ促进胆固醇的大量酯化创造了良好的条件。碱性蛋白Ⅱ(BPⅡ)可能以不同于碱性蛋白Ⅰ(BPⅠ)的方式影响血浆LDL浓度:BPⅠ主要通过影响外周细胞(如脂肪细胞)而发挥生物效应,因为在HyperApoB患者外周细胞对游离脂肪酸的转化降低;而BPⅡ则促进肝组织对游离脂肪酸的吸收并剌激肝细胞合成分泌载脂蛋白B。
碱性蛋白Ⅲ(BPⅢ)能显著剌激单核细胞源性巨噬细胞合成胆固醇酯,而对甘油三酯的代谢无影响。BPⅠ和BPⅡ对单核源性巨噬细胞的甘油三酯和胆固醇的代谢没有影响,表明碱性蛋白生物效应可能具有细胞特异性。
四、酰化作用剌激蛋白与细胞的连结
同正常人成纤维细胞一样,酰化作用剌激蛋白(ASP)能明显促进家族性高胆固醇血症和LDL-ApoB水平正常的IV型高脂蛋白血症患者的成纤维细胞合成甘油三酯,并且ASP与成纤维细胞结合具有一定的特异性,结合曲线可呈饱和状态,表明家族性高胆固醇血症和LDLApoB水平正常的IV型高脂蛋白血症患者,同正常细胞一样具有同一类ASP受体,而且该受体的最大亲和力与正常对照组基本一致。
研究表明,ASP与正常细胞和HyperApoB细胞连结的典型曲线为矩形双曲线。Scatcharel线性回归分析表明,正常细胞的斜率为-0.068±0.01(μg/ml)-1而HyperApoB患者细胞的斜率为-0.08±0.02(μg/ml)-1统计学无显著性差异,而HyperApoB细胞x轴截距只相当于正常细胞的一半这些结果表明,ASP与正常细胞和HyperApoB患者细胞表面受体的连结都呈单级式,kD值为1.05×10-6M,只是HyperApoB细胞表面受体下降了一半。但有研究表明,只有约50%的HyperApoB患者细胞存在这种缺陷,且此种缺陷与高脂血症的严重程度无关。Babirak则认为脂蛋白脂肪酶的活性缺失也可能导致高载脂蛋白β脂蛋白血症,而并未发现该患者的外周细胞表面的酰化剌激蛋白受体有所减少。
同胰岛素相比,ASP可能更有促进脂肪组织合成甘油三酯的潜力,对餐后脂肪酸的分布发挥其重要作用。ASP调节外周脂肪组织吸收脂肪酸合成甘油三酯,迅速解除游离脂肪酸对脂蛋白脂肪酶(LPL)活性的抑制,促使LPL更有效地水解餐后升高的甘油三酯,并改善LPL对富含甘油三酯的脂蛋白的清除,而HyperApoB患者由于细胞膜ASP受体数目降低,外周组织不能有效地利用血浆中的脂肪酸和葡萄糖,致使大量脂肪酸重新分布到肝组织,剌激肝细胞合成并分泌大量ApoB,装配VLDL和LDL。
五、碱性蛋白的信使传递途径
碱性蛋白Ⅰ和碱性蛋白Ⅱ可能是通过第二信使系统介导而影响细胞甘油三酯和胆固醇酯的代谢。Peter选择蛋白激酶C(PKC)的激活剂和抑制剂来研究BPⅠ、BPⅡ的作用途径,H-7是PKC较为有效的抑制剂,其作用是参与ATP竞争而不是与Ca2+或磷脂相互作用,实验结果表明,H-7抵消了HyperApoB患者细胞对BPⅠ的反应性,而且HyperApoB患者细胞对BPⅡ异常反应也被高浓度的H-7所遏制。在缺乏BPs时,PKC的激活剂C:8能同样有效地剌激正常细胞和HyperApoB患者细胞,表明在HyperApoB细胞,经甘油二酯(DG)途径激活PKC的过程无异常。但当BPs存在时,HyperApoB细胞的代谢缺陷并不因为PKC的激活剂C:8的出现而有所改善,所以HyperApoB的代谢缺陷不是在DG-PKC途径,而在第二信使系统的其他环节上。
Baldo也认为ASP是通过蛋白激酶C(PKC)途径介导而发挥生物效应的,因为PKC的激活剂豆寇酰佛波乙酯(PMA)和1-油酰基-2-乙酰-rar-甘油(OAG)能模拟ASP的生物效应,当成纤维细胞对PMA和OAG的反应性处于饱和状态时,改变培养基中的ASP浓度,并不能使甘油三酯的合成增加;PKC特异性抑制剂星形孢菌素Cal-phostinC和GF109203x也可完全抑制ASP的生物活性;ASP可使细胞内DG合成增加,而DG是PKC的有效激活剂;ASP激活PKC从胞浆转位到细胞膜,使细胞膜对脂肪酸的吸收和葡萄糖的转运增加。
为了进一步明确HyperApoB患者的细胞变异环节,1995年,Kwiterovich采用染料木黄酮(genistein)作为探针来研究正常细胞和HyperApoB患者细胞对BPⅠ的反应性。结果显示木黄酮存在时正常细胞和HyperApoB患者成纤维细胞的脂质代谢存在明显差异,可以推测酪氨酸蛋白激酶(TPK)的磷酸化在HyperApoB病理生理过程中扮演重要角色,且这一现象也被其他两种TPK抑制作用所证实(herbimycinA和tryphostinA47)。
在缺乏BPⅠ的F-12培养基中补充木黄酮(92.5nmol/ml),正常细胞甘油三酯含量下降10%,而HyperApoB患者成纤维细胞中总胆固醇和非酯化胆固醇含量下降25%。正常成纤维细胞和HyperApoB患者成纤维细胞中总胆固醇和非酯化胆固醇的量都显著减少,且HyperApoB患者成纤维细胞这两种脂质下降更显著,还没有发现成纤维细胞内胆固醇酯有何变化。当用BPⅠ和木黄酮(或者herbimycinA、tryphostinA47)处理培养基后,正常细胞合成甘油三酯的量与只用BPⅠ处理HyperApoB细胞合成甘油合成甘油三酯的量一致。这些现象表明,BPⅠ的生物活性,是通过位于细胞膜上TPK所介导的HyperApoB细胞,对BPⅠ反应性缺失,由于TPK的磷酸化为一些TPK的抑制剂所阻断,经木黄酮处理的正常细胞和HyperApoB细胞仍对BPⅠ有一些残余反应,其机理有待进一步探讨。
非受体型TPK包括SH2和SH3两个功能域,通过磷酸化作用,激活跨膜受体TPK,实际上SH2和(或)SH3蛋白是磷脂酶C-r(PLC-r)、ras-GTP酶活化蛋白(ras GAP)和磷脂酰肌醇3激酶(pI-3K)的同系物,其功能是裂解4,5二磷脂酰肌醇为DG和三磷酸肌醇(IP3),因此这些SH2和SH3蛋白也具有TPK活性,并放大TPK的信号,最终将其传到核内的转录机构,以调节特定基因的表达或通过改变细胞内蛋白的功能状态,使细胞的代谢水平发生变化,已证实HerbimycinA直接抑制PLC-r。因此,HyperApoB的细胞缺陷可能存在于跨膜受体TPK,也可能存在于原型细胞质信号蛋白的识别和结合方式。
从目前的资料来看,木黄酮对BPⅠ生物活性的抑制不是通过降低HMGCoA还原酶的活性而实现的,因为木黄酮能抑制甲羟戊酸内酯转变成非酯化胆固醇,而不能抑制HMGCoA还原酶的磷酸化。Sato已经阐明HMGCoA还原酶的磷酸化可降低其催化能力,如果木黄酮抑制了HMGCoA还原酶的磷酸化,那么将使胆固醇的生物合成增加而不是降低,但是这样无法解释经木黄酮处理的正常成纤维细胞和HyperApoB细胞内总胆固醇和非酯化胆固醇的量显著减少而胆固醇酯的变化不大的现象。
六、脂肪信号Adipsin-ASP系统
1983年,Spiegelman用梯度凝胶电泳和Northern杂交技术检测培养的鼠3T3脂肪细胞和前脂肪细胞总mRNA水平时,发现脂肪细胞较前脂肪细胞多三条特异的mRNA带,其中adipsin mRNA是分化的脂肪细胞所特有的,尤其在鼠的白色和褐色脂肪组织adipsinmRNA水平分别下降75%和68%,在胰岛素缺失的实验模型中,adipsin mRNA水平增加2~3倍,而在遗传性肥胖实验模型中,脂肪组织adipsin mRNA水平降低96%~99%。许多研究表明,adipsin是一种丝氨酸蛋白酶,由脂肪组织和坐骨神经产生,存在于循环血液中。Rosen用酶分析认为adipsin具有补体因子D的活性,而抗体中和试验也强烈提示鼠adipsin是人补体因子D仅有的同系物,White采用氨基酸序列分析表明adipsin同丝氨酸蛋白酶家族中主要成员有30%同源性,而与人补体因子D有60%同源性,而且经重组的adipsin可能替代补体因子D激活补体旁路途径。另外还发现,在肥胖型老鼠的血液中,补体因子D的活性也随着adipsin mRNA的水平下降而降低。最近White对人adipsin mRNA的成功克隆最终证实了adipsin和补体因子D为同一种物质。
在脊椎动物,补体系统是主要免疫防御体系之一。外来微生物的溶解是通过激活了抗体依赖性补体激活途径或抗体非依赖性补体激活途径来实现的,这两种激活途径都可形成裂解成孔复合体(lytic pore complex),破坏感染的细胞膜成分,导致细胞的裂解。我们知道,大多数补体蛋白都是由肝细胞和免疫细胞合成的,而脂肪组织特异性蛋白酶adipsin是人补体因子D的同系物,说明补体旁路激活与脂肪细胞的生物学行为间存在某种联系,受这一结果的启发,Lisa终于取得令人满意的结果:脂肪细胞和脂肪组织,还可合成补体旁路激活途径中的另外两个关键补体因子C3和B,表明脂肪组织在局部的免疫防御反应中起有重要的作用。SDSPAGE分析表明,补体因子B和D由一条多肽链组成,而C3由两条链组成,C3α(110kD)和C3β(70kD)之间由二硫键相连。将因子C3、B和adipsin/D放在一起孵育发现,adipsin/D将因子B酶解为Ba和Bb,因子Bb与C3相连形成C3转化酶,将C3裂解为C3α(110kD)和C3α(9kD)。过敏毒素C3α可能改变血管的通透性和收缩性,是一种趋化性细胞因子,能诱导单核细胞释放IL-1,Ba和Bb,调节淋巴细胞的生长,Bb还诱导人单核细胞的扩展,抑制单核细胞的迁移。
ASP是一个更具潜力的脂肪酸酰化剌激因子,他诱导TG合成具有双重效应:其一,ASP诱导葡萄糖经细胞器运输到细胞表面,使细胞膜对葡萄糖特异性转运增加,尽管细胞膜对脂肪酸的转运是由ASP间接引起的,但细胞对脂肪酸净吸收量的增加激活了甘油三酯合成的限速酶-甘油二酯酰基转移酶:其二,ASP实际上是补体C3的一个片段,命名为C3αdesArg,他具有调节细胞内甘油三酯合成的功能。
1993年,Baldo对ASP进行了氨基酸组成、分子量和N-端氨基酸序列分析发现,ASP和C3α的氨基酸组成非常接近,只是C3α比ASP多一个精氨酸,且N-端氨基酸序列均为N-Ser-Val-Gln-Leu-Thr-Glu-Lys-Arg-Met-ASP,离子喷射电离技术也证实ASP的质量单位(8933±0.3)与C3αdesArg(8932.5)一致,而不同于C3α(9088.7).
在血浆羧肽酶的作用下,C3α羧基未端Arg很容易被水解掉而形成C3αdesArg,尽管C3αdesArg曾被认为是C3的非活性产物,只有过敏毒素的作用,然而目前的资料已显示C3αdesArg确实能够促进细胞甘油三酯的合成。
已经明确,ASP能剌激成纤维细胞、脂肪细胞和HepG2细胞合成TG,且对分化的脂肪细胞影响最大,胆仍没有证据表明ASP对脂质水解有何影响,因为HyperApoB细胞TG的含量下降是由于该细胞对ASP的反应性下降而非细胞内TG的水解增加所致。但Cianflone在分子水平利用RT-PCR技术检测了甘油醛-3-磷酸脱氢酶(GAP)、脂蛋白脂肪酶、adipsin、因子C3和因子b mRNA水平与ASP(C3α-desArg)之间的关系后发现,成纤维细胞和未分化的前脂肪细胞只能合成微量ASP,而分化的脂肪细胞在相同时间内产生大量ASP(是前者的8倍);成纤维细胞和分化的脂肪细胞内GAp mRNA水平无差异,而LDL mRNA在分化的脂肪细胞内明显增加,其意义有待进一步探索。另外,分化的脂肪细胞内因子C3和adipsin mRNA水平异常升高,因子B mRNA水平只略有升高,这些变化与ASP(C3α-desArg)大量增加平行。
因此,adipsin/D-ASP/C3α-desArg系统可能具有非常重要的生理意义。当脂肪组织对脂肪酸的摄取能力下降时,大量脂肪酸滞留于血浆中,LPL的活性则受到严重抑制,不能有效水解血浆中的TG,而Adipisn-ASP系统可以上调脂肪组织对血浆游离脂肪酸的吸收率,使血浆中游离脂肪酸的水平不致于上升到有害的程度,LPL也能充分发挥其有效的生物活性,水解血浆中的TG和富含TG的脂蛋白,有效地调节甘油三酯的水解和合成。
七、HyperApoB的病理生理
HyperApoB是Sniderman分析了大量临床资料后于1980年首先提出的,该患者脂代谢紊乱的主要表现是血ApoB和LDL水平升高,LDL-C同LDL-ApoB之比明显降低。据Montreal心脏研究中心对100例HyperApoB合并冠状动脉粥样硬化患者实施主动脉-冠状动脉搭桥术后,十年随访结果显示:血清LDL-ApoB水平升高和HDL-ch水平降低是冠状动脉粥样硬化病变进展的两个最有价值的指标,不管是发生在原位冠状血管,还是在隐静脉旁路移植块。Brown等对血清LDL≥72.5μmol/L、有冠状动脉搭桥术史和早发冠心病的遗传背景的患者采用控制饮食和降低脂质相结合的治疗方案。结果表明:当血清LDL-ApoB的浓度下降时,冠状动脉内的粥样斑块也随之消退。
正常人的LDL是一类非均质的大分子物质,密度为1.019~1.063kg/L,HyperApoB患者LDL的分子量小于2.0×106D,直径仅有23nm,Sf值也小于5.0,而密度则高达1.055kg/L,该患者LDL组成分析表明,胆固醇酯的含量明显降低,ApoB含量明显升高,而甘油三酯、磷脂和非酯化胆固醇含量基本不变。另外,HyperApoB患者往往合并血清Lp(α)水平升高,而PROCAM研究中心则认为血清Lp(α)水平与ApoB或ApoA-Ⅰ的浓度变化无关。
大量研究显示HyperApoB患者体内LDL受体活性是正常的,并认为LDL-ApoB的增加是大量VLDL-ApoB的继发性改变。于是,许多实验室开始研究HyperApoB患者ApoB的分子或基因变异情况,Gavish应用ApoB的单克隆抗体封闭ApoB的某种抗原点位,发现LDL-ApoB的浓度。但大规模遗传连锁分析还没有确认HyperApoB患者同ApoB基因所在染色单体之间的关系,而且Johns Hopkins冠心病研究小组也没有发现ApoB的影响变异与HyperApoB之间存在某种密切关系。
从目前资料来看,ApoB的基因变异或缺失似乎对HyperApoB的影响甚微,无法解释HyperApoB的各种表型。已发现HyperApoB每一种表型都存在于两种代谢障碍。其一,肝组织大量合成VLDL,致使致密的LDL水平升高,Teng用ApoB的单克隆抗体分别封闭致密和疏松的LDL微粒,发现致密的LDL与LDL之间向乎无反应,而疏松的LDL微粒与LDL受体之间的高亲和力下降,致使LDL表面的ApoB重新分布。来自动物体内和体外的实验结果也证实疏松的LDL很容易从血液循环中清除,而致密LDL常需要很长时间。Kwiterovich认为致密LDL可能通过清道夫受体途径从血液中清除,这种代谢方式将促成动脉粥样硬化的形成和胆固醇酯在血管壁的沉积,但研究结果出乎意料,来源于HyperApoB患者体内的LDL并不能促进正常人或HyperApoB患者单核源性巨噬细胞大量合成胆固醇酯。而且Knight等也没有发现单核源性巨噬细胞优先吸收和降解HyperApoB患者的致密LDL。其二,从饮食中摄入的脂肪经乳糜途径延迟,血中游离脂肪酸的浓度明显升高。Sniderman等的研究表明脂肪细胞和成纤维细胞摄取游离脂肪酸合成甘油三酯的能力下降,可能是血中游离脂肪酸水平升高的主要原因,而游离脂肪酸则诱导肝细胞合成和分泌装配VLDL的载脂蛋白B。
由于血清碱性蛋白与脂代谢密切相关,而HyperApoB的发病机制又无法从ApoB的基因变异、LDL受体和清道夫受体水平上找到合理的解释,许多实验室已将目光转入血清碱性蛋白质的研究上,并试图解开HyperApoB的发病机制。尽管目前的研究水平仍停留在对碱性蛋白质结构和功能的探讨上,但Kwiterovich已根据现有的研究成果,对HyperApoB的生化特征从碱性蛋白质及其受体的角度作出了大胆的假设,如图7-3所示。
图7-3 HyperApoB病理假说图解
综上所述,三种血清碱性蛋白质所具有酰化剌激活性确实为我们进一步认识血浆脂质、脂蛋白和游离脂肪酸的代谢及HyperApoB的致病机制提供了新的视野,但其确切的生化机制有待进一步阐明。血清碱性蛋白质与补体系统之间的关系。以及碱性蛋白的组织特异性仍将是今后研究的重点。
第三节 LDL受体相关蛋白
LDL受体相关蛋白质(LDL receptor related protein ,LRP)是Herz等于1988年发现,其组成及结构与LDL受体类同,可能属于残粒受体(remnant receptor)的一种。其后证明,LRP又是α2-巨球蛋白(α2-macroglobulin,α2MG)受体。根据LRP的cDNA分析,他含有与LDL受体相同重复序列,而且与LDL受体重复序列互补的寡核苷酸可与LRP交叉杂交,所以称为LDL受体相关蛋白。LRP组成及结构见图7-4所示。
一、LRP组成及合成部位
利用寡核苷酸筛查法,已得到LRp cDNA并已阐明LRP氨基酸排列顺序,如图7-6所示。LRP由4526个氨基酸残基组成,是一种大分子量的糖蛋白,分布于大多数细胞内膜。
LRP与LDL受体,二者的配体结合结构极为相似,并与补体C8/C9结构组成具有高度类同性。
图7-4 LRP的结构与LDL受体结构比较
图7-5 LDL受体蛋白(LRP)的结构与代谢

图7-6 LRP的氨基酸序列
(引自HerzJ.1988)
细胞膜外存在的ECG前体结构域,LRP与LDL受体也类同,其中细胞外部的结构同样以三种形式存在:①20个氨基酸中有6个半胱氨酸残基,这种A基元(Amotif)带负电荷,该结构与脂蛋白结合有关;②EGF前体结构域的B基元的40个氨基酸中也有6个半胱氨酸存在,起有间隔基元的作用;③EGF前体结构域的另50个氨基酸序列中有Tyr-Trp-Thr-Asp结构,即YWTD重复序列。这一系列的相同性可能与这两种基因结构类似性有关。
LRP有两个疏水性很强的结构存在,其一是N端19个氨基酸的信号肽;其二是C端侧的组抽酸残基。跨膜结构域N端存在多个半胱氨酸,在细胞膜外侧以-S-S-键连接。LRP比LDL受体大两倍。LDL受体的有被小窝(coated pit)的第807位为酪氨酸,其周围的氨基酸组成与LRP高度相似。经有被小窝包吞作用(endocytosis)摄取细胞外物质的过程,LRP与其完全相同。在LDL受体胞液结构域的氨基酸序列中天冬酰胺-脯氨酸-X-酪氨酸(NPXY)重复序列存在,在LRP结构中也存在。
LRP在细胞粗面内质网合成,分子量为600kD(SDS-PAGE检测),在高尔基氏体内分解成515kD和85kD两种分子形式,分别称为α、β亚基,二者以非共价键结合。515kD的α亚基以贯通形式存在于细胞膜上,85kD的β亚基存在于膜内(见图7-5)。
二、LRP功能
直到目前为止,LRP的功能尚未完全清楚。LRP具有脂蛋白受体的以下特性:①摄取含ApoE的β-VLDL,摄取量与脂蛋白中ApoE含量有关;②ApoE存在时,LRP作用可促进脂蛋白的摄取;③LRP机能不受细胞内胆固醇水平的调节;④抑制含ApoC群的脂蛋白摄取,从而阻碍脂蛋白摄取。细胞内胆固醇含量不受下调作用的影响,是动脉粥样硬化灶中泡沫细胞生成的重要条件。LRP是信赖于Ca++的蛋白质,与配体结合需要Ca++的存在。
有报道,LRP可结合含ApoE的脂蛋白,并协同LPL的催化作用。LDL受体缺乏者,LRP起有重要作用。Kowdl和Beisiegel等报道,乳糜微粒残粒和β-VLDL均可被LRP识别;β-VLDL既可与LDL受体结合,又可与LRP结合;α2M也可作为配体与LRP结合,β-VLDL可抑制对α2M的摄取,以促进细胞内胆固醇酯的形成。α2M可与丝氨酸蛋白酶等多种蛋白质分解酶结合成复合物,并可经巨噬细胞膜上的α2M受体识别而进入细胞内,LRP则可抑制这种结合作用。LRP还可以抑制α2M与TGF-β、b-FGF、IL-Iβ和IL-b等细胞因子的结合作用。据此推测。分子结构与α2M受体蛋白为同一物质。利用精制的鼠肝细胞膜部分实验观察到,利用LDL受体缺乏的成纤维细胞实验,β-VLDL可竞争性抑制对α2M的摄取,α2M又可抑制乳糜微粒残粒的摄取。实验表明,LRP可能既是乳糜粒残粒受体,又是α2M受体之一。
经单克隆抗体免疫学实验检测,LRP蛋白质的mRNA在肝脏、肺、脑、小肠和肌肉等组织存在,与LDL受体比较,肝脏的LRp mRNA的量约有10倍之多。通过聚合酶链反应(PCR)和免疫组织化学检查发现,在动脉粥样硬化巢病变组织里,LRP含量迅速增加,并发现内膜的粥样硬化巢里由平滑肌细胞、巨噬细胞转变的泡沫化细胞中同样也有LRP的存在。
第四节 微粒体甘油三酯转移蛋白
WetterauJ.R等于1984年发现肝细胞微粒体的离子强度缓冲液里有加速甘油三酯和胆固醇酯转运作用,用Bio-Gel A-5m和Hydroxylapatite纯化,并监测其活性,发现该蛋白的激活作用促进甘油三酯转运的活力大。经凝胶过滤测得分子量约为150kD,部分纯化产品等电点为pH5.2~5.6,该蛋白即为微粒体甘油三酯转移蛋白(microsmal triglyceridetransfer protein, MTTP)。
一、MTP蛋白质结构及特性
1991年,Wetteran J R等发现MTR由58kD和88kD的两种亚基组成的异二聚体复合物。这一特点使之与以前报道的脂质转运蛋白加以区别,以前报道的脂质转运蛋白是单一多肽,分子量从8kD到53kD不等,发现几种哺乳动物包括人的血浆中的胆固醇酯转运蛋白(CETP),均属于糖蛋白,分子量为74kD,含一个53kD的多肽骨架。
MTP的58kD的小亚基通过氨基酸分析和免疫化学分析表明他是蛋白二硫键异构酶(protein disulfide isomerase,PDI;EC5.3.4.1)早在1963年就在肝和胰腺组织中发现此酶,其功能之一是催化蛋白质生物合成中的二硫键形成,具有较宽的底物特异性。PDI在新鲜制备的鼠肝微粒体中未能检测其活性,但破膜后,可检测到二硫键异构酶活性。PDI是一种多功能蛋白,据报道他又是脯氨酰-4-羟化酶(prolyl 4-hydroxylase)的β亚单位;还与寡糖基转移酶的糖化位点结合蛋白亚组分高度相似。PDI羧基端序列Lys-Asp-Glu-Leu与内质网上相应受体结合,使之与88kD组分一起保留在内质网腔内,PDI基因定位在17号染色体。据估计,牛肝内质网腔中游离PDI浓度超过MTP中PDI浓度的五倍。此,PDI自我组装成二聚体和四聚体。MTP中PDI的二硫键异构酶活性仅是自由PDI的十分之一。
用沉降平衡实验表明,这种150kD的MTP有三种不同的沉降速率。他们分别是MTP、PDI和一个88kD的亚基。进一步用SDS-聚丙烯酰胺凝胶电泳,考马斯亮蓝染色测定一定量MTP中PDI含量,与标准PDI比较,表明PDI:88kD亚基之比为1:0.98~1.30,证明MTP中58kD的PDI和88kD亚基化学计量为1:1。通过超速离心发现沉降系数为5.85,Stoke半径为4.7μm。用盐酸胍变性实验表明,MTP可抵抗0.8M盐酸胍的变性作用,PDI与88kD亚基结合稳定。PDI与MTP大亚基作用不可逆,到目前为止,试图用其组分或外源PDI重建MTP复合体还未功能。通过远紫外圆二色光谱分析表明,MTP约有28%α螺旋和随机结构(分别为31%和34%),而88kD亚基的β折叠占35%。
MTP的大亚基与已发现的蛋白相比未发现高度同源性。Shoulders等从MTP辨认出几个区域与卵黄磷脂蛋白的序列有低水平同源性。卵黄磷脂蛋白是产卵动物中脂蛋白复合体的蛋白质组分,由卵黄生成素裂解而成。基于氨基酸序列、分子模型和基因结构的比较,认为MTP大亚单位是卵黄生成素基因家族成员之一。
二、MTP基因结构
1993年Sharp D.等克隆MTP 88kD大亚基的cDNA并进行序列分析,比较人和牛的cDNA表明有88%核苷酸序列相同,在人MTP大亚基的3末端有基因组DNA编码的18个腺苷酸残基,预测的分子量97kDa,人和牛MTP大亚基单位氨基酸有86%同源性,加上保守性氨基酸替换,人与牛MTP大亚基单位有94%同源性。在核苷酸和蛋白序列数据库中未发现其他蛋白与之同源。
SharpD.等MTP88kD大亚基基因结构进行分析(图7-7)。其基因跨越55~60Kb,由18个外显子组成,外显子1和18也分别包括5和3的非编码序列。除掉含非编码序列的外显子1和18,平均每个编码外显子的长度是153bp。
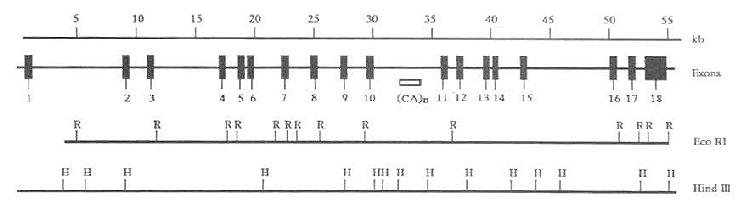
图7-7 人MTP大亚基的基因结构
上线表明基因跨度;第二线为MTP大亚基的18个外显子
示意图;第三四线分别是EcoRI(R)和Hind(H)的酶切位点。
SharpD等早期报道,人MTp cDNA 5端非编码区有64个核苷酸。用锚定PCR检测MTpcDNA的5末端,从两个独立PCR产物的直接序列分析揭示,从翻译起始的上游有86bp的非编码序列(见图7-8)。所有86bp5端非翻译区均编码外显子1,外显子1还有61bp编码信号肽及成熟蛋白2个氨基酸。在翻译起始框外上游25bp有一个ATG,但该处没有适合的起始环境,第二个ATG是真正的翻译起始点。

图7-8 MTP大亚基的5侧翼序列
转录起始点5侧翼序列不含TATA盒,但富含AT序列,在转录起始点上游约30bp的AAAGATAAA可能被TATA结合蛋白(TFⅡD)识别。用Nothern blot杂交及分析MTP活性表明MTP在肝和肠表达,在卵巢、睾丸和肾也发现有低水平MTp mRNA表达。计算机辅助分析转录起始点上游743bp序列表明,他与几种已知顺式作用元件同源,可调节MTP组织特性性表达。在转录起始点第一个200bp序列含肝特异C/EBP、HNF-1和HNF-5转录因子识别的上游启动子元件,该区还含有通用转录因子Sp-1和Ap-1识别序列。Sp-1,C/EBP、HNF-1和HNF-5在该区的位点有单个碱基错配。其他比第一个200bp更上游的顺式元件可被HNF-5,C/EBP和CTF/NF-1识别。
MTP大亚基限制性片段长度多态性分析或简单序列的串联重复多态性分析,均可用于调查MTP基因与异常血浆脂类或脂蛋白代谢的联系。CA双核苷酸重复多态性在人基因组随处可见,这种重复可用PCR分析,因而是一种理想的基因标记。为了识别CA双核苷酸重复序列,用一个CA重复的探针来与MTP大亚基因进行杂交,在内含子10发现非完整CA重复结构(CA)4AA(CA)3GA(CA)4TA(CA)nTACA,分析18个不相关个体的36个等位基因表明有8种变异,n从8到17。荧光原位杂交表明MTP大亚基基因位于4号染色体,即4q28-q31。
三、MTP生理功能和基因突变
脂质转运蛋白促进膜间不溶性脂类分子转运,MTP的特性在于他剌激膜间中性脂类(甘油三酯、胆固醇酯、磷脂酰胆碱)转运。脂质转运蛋白也能促进膜间脂质分子交换或促进从一种膜向另一种膜净转运脂质分子,虽然有例外,但在体外分析表明脂质转运蛋白一般是促进膜间脂质分子交换。当供体和受体膜间TG浓度相等时,MTP能促进膜间交换TG,而且当供体和受体膜间中性脂类浓度不平衡,中性脂类仍可转移到受体颗粒,表明MTP能净转运TG和CE。MTP存在于肝细胞和小肠细胞微粒体腔内,在富含甘油三酯的脂蛋白的正常组装、分泌中起有重要作用。用MTP抑制剂研究表明,MTP在含ApoB48脂蛋白组装的早期而不是晚期起作用,光亲和MTP抑制剂能阻断McArdle RH-7777细胞分泌含ApoB的脂蛋白,当这种细胞在缺乏MTP抑制剂和油酸时,贫脂质(HDL)的ApoB48颗粒可以形成,但不能分泌。油酸加入这种培养细胞后可转化成能分泌的富脂质的颗粒。然而,如果在贫脂复合体形成之后加入MTP光亲和抑制剂,则对这种转化或分泌过程没有作用。
1992年Wetterau J.R等报道无β脂蛋白血症患者MTP活性和MTP蛋白缺陷。SharpD.等1993年从一个无β脂蛋白血症患者取小肠活检,该患者是近亲婚配的女性后代,39岁,用RT-PCR结合序列分析表明215位胞嘧啶缺失,导致发生移码突变,移码突变导致在下游21个碱基处过早形成一个终止密码,并预测翻译产物为78个氨基酸。进一步分析发现该患者是移码突变的纯合子。从一个14岁女性无β脂蛋白血症患者发现1783位C→T转换,这个突变使Arg密码变成终止密码,产生594个氨基酸的截短产物。这个无义突变消除了一个TaqⅠ限制性内切酶位点。Southern杂交分析表明该患者为纯合子,而其父母都是含正常和突变的杂合子。为检测这些突变对MTP的影响,将PDI和野生或突变MTP大亚基用杆状病毒表达系统在sfq昆虫细胞共同表达。用表达PDI和野生MTP大亚基病毒共传染sfp细胞,可产生有活性的MTP。相反,用表达PDI和突变MTP大亚基病毒共传染sfq细胞,则不能产生有活性蛋白,突变蛋白也形成不容性凝聚体,不能与PDI结合。该结论可用解释无β脂蛋白血症患者的突变后MTP活性和MTP蛋白的缺陷。到目前为止,MTP大亚基的突变有码突变、无义突变及点突变改变了MTP的正常剪接。
第五节 胆固醇调节组件结合蛋白
胆固醇调节组件结合蛋白(SREBPs),是一类能与胆固醇调节组件1(SRE-1)发生特异性结合的“碱性螺旋-环-螺旋-亮氨酸拉链”(bHLH-ZZP)蛋白。在细胞内缺乏胆固醇的情况下,SREBPs通过和SRE-1的结合,激活SRE-1的基因,使其翻译增强,发挥生理功能。
一、胆固醇调节组件1的功能和定位
编码低密度脂蛋白受体(LDL-R)的基因5侧翼区,具有一个长10个碱基对的胆固醇调节组件1(sterol regulatory element 1,SRE-1)。SRE-1是一个条件正性调节组件,仅在细胞内胆固醇缺乏的条件下,才被激活。在其他的胆固醇调节基因如羟甲基戊二酸单酰CoA合酶(HMGCoa synthase )基因的启动子中也含有SRE-1,而在羟甲基戊二酸单酰CoA还原酶(HMGCoa reductase )基因的启动子中含有类似于SRE-1的胆固醇调节组件(SRE)。SRE-1通过调节LDL-R基因、HMGCoA合酶基因的翻译,控制细胞对外源性胆固醇的摄取量和内源性胆固醇的合成速率,调节细胞内胆固醇含量。SRE-1在LDL-R基因5侧翼区的定位见图7-9。
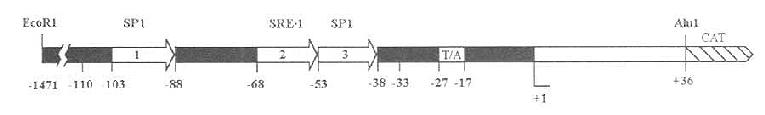
图7-9 +1表示翻译起始位点,T/A表示TATA盒,空心箭头表示重复区,重复区1、重复区3可能和Sp1(一种正性翻译因子)结合。重复区2内含有SRE-1。
二、SREBPs的发现和命名
1989年,Tripathi B.Rajavashisth发现了一种能和SRE结合的锌脂蛋白。1993年,MichaelR.Briggs等人,利用离子交换层析、凝胶过滤和DNA亲和层析的方法,从人类宫颈癌细胞(Hela细胞)核的提取物中分离出了这一组能与SRE-1结合的蛋白质,并将其命名为胆固醇调节组件结合蛋白(sterol regulatory element-binding proteins, SREBPs)。SREBPs在细胞胆固醇缺乏的情况下,通过和SRE-1的结合,激活LDLR基因、HMGCoA合酶基因的翻译。
三、SREBPs的结构和分类
SREBPs具有“碱性螺旋-环-螺旋-亮氨酸拉链”(basic helix-loop-helix-leucine zipper, bHLH-ZIP)结构,是bHLH-ZIP蛋白系列的一种。bHLH-ZIP蛋白包含一系列能特异性地和含E盒(e box, CANNTG)的DNA结合的蛋白质,例如:调节免疫球蛋白基因翻译的TFE3,致肿瘤蛋白Myc等。SREBPs虽是bHLH-ZIP蛋白中的一种,但又不同于其他的bHLH-ZIP蛋白。一方面,SREBPs分子量大,含1140个左右的氨基酸残基;另一方面,SREBPs不识别E盒(e box)而特定地识别SRE-1中直接重复的“CAC”序列。
迄今为止,发现有两种SREBPs。一种称SREBP-1,另一种称SREBP-2。SREBP-1又由于其mRNA剪接方式的不同,以三种功能上完全相同,组成上略有不同的形式大量存在,这三种形式的蛋白分别称为SREBP-1a、SREBP-1b、SREBP-1c。其中,SREBP-1a是SREBP-1的主要存在形式,故本文以SREBP-1a为例来描述SREBP-1。SREBP-1a含1147个氨基酸残基。分子量为125kD。至今,还没有发现SREBP-2存在多种不同的剪接后蛋白。SREBP-2含1141个氨基酸残基,分子量为121kD,与SREBP-1a之间有47%的同源性,含高度保守的bHLH-ZIP区,和SREBP-1a的bHLH-ZIP区有71%的一致性。但是SREBP-2含有不同SREBP-1a的谷氨酸富集区(在121个氨基酸残基中含多于27%的谷氨酸残基。SREBP-1a和SREBP-2的氨基酸序列和功能域结构之间的比较参见图7-10(A、B、C)。

图7-10 A:SREBP-2和SREBP-1a氨基酸序列之间的比较
“--”表示二者的相同部分
图7-10 B:SREBP-2和SREBP-1a的bHLH区(粗横线所示)的比较
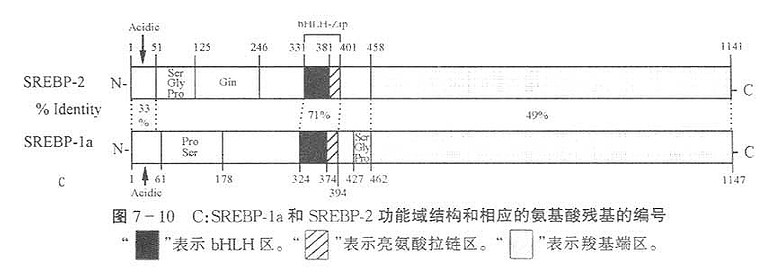
四、SREBPs的生理功能
两种SREBPs利用位于其氨基酸残基470~570之间的疏水序列,附着于内质网膜和核膜,在氨基端的470个氨基酸残基组成的肽链中,均含“碱性螺旋-环-螺旋-亮氨酸拉链”的核心结构,使蛋白质能形成均一二聚体,并能和SRE-1结合。两种蛋白质氨基端一侧的结构中,都有酸性区域,可能作为DNA翻译的增强子。当人或仓鼠细胞在缺乏胆固醇的环境中培养时,蛋白酶在亮氨酸拉链和膜间的附着区处裂解SREBPs,并从膜上释放出水溶性的氨基端的裂解片段,这一片段约含470个氨基酸残基,表现分子量为68kD。这一片段能够移行入胞核,结合于SRE-1,从而激活LDLR基因翻译和HMGCoA合酶基因翻译。
SREBPs裂解、移行入胞核,进而结合于SRE-1,以致激活LDLR基因、HMGCoA合酶基因,都有赖于细胞内缺乏胆固醇。因为胆固醇能够抑制SREBPs的裂解。而已形成的SREBPs的裂解片段又很容易被迅速分解,从细胞核中快速消失。故而胆固醇的存在,将阻断整个调节通路,使SRE-1失活。
将SREBP-1和SREBP-2进行cDNAg隆,并采用质粒转染动物细胞的方法,使培养细胞,如Hela细胞和中国仓鼠卵巢细胞(CHO细胞),表达SREBP-1和SREBP-2,发现他们调节细胞内胆固醇代谢的过程是一致的,功能上是协同的,然而两种蛋白质是单独发生作用,没有发现杂化二聚体。为什么存在这两种组成不同但功能一致的SREBPs,原因还不清楚。
研究仓鼠肝脏中产生的,由细胞内胆固醇含量调节的mRNA(包括LDLR和HMGCoA合酶的mRNA)的含量。肝脏经HMGCoA还原酶抑制物mevinolin处理后,这两种mRNA的量都增加。通过阻止胆固醇的合成,mevinolin诱导暂时的胆固醇水平降低,而增强胆固醇调节基因的翻译。当mevinolin和胆汁酸结合树酯,如降胆灵合用时,mevinolin增强翻译的效果更强。降胆宁通过阻止肠道对胆汁酸的再吸收,使胆固醇转变为胆汁酸,因而增加肝脏对胆固醇的进一步需求。
最近,研究HMGCoA还原酶抑制物和胆汁酸结合树酯是否促进SREBP-1和SREBP-2在仓鼠肝脏中的蛋白裂解,与在培养的细胞中的发现有些不同。资料表明SREBP-1和SREBP-2的裂解片段在仓鼠肝脏中的调节作用是不一致的。仓鼠肝脏经mevinolin 加降胆宁处理后,SREBP-2的裂解片段增多,而SREBP-1的裂解片段减少。这一结果似乎表明在仓鼠肝脏中,SREBP-1对LDLR和HMGCoA合酶基因的基础翻译起作用,而SREBP-2对经胆汁酸结合树酯和胆固醇还原酶抑制物处理后,形成的胆固醇缺乏状态的基因翻译起作用。
另有报道,胰岛素和类胰岛素生长因子Ⅰ也可以通过SREBP-1介导LDL-R启动子的激活,从而调节细胞内的胆固醇含量。
总之,在细胞内胆固醇含量的自我平衡中,SREBPs起了重要作用,其详细机制的阐明,必然对胆固醇代谢调节的研究产生重大影响。
(董学梅 滕思勇 郑芳 崔天盆)
(脂类代谢有关的特殊蛋白质)参考文献
1.DraynaD,Jarnagin A,Mclean J,et al Colnning and sequencing of human cholesteryl estertransfer protein cDna,Narure,1987,327:632-634
2.AbbeyM.Savage J,Mackimnnon A,et al .Detection of lipid transfer protein activity inrabbit perfusate.Biochim Biophys Acta,1984,793:481-484
3.NishidaH,Katolt,Nishida T.Affinty of lipid transfer protein for lipid and lipoproteinparticles as infuenced by lecithine cholesteryl acyltransferase.J Biol Chem,1990,265:4876-4883
4.TallA.Plasma lipid transfer proteins .Jlipid Res ,1986<27:361-367
5.HussainM,Maxfield F,Mas Olira J,et al .Clearance of chylomicron remnants by the lowdenisty lipoprotein receptor-related.J Biol Chem,1991,266:13936-13940
6.ScottrupJenesen L Alpha-Macroglobulins:structure,shape and mechansim of proteinasecomplesx formation. J Biol Chem,1989,264:11536-11542
7.StricklandD,Ashcom J,Williams S,et al Sequence identity between the α2-Macroglobulinreceptor and low density lipoprotein receptor-related protein suggests thatthis molecule is a multifunctional receptor ,J Biol Chem,1990,265:17401-17404
8.BrownM,Goldstein J,et al .A receptor mediated pathway for cholesterol homeostasis.Science,1986,232:34-47.
9.SmithJ R,Oshrne T F,Goldstein J L,et al Identification of nucleotides responsiblefor enhancer activity of sterol regulatory element in LDLR gene.J BiolChem,1990,265:2306-2310
10.BriggsM R,Yokoyama C,Wang X,et al .Nuclear protein that binds sterol regulatoryelement of low density lipoprotein receptor promotor.j BiolChem,1990,265:14490-14496
11.Youkoyama C,Wang X,Bringgs M R,et al ,srebp-1,a basic-helix-loop-helix-leucinezipper proteins that controls transcription of the low density lipoproteinreceptor gene Cell,1993,75:187-197
12.GoldsteinJL ,Brown M S.Regulation of the mevalonate pathway .Natute,1990,343:425-430
13.RajavashiothT B,Taylor A.K,Andalibi A,et al .Identification of a zinc finger protein thatbinds to the sterol regulatory element .Science,1989,245:640-643
14.WangX,Briggs M R,Hus X,et al. Nuclear protein that binds sterol regulatory elementof low density lipoprotein receptor promoter.J.Biol .Chem,1993,268:14497-14504
15.Kadesch T,Consequences of heteromeric interactions among helix-loop-helixprotein.Cell Growth Differ.1993,4:49-55
16.BeckmanH,Sul K,kadesch T.TFE3:a helix-loop-helix protein that activated transcriptionthrough the immunoglobulin enhancer motif .Gene.KEV.1990,4:167-179
17.HuaX,Yokoyama C,WuJ,et al.SREBP-2,a second basic-helix-loop-helix-leucine zipperprotein that stimulates transcription by binding to a sterol regulatory elementProc Natl Acad Sci USA,1993,90:11603-11607
18.SatoR,Yang J,Wang X,et al.Assignment of the membrane attachment ,DNA bindings ,andtranscriptional activation domains of sterol regulatory element-bindingprotein-1(SREBP-1).J Biol Chem,1994,269:17267-17273
19.WangX,Sato R,Brown M S,et al SREBP-1,a membrane-bound transcription factor releasedby sterol-regulated proteolysis ,Cell,1994,77:53-62
20.MaPTS,Gil G,Sudhof T C,et al .Mevinolin,an inhibitor of cholesterol sythesisinduces Mrna for LDLDR in livers of hasmters and rabbits .Proc Natl Acad SciUSA,1986,83:8370-8374
21.MehrabianM,Callaway K A,Clarke C F,et al Regulation of rat liver 3-hydroxy-3-methsutarylcoenzyme A synthase and the chromosomol localization of the humen gene J BiolChem,1986,261:16249-16255
22.BrownM S,Goldstein J L.A receptor mediated pathway for cholesterol homeostasis.Science,1986,232:34-47
23.ShergZ,Otani H,Brown M S,et al.Independent regulation of sterol regulatoryelement-binding protein 1 and 2 in hasmster liver.Prot Natl Acad SciUSA,1995,92:935-938
24.StreicherR,Kotzka J,Muller-Wieland D,et al .SREBP-1mediates activation of the lowdensity lipoprotein receptor promoter by insulin and insulin-like growthfactor-I.J Biol Chem;1996,7128-7133
25.WetterauJ R,Zilversmit D B.Atriglyceride and cholesteryl ester transfer protein associatedwith liver microsomes .J,Biol Chem,1984,259(17):10863-10886
26.WetterauJ R,Aggerbect,L P,Laplud M L ,et al .Structural properties of the microsomaltriglyceride transfer rpotein complex.Biochemistry.1991,30(18):4406-4412
27.WetterauJ R,Combs K A.Snipnner S N,et al .Protein disulfide isomerase is a component ofthe microsomal triglyceride transfer protein complex.J BiolChem,1990,265(17):9800-9807
28.GoldbergerR F,Epstein C J,Acceleration of reactivation of reduced bovine pancreaticribonuclease by a microsomal system from rat Liver j Biol Chem,1963,238:628-635
29.SharpD,Ricci B Kicnzle B Kienzle B,et al Human microsomal triglyceride transferprotein large subunit gene structure, Biodomistry ,1994,33(31):9057-9061
30.SharpD,Blindeman L.Combs K A et al .Cloning and gene defects in microsomaltriglyceride transfer protein associated wiyth abetalipoproteinaemia Nature,1993,258:999-1001
31.MathurS N,Born E,Marygy S,et al .Microsomal triglyceride transfer protein in CaCo-2Cell:characterization and regulation .J Lipid Res,1997,38(1);61-67
32.Weterau J R,Aggerbert LP.Bouma ME ,et al Absence of microsomal triglycetridetransfer protein in inpiduals with abetalipoproteinaemiaScience,1992,258:999-1001
33.WetterauJ R,Combs K A,Mclean LR ,et al .Protein disulfide isomnerase appears necessaryto maintain the catalytically active structure of the microsomal triglyceridetransfer protein .Biochemistry,1991,30(40):9728-9735
34.RicciB,Shrp D.Rourke E,et al .A30-amino acid truncation of the microsomaltriglyceride transfer proteinlarge subunit disrupts its interaction withprotein disulfide-isomerase and causesabetalipoproteinaemia.J,Biol.Chem,1995,270(24):14281-14285
35.WetterauJ R,Lin M,Jamil H.Microsomal triglyceride transfer protein Biochim Biophy Acta,1997,1345(1);136-150
36.BorenJ,Rustaeus S,Olofsson S.O.Studies on the assembly of apolipprotein B-48containing verylow density lipoproteins in MCARH7777 cells,j BiolChem,1994,(269(41)25879-25888
37.AtaelA.Wetterau J R.Mechansim of microsomcl triglyceride transfer protein catalyzedlipid transport.Biochemistry,1993 ,32(39);10444-10450
38.SnidermanA,et al .Alseuce of microsomal triglyceride transfer protein in indevidualswith abetalipoproteinemia.
39.ShrpD,Blinderma L,Combs K,et al.Cloning and gene defects in microsomal triglyeridetransfer protein associated with abetalipoproteinemia Nature ,1993,365:65
40.SnidermanA S,Marpole D M,Sdinner B,Kwiviterovich ,et al.The saaociaton of coronaryatherosclerosis cholesterol content in human plasma low density lipoprotein.Prot Nat Acad Sci USA,1990,97:604-608
41.SnidermanA S,Marpole D M.Skinner B,Kwivterovich ,et al.The association of coronaryatherosclerosis cholesterol content in human plasma low density lipoprtein.Prot Natl Acad Sci USR ,1990,97:604-608
42.TengB,Thompson GR,Smiderman AD,et al.Composition and distrbution of low densitylipoprotein fracteons in hyperapobetalipoproteinemia ,normolipidemia andfamilial hypercholesteroemia Prot Natl Acad Sci USa ,1983,80:6662-6666
43.KwiterovichPo Jr,white S,Forte T,et al.Hyperapobetalipoproteinemia in a kinderd withfamilial combined hyperlipidemica and familial hypercholeserolemia .ArterosclerThromb,1987,7:211-225
44.KwiterovichPo Jr,Coresh J Bachorik PL Prevalence of hyperapobetalipopproteinemia and otherlipoprotein phenotypes in men(≤50years )and women(≤60years)with coronarydisease Am J Cardiol,1993,71:631-639
45.BrunzdllJD.Sniderman AD,Albers JJ,et al.Apolipoprotein b and coronary artery disease inhumans.Arterioscler Thromb,1984,4:79-83
46.Kwiterovichpo Jr.HyperAopB:a pleiotrothic phenotype characterized by dense low densityliporoteins and associated with coronary artery disease.ClinChem,1988:34(supple B-1-B-135)B71-B83
47.CianfloneK,Kwiterovich po Jr,Wslsh M,et al.Stimulation of fatty acid uptake andtriglyceride synthesis in human cultured sdin fibroblasts and adipocytes by aserum protein.Biohys Res commun,1987,144:94-100
48.CianfloneKM,Rodriguez MA,Welsh MJ,et al.Effect of acylation-stimulation protein ontriglyceride synthesis in cultured skin fibroblasts from normals and patientswith hyperapobetalipoproteinemia(Abstract)Arteriosclerosis,1987,7:496
49.CianfloneKM,Rodriguez MA,Walsh M,et al.Purification and characterization ofcaylation-stmulating protein,J Biol Chem,1987,7:496
50.KwiterovichPo Jr,Motevlli M,Miller M Acylation stimulating activity inhyperapobetalipoproteinemia fibrolasts enhanced cholesterol esterification withanother serum basic protein BPⅡ.Proc Natl Acad Sci USA,1990,87:8980-8994
51.VahounyGV,chanderbhan R,kharroabi A.Sterol carrier and lipid transfer protein(Revicw).Adv Lipid Res,1987,22:83-113
52.KwiterovichPO,Jr,Motevalli M,Miller M.The effect of three serum basic proteins on the massof lipids in normal and hyperAopB fibroblasts Arterioscler Thromb,1994,14:1-7
53.TengBA,Forse MA,Rodriguez AD,et al.Adipose tissue glyceride synthesis in patientseith hyper aplbetalipoprotenemia J Physiol Pharmacol,1988,66:239-242
54.CianfloneKM,Maslowska MH.Sniderman AD.Impaired response of fibroblasts from patientswith hyperapobeta lipoproteinemia to acylation-stimulating protein.JclinInvest.,1990,85:722-30
55.BabirakSP.Iverius PH,Fujimoto WY.Detection and characterization of the heteroazygousstate for lipoprtein lipase deficiency ,Arteriosclenosis .1989,9:326-34
56.KwiterovichPO.Jr,Motevalli M,Miller M,The effect of three serum basic proteins on the massof lipid in normal and hyperapoB fibroblasts .Arterioscler Thromb,1994,141-7
57.Baldo AD.Sniderman S Kohen MK,Cianflone signal transduction pathway ofacylation stimulating protein involvement of protein kinase C.J lipid Res1995,36:1415-1426
58.KwiterovichPO Jr ,Motevalli Miller M,Inhibition of protein tyrosine dinase alters theeffcet of serum basic protein I on tracylglycerol and cholesterol differentlyin normal and hyperapoB fibroblasts Arteriolcler Thromb VascBiol,1995,15:1195-1203
59.CastagnaMY,Takai KK,et al .Direct activation of calcium activated phospholipiddependent protein dinase by tumor promoting phorbol esters J BiolChem,1982,257:7847-7851
60.WittersL A,and PJ,Blackshear,Protein kinase C mediated phosphorylation in intact cellsMethods Enzymol1987,141:412-425
61.EtscheidBG,Albert KA,Villereal ML,et al.Transduction of the bradykinin response inhuman fibroblasts prolonged elevation of diacyglycerol level and itscorrelation cell.Reg .1991,3:229-239
62.ZorVE,Her T,Harell G.et al.Arachidonic acid release bybasophilic leudemia cellsand macrophages stimulated by Ca2+ionophores,antigen anddiacylglycerol:essential role for protein dinase C and preventionbyglucocorticosteroids.Biochem Biophys Acta.1990,1091:385-392
63.IshizudaTJ,Hoffman DR,Cooper JE,et al.Clucose induced synthesis of ciacylglycerol denovo is associated with translocation cactivation of protein kinase C in ratadipocytes FEBS Lett.1989,249:234-238
64.SatoR.Goldstein JL,Browm MS,Replacement of serine871 of hamster3-hydroxy-3methylglutaryl coA reductase prevents phosphorylation by aAMP-activated kinase and blocks inhibition of sterol synthesis indrced by ATpdepletion Proc Natl Acad Sci USA,1993,90:9261-9265
65.BolenJB,Non erceptor tyrosine protein kinases Oncogene.1993,8:2025-2031
66.ParkDJ.Nin HK,Rhee SG,IgE-in duced tyrosine phosphorylation of phospholipase Cr-1in rat basophilic leukemia cells J.Biol Chem,1991,266:24237-24240
67.CianfloneK,AD Sniderman M.J.Walsh.H.et al.Purification and characterization of acylationstimulating protein .J.Biol Chem,1989,264:426-430
68.GerminarioR,A Sniderman D Manuels S.et al .Coordinate response of triacylglycerolsynthesis and glucose transport by acylation stimulating protein ,Metab ClinExp.1993,42:574-580
69.YasruelZ,Cianflinge K,Sniderman AD,et al.Effect of caylation stimulating protein onthe triacylglycerol synthetic pathway of human adipose tissue .Lipids.1991,26:495-499
70.MayorekNo,I Grinstein and J.Bar Tana.Triacylglycerol .synthesis in cultured rathepatocytes EurJ Biochem,1989,182:395-400
71.TengB.Sniderman AD.Soutar AK,et al. Metabolic basis of hyperapobetalipoproteinemiaJ Clin Invest .1986,77:663-672
72.CookKS,Min D,Fnhnson et al.Adipsin:a circulating serine protease homolog secretedby adipose tissue and sciatic nerve.Science(Wash.DC).1987,237:402-405
73.WhiteRT.Damon .N,Hancodk ,et al.Human adipoin is identical to complement factor Dand is expressed at high levels in adipose tissue.J BiolChem,1992,267:9210-9213
74.ChoyLN,Rosen BS.B.M Spiegelman.Adipsln and an endogenous pathway of complement fromadipose cells,J Biol Chem,1992,267:12736-12741
75.CianfloneKA,Snielerman D.Walsh MJ,et al .Adipsin/Acylatin stimulating protein system inhuman adipocytes :regulation of triacylglycerolsynthesis.Bioxhemistry.1994,33:9489-9495
76.SpiegelmanBM,Fraik M,Green,H,Molecular cloning of mRNa from 3T3 adipocytes J BiolChem,258,16:10083-10089
77.CookKS,Groves ,DL,Min HY,et al.A devlopmently regulated mRNA from 3T3 adipo cytescncodes A novel serine protease homologue .Proc Natl Acad SciUSA.1985,82:6480-6484
78.SnidermanA.Shapiros ,Marpole D,et al. Association of coronary atheroscleros is with Ahperapo beta lipoprotenemia .Proc Natl Acad Sci USA,1980,97:604-608
79.SnidermanA.Wolfson V,Teng B.Association of hyperaobetalipwproteinemia with endogenoushypertrglyceridemia and atherosclerosis Bachorikp Ann Intern Med.1982,97:833-839
80.TengB Thompson GR Sniderman AD,Composition and distrbution of low ednsity lipoproteinfractions in hyperapobetalipoproteinemia normolpidemia ,and familialhypercholesterolemia .Proc Natl Acad Sci USa 1983,80:6662-6666
81.Flier JS,Cook KS,Vsher P,et al.Severely Iimpaired adipsin expression in geneticand acquired obesity ,Science .1987,244:1483-1487
82.RosenBS,Cook KS,Yaglom Jet al .Adipsin and Comlement factor D activity:animmune-pelated defect in obesity .Science ,1989,244:1483-1487
83.DovisRA,Boogaerts JR.Intranepatic assembly of very low density lipoproteins J Biolchem,1982,257:10908-10913
84.HugliTE.Biochemistry and biology of anaphylatoxin curr topics microbiol immunol,1989,153:181-208
85.PrazF.Rauth EJ.Growth-supporting activity of fragment ba of the human alternativecomplement pathway for activated murine B lymphocytes .J Exp Med1986,163,1349-1354
86.AmbrusJL,Jr Peters MG,Fauci AS,et al.The ba fragment of xomplement factor B Inhibitshuman Blymphocyte proliferation J Immunol .1990,144:1549-1533
87.CampeauL Enjabert M.lesperange J et al .The pelation of risk factors to thedevelopment of atheroscerosis in saphenous-vein bypass corafts and theprogression of disease in the native circulation N Engl J Med.1984,311:1329-1332
88.BrownBO,Alberts JJ,Fisher LD,et al.Regression of coronary artery disease as a resultof intensive lipid-lowering therapy in men with high levels of apolipoproteinB.N Engl J Med,1990,319:1289-1298
89.KwiterovichPO,Ir.whitxy ,Forte Tet al.Hyperapobetalipoproteinemia in a dindred withfamilial combined hyperlipidemia and rfmilial hypercholesterolemiaArtriosclerosis,1987,7:211-225
90.SandkampM,Funke H.Schulte H,K liporotein (a)Is An Iadependent risk tactor formyocardial in farction at Yong are ,Clin Chem,1990,36:20-6
91.ladiasJA,K witerovich PO,Ir,Smith H,et al.A missense mutation arinine 4019-tryptophanin apolipoprotein B in a famliy with hyperapob and premature atherosclerosis.Arteriosclersis ,1987,7:492
92.GavishD,Brinton EA,Breslow JL,Heritable allele –specisic differences in amounts ofapoB,and low-density lipoproteins in plasma.Science.1989,244:72-76
93.CoreshJ,Kwiterovich PO,Jr,Antoaradis SE,HyperapoB a pleiotropic phenotypecheracterized by dende lowdendity lipoproteins and associated with coronarydiseade .Am J Hum Genet ,1990,47(3):A130
94.TengB.Sniderman AD,Krauss RM,Modulation of apolipoprotein B antigenic determinantsin human low density lipoprtein subclasses J Biol chem,1985,260;5067-5072
95.KnighyBL,Thompson GR,Soutar AK.Binding and degradation of heavy and lighysubfractions of low density lipoprotein by cultured fibroblasts and macrophagesAtherosclerosis.1986,59:301-306.
96.WhiteR T, Damm D.Hanxock N.et al. Cell Biol.1991 in press.
第八章 脂蛋白代谢
脂蛋白是血液中脂质的运输形式,与细胞膜受体结合被摄入胞内进行代谢。
第一节 乳糜微粒代谢
CM是饮食高脂肪食物后,由肠壁细胞合成的富含TG的巨大脂蛋白,其直径为80~1000nm,在血液中的半寿期为10~15min,进食后12h内,正常人血中几乎无CM。它是在肠上皮细胞合成并分泌入淋巴管。CM含有ApoⅠ、A-Ⅱ、A-Ⅳ、和B48。ApoB48含量多少与摄取食物的TG含量有关。ApoB48是合成CM所必须的蛋白质。CM从胸导管移行入血液过程中,其载脂蛋白的组份迅速改变。CM获得ApoC和E,把ApoAⅠ,移行到HDL,脱去ApoAⅣ。进入血中的CM,被末稍血管内皮细胞表面的LPL经ApoCⅡ激活并作用于其内的TG,分解变成脂肪酸和单甘油,脂肪酸再进入肌肉、脂肪组织及心肌组织贮存或利用。CM表面的磷脂和载脂蛋白往HDL3移行,CM颗粒变小,结果转变成CM残粒,分别被肝脏LDL受体和清道夫受体识别并摄取。
CM生理功能是转运外源性脂类,主要是甘油三脂。其中TG在毛细血管里被水解成游离脂肪酸后进入各组织贮存或利用;而外源性胆固醇则全部进入肝脏,如图8-1所示。
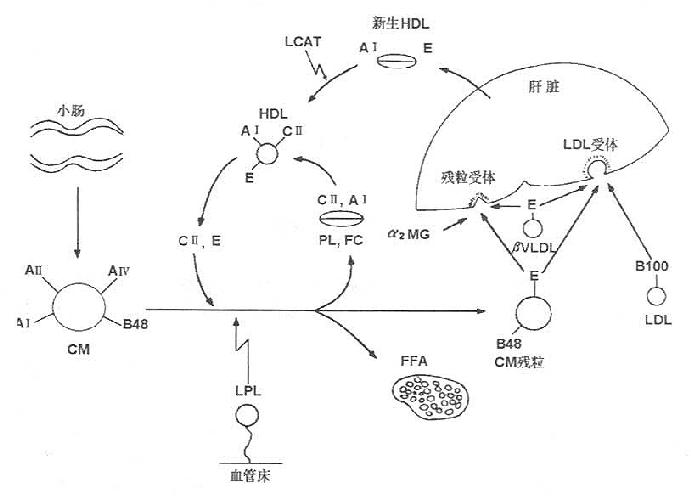
图8-1 乳糜微粒代谢
第二节 极低密度脂蛋白代谢
VLDL大小为30~80nm,含有甘油三酯,胆固醇、胆固醇酯和磷脂等脂类,其中TG占50%左右,蛋白质部分为ApoAⅠ,AⅣ,B100,C,E等。VLDL在肝脏合成,利用来自脂库的脂肪酸作为合成材料,其中胆固醇来自CM残粒及肝脏自身合成的部分。ApoB100全部由肝脏合成。肝脏合成的VLDL分泌入门静脉进入血液,由LPL水解其内的TG。HDL由来的胆固醇经LCAT作用生成的胆固醇酯,再经CETP转移给VLDL进行交换,而VLDL中余下的磷脂、ApoE、C转移给HDL,VLDL则转变成VLDL残粒,尔后大部分通过VLDL受体摄入肝脏,小部分则转变成LDL继续进行代谢。
第三节 低密度脂蛋白代谢
LDL是富含胆固醇的脂蛋白,其胆固醇主要来自从LTP转运的高密度脂蛋白中的胆固醇。目前认为血浆中LDL的来源有两条途径:主要途径是由VLDL异化代谢转变而来;次要途径是经肝脏合成后直接分泌到血液中。
LDL的降解是经LDL受体途径进行代谢。细胞膜表面的被覆陷窝是LDL受体存在的部位,即LDL的ApoB100被受体识别,将LDL结合到受体陷窝内,其后再与膜分离形成内吞泡。内吞泡内经膜H+-ATPase作用下,pH降低变酸,LDL与受体分离后又与溶酶体融合,再经酶水解产生的胆固醇进入运输小泡体,经ACAT作用再酯化而蓄积。血浆中65%~70%的LDL是依赖LDL受体清除,少部分(约1/3)被周围组织(包括血管壁)摄取异化。胆固醇能促进ACAT活性增加,与此同时,因胆固醇的增加使合成胆固醇的HMGCoA还原酶和HMGCoA合成酶等活性被抑制,LDL受体自身转录被抑制,胆固醇的合成减少或摄入进入细胞内的量也减少,胞内胆固醇降低。一旦LDL受体缺陷,VLDL残粒由正常时的大部分经肝LDL受体识别,而改为大部分转变成LDL,使血浆中LDL浓度增加。
第四节 高密度脂蛋白代谢
HDL主要由肝脏和小肠合成。肝脏合成的新生HDL以磷脂和ApoAⅠ为主。在LCAT作用下,游离胆固醇变成胆固醇酯,脂蛋白则变成成熟球形HDL3’,再经LPL作用转变成HDL2。
HDL可将蓄积于末稍组织的游离胆固醇与血循环中的脂蛋白或某些大分子结合而运送到各组织细胞,主要是肝脏,这种胆固醇被利用的过程称为胆固醇逆转运(reverse cholesterol transport, RCT)。RCT促进组织细胞内胆固醇的清除,维持细胞内胆固醇量的相对恒定,从而限制动脉粥样硬化的发生发展,起有抗动脉粥样硬化的作用。Glomest指出,LCAT通过转酯化反应完成新生盘状HDL向HDL3、HDL2的转化,减少血浆HDL中游离胆固醇的浓度,构成胆固醇从细胞膜流向血浆脂蛋白的浓度梯度,降低组织胆固醇的沉积,如图8-2所示。
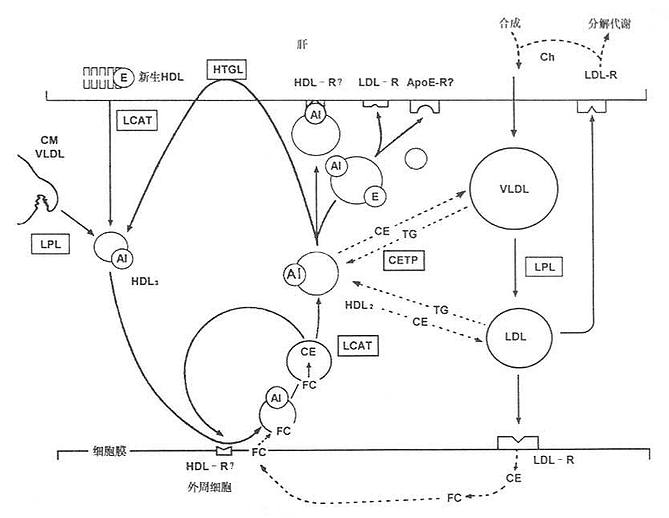
图8-2 高密度脂蛋白代谢
图中虚线为脂肪的转移途径,实线为载脂蛋白转移途径
LDL-R:LDL受体,ApoE-R:ApoE受体,HDL-R:HDL受体
第五节 脂蛋白代谢主要途径
脂蛋白代谢主要途径如图8-3所示。作为食物中的脂质有甘油三酯,胆固醇等,以TG为主。TG经胰脂肪酶水解后,经肠道吸收于肠粘膜细胞内再合成TG(外源TG),同时还有Ch、PL、ApoAⅣ、B48与之结合形成CM,进入淋巴管由胸导管再送到血液(图中1)。流入血液中的CM,从HDL接受ApoC-Ⅱ,E及CE(图中2),各脏器毛细血管内皮细胞表面的LPL被ApoC-Ⅱ活化后,水解CM的TG,(图中3),使之转变成仅有ApoB48和ApoE为主的CM残粒,被肝细胞的ApoB、E受体识别并摄取入肝细胞(图中4)。CM在血液中半寿期为5~15min,空腹时,血中一般无CM存在。
另外,体内肝脏利用糖及游离脂肪酸合成TG(内源性TG),再与Ch,ApoB100、ApoC-Ⅱ及ApoE等结合形成VLDL释放入血中(图中5)。血中VLDL,再接受HDL上转移的ApoC-Ⅱ、E(图中6)又在各组织毛细胞血管壁的LPL作用下,使其核心的TG不断水解(图中7),尔后转变成中间密度脂蛋白(IDL)或者称为VLDL残粒,大部分被肝脏摄取,也可能被肝外脏器摄取一小部分。血浆中VLDL很不均一。大颗粒的含TG高者可迅速清除,仅10%左右转变成LDL;小颗粒含TG较少的VLDL清除较慢,约40%转变成VLDL残粒,经肝细胞的LDL受体摄取(图中8);一部分又经LPL和HL作用水解TG成脂肪酸供组织细胞利用,等其表面积缩小,并变成ApoB100为主的LDL。LDL一部分经肝脏LDL受体识别摄取入肝脏(图中9);另一部分氧化后经肝及肝外组织清道夫受体识别入肝外组织细胞(图中10)。
HDL是肝脏(图中11)和小肠中(图中12)合成的一种脂蛋白,具有从末稍组织运送Ch到肝脏处理的生理功能。LCAT使卵磷脂的FFA转移到Ch上催化进行胆固醇酯化反应,HDL是其最适底物。刚合成分泌的HDL为新生HDL,呈圆形,含ApoE多,经LCAT作用转变成球状HDL3(图中13),又再转变成HDL2(图中14)。粘膜细胞也合成一部分新生HDL(图中10),HDL还可能将ApoCⅡ和ApoE转运给CM及VLDL。
脂蛋白代谢是血中脂质、脂蛋白、载脂蛋白及其受体、蛋白因子和酶相互作用并密切联系的相关代谢过程。在脂蛋白代谢过程中许多环节易出现代谢受到障碍,从而有可能导致脂蛋白代谢紊乱。
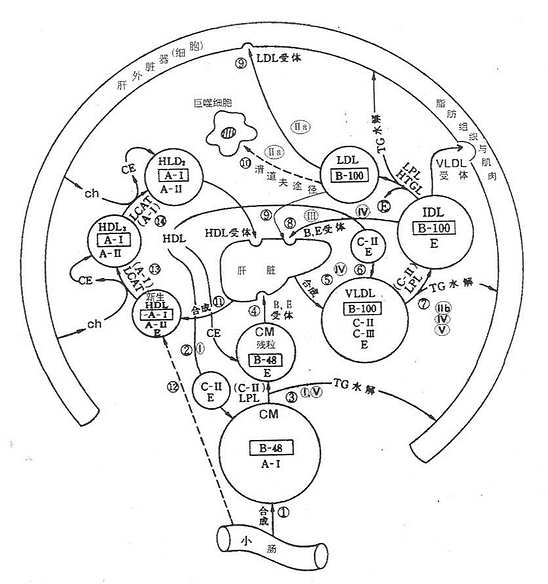
图8-3 脂蛋白的主要代谢途径示意图
Ⅰ-Ⅳ为高脂蛋白血症发生的代谢环节;○内的数字为代谢环节标记
(涂建成)
(脂蛋白代谢)参考文献
1.GoldsteinJ,Kita T,et al.Defective lipoprotein receptors and atherosclerosis:from aanimal countepart of familial hyperchoesterolemia .n Engl JMed,1983,309:288-296
2.MillerJ,Miler N.Plasma high density lipoprtein concentration and development of ischemicheart disease Lancet ,1975,1:16-19
3.PhillipsM,Jonson W ,et al.Mechanism and consequences of cellular cholesterol cxchangeand transfer .Biochim Biophys Acta,1987,906:223-276
4.YamashitaS,Sprecher D,et al.Accumulation of apolipoprotein E-rich high densitylipoproteins in hyperal phalipoproteinemic subjects with plasma cholesterylester transfer protein deficency.J Clin Invest ,1990,86:688-695
5.ScanuAM,Spector AA.Biocemistry and biology of plasma lipoproteins New York,1986
6.BrownM,Goldstein J.A receptor mediated pathway for cholesterol homeostasis.Science,1986,232:34-47
7.RosseneuM,De Bacder G,Caster H,et al.Distrbution and composition of HDL subclasses instudents whose parens suffered prematruely from a myocardial infarction in comparisonwith controls Atherosclerosis,1987,63:231-234
8.WilliamsP,Krauss R,Vranijan K,et al.Associations of ilpoproteins and apolipoproteinswith gradient gel elecrtophoresis etimates of high density lipoproteinsubfractions in men and women .Arteriosclerosis and Thrombosis,1992,12:332-340
9.HerbertK.Detection,evaluation ,and treatment of high blood cholesterol in adults(adult treatment panel Ⅱ).Circulation,1994,89:1329-1445
10.GrundySM,Role of low density lipoproteins in atherogenesis and development ofcoronary heart disease.Clin Chem,1995,41:139-146
第九章 自由基与细胞凋亡
第一节 大气氧含量的变迁
大气氧含量的变迁为生命的起源及生存创造了必须的条件。
生命的起源,历史上记录了许多企图回答这个古老的问题的答案,最具代表性的理论有三种:①特创论;②迁居论;③自然发生论。第一种解释特创论是生命起源归因于超自然力量的干预。圣经的《创世记》篇中关于创造世界的叙述就是特创论的一个例子这种理论显然是缺乏科学依据的。第二种解释是迁居论,迁居论假设认为,我位今天在地球看到的生命起源于从宇宙的另外地方的生命类型。这一假说远在19世纪经瑞典化学家Srante Arrhenius最先提出。按迁居论者认为,我们今天在地球上看到的生命。可能代表漫不经心地丢弃在垃圾里的细菌的后裔,这垃圾则是几十亿年以前从别的世界来的旅游者,在我们称之为太阳的恒星外数第三的行星(指地球)上停留期间进行野餐时遗留下来的,这种假想确实带有神话的色彩。目前的登月飞行,寻找外星有否生命存在,与迁居说有否联系,不得而知。第三种自然发生论是人们最感兴趣而有一定科学依据的假设。1924年Oparin提出生命起源于无生命物质。然而,生命的起源并不是一个能够追踪到特定的顷刻时间的突然事件。而是发生于地球上的一个经历了难以想像的漫长时间的逐渐的演变过程。Oparin和Haldane的化学进化假说新依据的设想是在适宜环境的影响下,所有这些重要的有机分子是可以形成的,并且随着时间的推移,这些分子就会发生一系列的相互作用,最后形成生命体系。当时这种假设并未被科学界马上接受,直至1953年,Stanley Miller利用自行设计的装置重建了含有甲烷、氨和水的原始地球大气,并加热到121℃(水在100℃时煮沸)24h灭菌,无菌之后,通过实验装置上部钟罩内包含的大气进行火花放电,经过七天之后,停止放电并分析实验装置中的内含物,以确定是否有有机化合物产生。七天后,在烧瓶内发现了许多象征生命系统特征的分子,有四种不同的氨基酸,尿素及其他化合物,在Miller的先驱性实验工作之后的年代中,别的实验工作在模拟原始地球的条件下,完成了不仅是简单的有机化合物,而且是更加复杂的分子生命系统中发现的原白质和核酸颇为相似。科学家们对Oparin-Haldane的生命起源假说是很认真的,他们的观点是把地球上生命的发展看作是特续达亿万年之久的化学进化过程的结果,这种观点是对生命起源的比较合理的解释。Oparin-Haldne学说的最重要的前提大气中氧气含量的变迁,为生命的起源创造了不可缺少的条件。正因为大气中氧含量经过亿万年的变迁,才进化到构成今日大气之大部分的氮气和维持生命的氧气,仅仅是原始地球大气的次要成分。因为原始地球表面是一个不毛之地的世界,它具有现在截然不同的的大气,有丰富的热能来源,它沐浴在紫外光之中,而且经受着当今世界所无法匹敌的巨大电暴。
地球上的生物在进化过程中,最初经化学进化合成简单有机物,如CH4、HCN及HCHO,从而演化产生厌氧生物。继之产生光合生物,它们利用这些有机物,并借助太阳能固定二氧化碳;其后又出现了篮藻,它是以水作为电子供体,进行光合作用生成氧的生物。篮藻使水受光氧化,造成地球大气O2的最初蓄积(图9-1)。在这之前,原始地球的大气成分中无游离O2,却含有具还原性的氢。这种环境变化,即游离O2作为光合作用副产品的不断产生,造成一种危机:生物只有逐步适应此含氧的大气才能生存,对于当时的原始生物来说,进入大气中的氧分子是一种“公害”,它使厌氧生物的生活圈逐渐限制在很狭小的范围,其巢穴越来越小。同时,因O2蓄积,形成臭氧层,290nm以下的紫外线不能到达地表,导致进入地表的能量减少,造成生物损害。结果,生活在深水中的生物生活圈必须扩大,从接近水面进而迁移到陆地,促进了对O2有抵抗性的生物的大发展。
图9-1 地球大气氧浓度的变迁
光合作用导致大气中大量蓄积O2,它不仅对厌氧生物,而且对需氧生物亦显示毒性。需氧生物不仅利用氧的过程中获得对付O2毒性的防御机能。而且还能把O2作为电子受体加以利用,获得高效率能源,使进行氧呼吸的需氧生物进化了一大步。氧气对生物的进化及生存是如此的重要,然而氧气也有对机损害的一面。主要通过氧自由基对机产生多种有利和有害的影响。
第二节 自由基的来源
一、概念
大多数化学键由双电子形成。这种键断裂时有二种可能:一种是异裂反应,成键的两个电子分给两种分裂产物之一,生成物为离子。另一种是均裂反应,两个电子均分给两个产物,此过程中产生的分裂物称为自由基(free-radical),在溶液中呈均一状态。自由基是指分子、原子或基团中有未配对电子的一类物质,如下述反应中的A·和B·,还有NO、NO2、I·及Na·等均具有未配对电子。绝大多数自由基寿命短,生成后不稳定,易被周围环境吸收。在化学反应机理的研究中,发现自由基参与的反应占相当大比例。
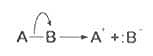
二、自由基的来源
机体在代谢中不断地产生自由基,在酶催化的电子转移及氧化还原反应中,有许多自由基中间体参与;某些药物在体内以自由基中间体的活性形式发挥作用;在光化学反应及放射中多以自由基发挥作用。生物体的自由基可通过下面几种方式产生。
(一)放射线照射
放射性可直接或间接地对生物体发生作用,α-射线具有高能粒子作用,γ-射线具有电磁波作用,使生物体组织成分的分子激励或离子化;最终是化学键被切生成自由基,使机体被损害,这是放射线对生物直接作用的结果,这种方式是少量的。生物体内含有大量水,放射线首先使水分解,产生反应性非常高的自由基如H·和·OH等,H·和·OH可产生多种效应如破坏机体各组织细胞等,这是放射线对生物间接作用的结果。
生物体还被外部宇宙线、伦琴射线以及β射线包围,使生物体沐浴在大量射线之中,因而组织易遭损伤,加快老化的过程。
(二)机体周围自由基前身物的转变
我们周围环境有各种自由基或产生自由基的多种物质存在,如较稳定的氮氧化合物NO、NO2自由基,在大气中还有汽车排出的碳化氢,空气烟雾中的氟利昂等经太阳紫外线照射及光分解产生多种碳的自由基及卤原子;大气中的臭氧也可能转变成过氧化物自由基。食物中某些成分如茶叶在空气中放置过久,自由基含量会升高,还有一些脂类含有自由基的前身物以及过氧化物、某些药物、激素和类固醇等经机体摄取后,在代谢过程中也容易产生自由基。
(三)生物体内活性氧的生成
机体在代谢中不断产生的自由基,种类繁多,其中以活性氧最多。
1.活性氧种类:氧是偶电分子,分子中存在一个σ键和两个三电子π键,其简化结构式为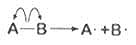 。O2可呈现两种状态,即单线态(singlet state)又称为激发态,以1O2表示;另一种为三线态(triplet state),又称为基态,以3O2表示,3O2可吸收能量变为激发态;
。O2可呈现两种状态,即单线态(singlet state)又称为激发态,以1O2表示;另一种为三线态(triplet state),又称为基态,以3O2表示,3O2可吸收能量变为激发态;
3O2+hυ→1O2
氧化能力的指标是以氧分子的还原分子之间的标准氧化还原电位(E1)而定,如图9-1所示。
图9-2 氧分子及活性氧相互间的标准氧化还原电位(pH7.0)O:1.0Atm
图9-3 脂质过氧化反应及其脂质自由基的生成(LOOH、LOO、LO·)
氧是一个重要的电子受体,因所得电子数不同,氧可产生多种还原产物:O2-、·OH及H2O2,他们的E1均比O2高,具有强的氧化能力。
O2+e→O2-
O2+2e+2H+→H2O2
O2+3e+3H+→·OH+H2O
O2+4e+4H+→2H2O
不饱和脂肪酸在1O2等作用下,被氧化成过氧化脂(LOOH),LOOH又可进一步使脂肪酸氧化,脂质过氧化反应及其脂质自由基的生成如图9-3示。
以上所述的1O2、O2-、H2O2、·OH及LOOH等统称为活性氧,但是体内不能产生活性的O2+及原子氧。
基态氧本身毒性很低,但是O2-、H2O2、·OH、1O2及LOOH毒性较大,这种活性氧的毒害作用称为氧的毒性。
2.活性氧的生成性质
(1)超氧化物自由基(O2-):O2-也可以HO2形式存在,HO2的pKa为8.4,在生理pH为7.45条件下,大部分以O2-形成存在,即HO2
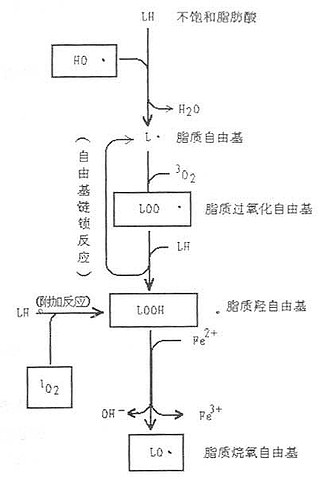
H++O2-。O2-是O2被一个电子还原生成,再由O2-产生其它活性氧,O2-是造成氧毒性的主要物质,在pH7.0时,O2-/O2和(2H+、O2-)/H2O2的E1相应为-330毫伏和+940毫伏,O2-既可起氧化作用,也可作为还原剂,当O2-作为还原剂时,产物为H2O2。
O2-的消除主要经超氧化物歧化酶(SOD)催化生成O2和H2O2:
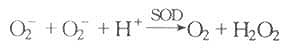
k=2.37×109M-1S-1,O2-也可自身进行歧化反应,反应速度相当慢:
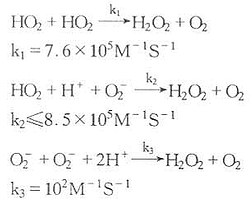
H2O2与O2-反应可生成反应性更高的HO·及1O2:
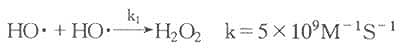
O2-可被维生素C还原生成H2O2,维生素C使O2-还原的速度常数为2.7×109M-1S-1,与SOD催化的反应速度常数相当,细胞内维生素C浓度高,因此维生素C有与SOD同等程度消除O2-的作用。O2-还可被维生素E及谷胱甘肽(GSH)还原生成H2O2,GSH的-SH还原作用约相当于SOD的10%。
由于O2-寿命短,检测有一定困难,只能用电子顺磁共振波谱(ERR)检出。
(2)过氧化氢(H2O2):H2O2可由O2-的歧化反应生成,在D-氨基酸氧化酶、L-氨基酸氧化酶、葡萄糖氧化酶及亚硫酸盐氧化酶等作用下,把O2作为电子受体,经两个电子还原生成H2O2,在线粒体中也能直接生成H2O2。H2O经放射线照射,一次生成·OH,再生成H2O2。
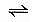
H2O2较稳定,反应性低,在体内浓度也比较低,(大鼠肝脏中为10-9M),对机体几乎无毒性;H2O2可与铁离子生成反应性非常高的·OH:
H2O2+Fe2++H+→OH+Fe3++H2O
H2O2的消除依赖于两种酶,一是过氧化氢酶,催化H2O2歧化反应:2H2O2→2H2O+O2;二是谷胱甘肽过氧化物酶。在GSH参与下使H2O2分解,GSH则变成氧化型谷胱甘肽。这两种酶可消除体内H2O2及过氧化物,防止血红蛋白及肝细胞膜部分被氧化破坏的可能。
(3)氢氧自由基(·OH):体内·OH从O2直接生成的反应尚不清楚,机体可由O2-生成系与H2O2生成系共同形成·OH自由基。水经放射线照射后的一级反应产物是·OH,由于·OH氧化能力很强,因此对机体毒性很大。
H2O2+Fe2++H+→OH+Fe3++H2O
H2O2+O2-+H+→·OH+H2O+O2-
·OH在水中寿命很短,一般不易以自旋共振(ESR)方法检出,有人利用DMPO(5,5-二甲基-1-吡咯啉-N-氧化物)作自旋捕获,成功地检出白细胞内产生的·OH,因DMPO与·OH形成一个较稳定的加成物DMPO-HO·。另外也可采用生物反应检出。
(4)单线态分子氧(1O2):1O2是一个强的亲电子性的氧化剂,可用化学方法生成,也可由H2O2经氧化生成,即H2O2由次氯酸氧化生成1O2:
NaClO+H2O2→1O2+NaCl+H2O2
1O2可与芳香族碳氢化合物进行一系列的反应。
1O2可将能量转移给其他物质而变成3O2,在此过程中,物质(A)作为1O2的淬灭剂,接受能量变为激发态(A*),然后以热的形式放出能量回到基态A。水也可作为1O2的淬灭剂。
由于1O2在水中寿命短,要检测出1O2有一定困难,最直接的证明是经1O2→3O2+hυ的化学发光观察,1O2单分子发光波长为1269微米及760微米。1O2的寿命在D2O中比在水中长10倍,以此均可证明1O2的存在。最近有人利用光子计数器检测微粒体中产生的1O2已获得成功。
(5)过氧化脂类:人体内主要有亚油酸、亚麻酸及花生四烯酸,多以磷脂形式存在于质膜等生物膜中。这些不饱和脂肪酸可受1O2氧化,也可经·OH氧化生成过氧化脂质,生物膜上脂类既可在O2-作用下生成过氧化脂质(LO·、LOO·、LOOH),也可经放射线照射生成脂类自由基(L·),这种在脂类中微量存在的L·,在氧参与下进行链锁反应,加速过氧化过程,如图9-3所示。过氧化脂质化学性质活泼,易进一步使脂类分解引起自由基反应,也可使GSH氧化,而本身变成较稳定的脂类羟基化合物(LOOH)。
氧自由基的生成、氧化还原及激发过程如图9-4所示。
第三节 由基的防御作用
生物体内具有防御自由基毒害的抗氧化剂或抗氧化酶。
一、超氧化物歧化酶作用
SOD是催化O2-歧化反应的酶类,这种歧化反应属于自身氧化还原反应,O2-的歧化反应在H-存在下,经SOD催化,一半O2-氧化为O2,O2-的另一半还原为O22-。
SOD+O2-→SOD-+O2
SOD-+O2-+2H+→SOD+H2O2
(SOD:氧化型,SOD-:还原型)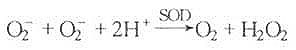
SOD是生物对抗O2-毒性的酶,产物之一H2O2又可与O2-相互作用(Haber-Weins反应)产生OH·,借以清除细胞内O2-。缺氧条件下,培养的大肠杆菌里SOD含量少;有氧条件下,培养的大肠杆菌里SOD含量高。如果将上述两种大肠杆菌置于20个大气压的O2及N2条件下培养,当即见到无O2条件下预先培养的大肠杆菌迅速死亡;有O2条件下,预先培养的大肠杆菌对O2有抵抗性,因此,SOD在防止O2-的毒性方面具有重要意义。
SOD有含Cu、Zn的SOD(Cu、Zn-SOD),含Fe的SOD(Fe-SOD)及含Mn的SOD(MnSOD)三种存在形式。生物界中,细菌等原核生物及线粒体含有Fe-SOD和Mn-SOD,与高等动物所含的Cu、Zn-SOD相比,其蛋白质部分截然不同。目前从牛红细胞中提取了比较多的Cu、Zn-SOD,其结晶纯品已开始用于临床。各种SOD进行的歧化反应稍有不同,Fielden等测出Cu、Zn-SOD中的Cu有1/4处于还原不被氧化状态,这是因为有一部分Cu与O2-进行反应,另一部分处于非反应状态。
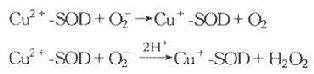
Pick等测出大肠杆菌的Mn-SOD对O21的催化反应有两种速度,推测Mn-SOD以三种形式存在并参与反应。
Fe-SOD参与反应的机制与Cu、Zn-SOD一样按两步进行:
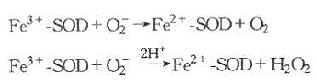
SOD生理功能可归纳为:保护细胞,对抗氧的毒性;有助于H2O2浓度的调节,对付微生物的侵害。
二、维生素E的作用
维生素E又名生育酚,天然的生育酚有七种,其中分布最广泛的是α-生育粉,具有抗氧化作用。维生素E可抑制肝细胞内微粒体的过氧化脂类的生成。据报道,给予鼠维生素E有延长寿命的作用,在胎儿成纤维细胞传代培养中,给予维生素E者,传代数增加,可抑制过氧化脂类生成,其原因是作为生物体内自由基淬灭自由基(LOO·)生成的苯羟自由基的过程可被巯基化合物还原,特别是被GSH还原成生育酚,从而使生育酚能更有效的发挥作用。
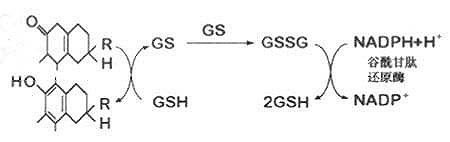
维生素C也有与维生素E同样的作用,然而维生素E是脂容性,维生素C是水溶性,基作用场所不同,维生素C可使水中自由基淬灭,在防止膜受攻击上有重要意义。
三、过氧化氢酶、过氧化物酶的作用
体内H2O2可被氧化酶和氧化物酶转变为H2O2消除H2O2的毒性。过氧化氢酶可催化两两分子H2O2生成H2O2和O2过氧化物酶利用H2O2直接胺类等物质,某些组织中含有一种含硒的谷胱氧化酶,可使LOOH或H2O2与GSH反应将LOOH变成无毒的醇类。
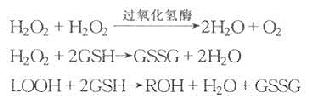
活性氧的代谢途径及清除体系如图9-5所示。
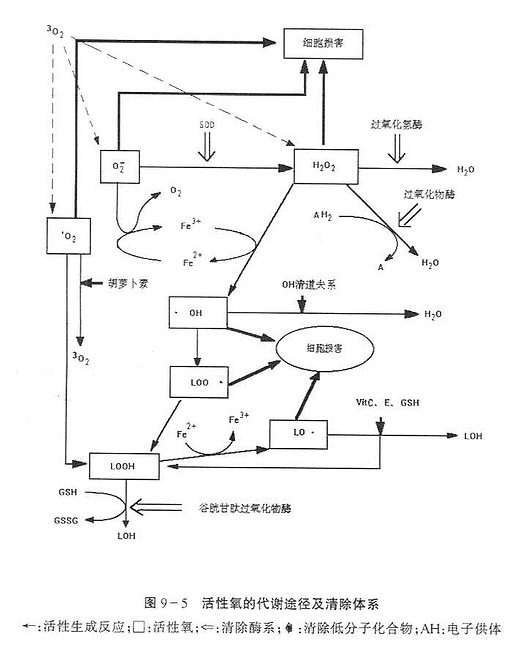
图9-5 活性氧的代谢途径及清除体系
←:活性生成反应;□:活性氧;:清除酶系;AH:清除低分子化合物;AH:电子供体
第四节 氧化低密度脂蛋白
天然的低密度脂蛋白(LDL)经氧化修饰形成的脂蛋白,称为氧化低密度脂蛋白(OxLDL)。天然LDL核心的脂肪酸中含有大量不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)约占LDL总脂肪酸含量的35%~70%,所以容易发生自身氧化。
LDL中的PUFAs在自由基或其他氧化剂作用下,生成脂类自由基,并能产生更多的过氧化脂质,引起连锁的自由基链式反应,最终生成多种反应性的醛。这些化学性质活泼的醛和ApoB发生结合,产生新的抗原决定簇,形成氧化LDL。OxLDL与动脉粥样硬化关系密切。
一、修饰的LDL与巨噬细胞泡沫化
从动脉粥样硬化发病机制,我们不难发现LDL在动脉粥样硬化发生、发展中起非常重要的作用。
(一)内皮细胞俘获LDL和巨噬细胞泡沫化
高脂血症、脂质代谢失常是动脉粥样硬化的重要病因。血浆中增多的脂质以LDL的形式经完整的内膜侵入内皮下,这一过程呈现LDL浓度依赖性,无需受体介导。另有观点认为,机械因子、化学因子、免疫因子、毒素或感染因子对内皮的损伤,导致LDL-胆固醇摄取增多。这又反过来会改变内皮细胞和循环血细胞(单核细胞、血小板)的表面特性,促进单核细胞粘附于血管内皮,并转变为巨噬细胞,转变后的巨噬细胞更有能力摄取更多的脂质,在内皮下被俘获的天然的LDL可以经历两种形式的修饰,即衍化和氧化,如图9-6所示。
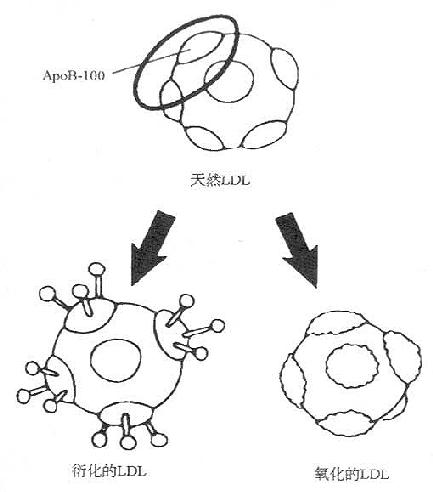
图9-6 LDL的修饰在内皮下间隙,被俘获的天然的LDL可能经历两种形式的修饰-衍化(MAD粘附于ApoB-100或者ApoB-100的糖基化)、氧化(ApoB-100被过氧化物降解),分别形成衍化的LDL和氧化的LDL。
天然LDL在正常情况下,由LDL受体识别。LDL和LDL受体结合后,内吞入细胞,与溶酶体结合。在溶酶体酶的作用下,蛋白质降解为氨基酸,胆固醇酯水解为游离胆固醇和脂肪酸。此受体受到细胞内胆固醇含量的下降调节,当细胞内胆固醇的含量增多时,LDL受体的量便会减少。所以,天然LDL经这一途径代谢,不会引起胆固醇酯在细胞内堆积。
LDL还可以通过清道夫受体途径代谢。这一受体主要参与修饰的LDL的代谢,没有下降调节的特点,不受细胞内胆固醇的含量的应答。通过此途径,修饰LDL被摄取和降解的速度都比正常LDL快。所以LDL这一代谢途径直接参与动脉粥样硬化中泡沫细胞的形成,如图9-7所示。
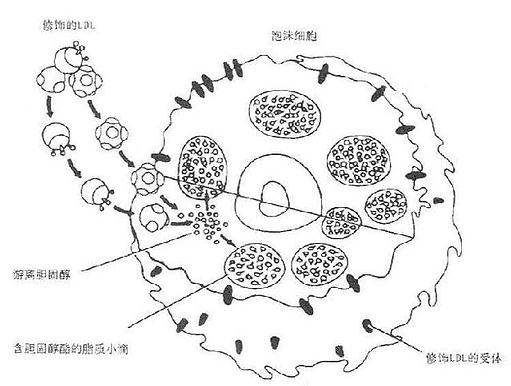
图9-7 泡沫细胞的形成巨噬细胞通过修饰LDL受体途径摄取(消化)修饰的LDL。导致大量的负荷脂质的小滴进入,泡沫细胞的形成是动脉粥样硬化进程中脂肪纹形成的标志。
(二)LDL的氧化修饰
1.LDL氧化修饰的形式
(1)细胞介导的LDL氧化修饰
1981年,Henriksen等人将兔主动脉内皮细胞和LDL孵育一段时间后,发现该LDL被巨噬细胞摄取的速度较未与内皮细胞共同孵育的LDL快,而且在孵育的基质中发现了硫代巴比妥酸反应物(TBARS),据此,认为内皮细胞可以氧化修饰LDL。这是细胞介导的LDL氧化修饰,又称生物氧化修饰的LDL。后来发现除内皮细胞外,巨噬细胞、血管内膜平滑肌细胞、单核细胞都可以氧化修饰LDL。
(2)过度金属离子介导的LDL氧化修饰
过度金属离子Ca2+、Fe2+等,在体外适宜条件下与LDL孵育一段时间后,也能使LDL发生氧化变构。因为这是利用化学物质氧化LDL,故称为化学氧化修饰的LDL。
(3)其他形式的氧化修饰
还可以使用物理学方法如紫外线、钴60对LDL进行氧化修饰。利用过氧化酶类也可能使LDL转变成OxLDL。
2.氧化修饰的过程
LDL的氧化可人为划分为三个阶段。最初为迟滞阶段,消耗内源性抗氧化剂(VitE);增殖阶段,PUFAs快速氧化为脂质氢过氧化物;分解阶段,脂质氢过氧化物转变为反庆性的醛。这些醛包括丙二醛(MDA)、4-羟烯酸(4-HNE)等,并可以和ApoB发生共价结合(主要和ApoB的赖氨酸残基结合),形成新的抗原决定簇。OxLDL丧失与天然LDL受体结合的能力,被清道夫受体所识别。
3.氧化修饰后LDL理化的生物学特性
OxLDL不同于天然LDL。OxLDL内维生素E含量下降,游离氨基减少,琼脂糖电泳速率增快。LDL中所含的大量卵磷脂转变为溶血卵磷脂。氧化修饰程度低时,ApoB以分解为主。修饰程度高时,降解的ApoB又可重新聚合成大分子。氧化LDL还具有一系列生物学毒性作用。氧化修饰后的LDL不能经LDL受体代谢,由清道夫受体识别、结合、内吞饮入细胞并丧失正常的胆固醇代谢途径,引起细胞内脂质沉积,泡沫样变。
4.修饰的LDL和氧化修饰的LDL的区别和联系
氧化的LDL是修饰LDL中的一类。修饰的LDL除包括氧化修饰的LDL外,还包括乙酰化LDL及丙二醛、4-羟烯酸直接结合的LDL,我们称这些未经氧化修饰,而仅经一般化学修饰的LDL为衍化的LDL。
衍化的LDL和OxLDL都可以被清道夫受体识别,导致泡沫细胞的形成。在过去的很长一段时间里,我们将一般化学修饰的衍化的LDL和OxLDL混为一谈。特别是认为氧化LDL就是MDA-LDL。但实际上,MDA-LDL不同于OxLDL。
用Ca2+引发LDL的氧化修饰,比较氧化修饰的LDL与脂质过氧化降解产物MDA修饰的LDL之间的差别。发现氧化修饰LDL和MDA修饰LDL都产生类似于脂褐质的荧光物质,都可使LDL上的游离氨基减少,琼脂糖电泳速度加快,且游离氨基减少量与电泳迁移率增加呈正相关。但两类不同的修饰LDL之间也有差异,主要表现在:①对细胞生理功能影响不同。氧化LDL可诱发细胞毒性作用,影响花生四烯酸的代谢,抑制胆固醇酯化作用等,而一般化学修饰的LDL则无上述效应;②氧化修饰消耗LDL内源性抗氧化物质,使LDL上的维生素E含量下降,而MDA修饰无上述改变;③氧化修饰涉及脂质过氧化反应,LDL中的PUFAs被氧化。MDA对LDL修饰,是直接和ApoB-100结合成希夫氏碱,脂质过氧化反应轻微;④氧化LDL在氧化程度低时,ApoB降解,在氧化程度高时,ApoB又可发生再聚合。MDA对LDL的修饰,ApoB无降解、聚合反应发生;⑤氧化LDL产生的荧光峰波长为430nm,而MDA修饰LDL的荧光峰波长为460nm。这些差异可能是由于两类不同的修饰对LDL结构与组成影响不同,提示我们不能简单地把脂质过氧化降解产物修饰的LDL等同于OxLDL。
二、氧化LDL的代谢
OxLDL由清道夫受体识别并进一步代谢。清道夫受体可能是多种受体的总称,据报道,除乙酰化LDL的受体外,Fcr受体和CD36受体也能介导OxLDL的摄取和降解。现已证实分离纯化的清道夫受体是由3个λkD的亚单位构成的糖蛋白,存在于细胞表面,聚丙烯酰胺凝胶电泳测得分子量为2.2×105左右。清道夫受体可以和乙酰化LDL、OxLDL以及诸如次黄嘌呤核苷酸、丝氨酸磷脂等配体结合。这些物质的共同特点为多阴离子化合物。正常LDL受体是通过识别ApoB上由赖氨酸、精氨酸、组氨酸共同构成的正电荷区与LDL结合的。LDL氧化后,产生的反应性醛和LDL的ApoB的赖氨酸残基的ε氨基结合,使LDL失去一些正电荷,带上多量负电荷。这样OxLDL不能再被LDL受体识别,而被清道夫受体结合。而且OxLDL摄入速度是天然LDL的3~10倍,并且不受细胞内胆固醇含量的应答。
巨噬细胞和内皮细胞对不同氧化程度的LDL的结合和降解量是不同的。总的来说,随着氧化修饰程度的升高,巨噬细胞和内皮细胞对LDL的结合和降解随之升高。将LDL与Ca2+孵育,LDL经氧化后得到琼脂糖迁移率(Rf)分别为1.33、1.67、2.33的氧化LDL。研究巨噬细胞和内皮细胞对这几种不同氧化程度的LDL的结合和降解,发现当LDL修饰程度很低(Rf=1.33)时,OxLDL被巨噬细胞结合和降解的量接近、甚至低于天然LDL,而当修饰程度高时,被巨噬细胞和内皮细胞结合和降解的量随之升高,而且明显高于正常LDL(图9-8、图9-9、图9-10、图9-11)。
另有报道,正常细胞摄取OxLDL时,LDL受体与清道夫受体起协同作用。因为氧化程度不同。OxLDL的ApoB上可能残留多少不等的LDL受体识别位点。用单抗封闭这些位点时,细胞对OxLDL结合量和降解量下降。
三、OxLDL存在的可能性
(一)动脉粥样硬化损伤灶存在OxLDL
有学者发现人、兔动脉粥样硬化斑块处分离出的LDL的特性与OxLDL相似,包括电泳速度加快、ApoB降解等。而正常动脉壁处LDL无此特性。
最近,生产出的针对MDA-ApoB的单克隆抗体和MDA-VLDL、MDA-HDL、MDA-白蛋白不发生交叉反应。利用特异性抗原抗体反应推测来源于冠心病人的组织标本,发现在平滑肌细胞、巨噬细胞来源的泡沫细胞中和斑块核心脂质中都有免疫反应发生,而且在人、兔的动脉粥样硬化病灶区存在抗OxLDL的自身抗体。
(二)血浆中是否存在OxLDL
抗MDA-LDL自身抗体的滴度可用来预测冠状动脉粥样硬化进展。然而这些抗体和蛋白质(如蛋白)中MDA-赖氨酸加合物发生交叉反应。目前,尚没有血浆中存在OxLDL的直接证据,血浆中存在脂质过氧化物和TBARS,它们的含量可以用脂质TBARS荧光微量测定法测量。它们可能是氧化LDL的裂解片段。
有学者制备抗OxLDL的单抗,推测血浆中OxLDL的含量,并通过临床试验证实冠心病患者血浆中OxLDL浓度高于正常人。然而,由于血浆中是否存在OxLDL有待证实,故这种检测方法是否能够用于动脉粥样硬化的辅助诊断有待证实。
四、OxLDL与动脉粥样硬化
OxLDL可以通过以下途径促进动脉粥样硬化的发生、发展。
(一)参与泡沫细胞的形成
在早期的动脉粥样硬化损伤中,发现负荷脂质的泡沫细胞在动脉内膜下集聚。这些泡沫细胞主要来源于摄取OxLDL的单核/巨噬细胞。内皮下泡沫细胞的堆积在动脉粥硬化起因中有关键作用。
MarileeLoughecd等认为氧化LDL能抵抗组蛋白酶,从而抵抗溶酶体对OxLDL的降解,在细胞内堆积。当然,细胞内胆固醇量对清道夫受体的非下降调节是细胞泡沫化的主导原因。这些泡沫细胞以大量的二级溶酶体和胞浆脂滴为特点。脂质在泡沫细胞中沉积的结果使得动脉壁从最初的脂肪纹发展到更复杂的纤维斑块和粥样斑块。这些斑块最外层富含巨噬细胞来源的泡沫细胞,易于发生斑块破裂,引起血栓形成。
(二)促进细胞粘附和巨噬细胞源性泡沫细胞的产生
1.促进单核细胞的粘附和泡沫细胞的产生
单核细胞对动脉内皮粘附的增多是实验动物动脉粥样硬化早期表现之一。氧化LDL可以通过剌激细胞间粘附分子-1(ICAM-1)表达,使单核细胞,中性白细胞和淋巴细胞与内皮结合的数量增多,而且这种结合表现出高亲和力。还可以剌激内皮白细胞粘附分子-1(VCAM-Ⅰ)的表达,导致单核细胞的粘附移行。而且,OxLDL还能促使内皮细胞和血小板产生一种分子量为140kDa的颗粒膜蛋白(GMP140)。这种颗粒膜蛋白能在细胞激活的基础上快速翻译到细胞膜上,结合中性白细胞和单核细胞。微氧化的LDL,不能被清道夫受体识别,但它已能剌激特定的单核细胞粘附分子的表达。
单核细胞粘附于内皮后移行入内膜。内皮细胞、平滑肌细胞和巨噬细胞分泌特定趋化剂,如单核细胞趋化剂1(MCP-1),MCP-1的合成受OxLDL的剌激。
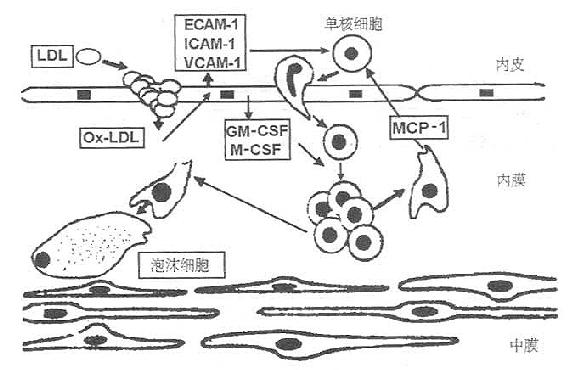
图9-8 单核细胞源泡沫细胞的产生
ECAM-1,内皮白细胞粘附分子-1 1CAM-1,细胞间粘附分子-1
VCAM-1,血管细胞粘附分子-1MCP-1,单核细胞趋化蛋白-1
M-CSF,单核细胞集落剌激因子 GM-CSF,粒细胞-单核细胞集落剌激因子
氧化LDL剌激内皮细胞分泌粘附分子(ECAM-1、ICAM-1、VCAM-1),内膜单核细胞的增生受特定集落刺激因子(GM-CSF、M-CSF)的诱导。继而单核细胞分化为巨噬细胞并分泌特异的针对单核细胞的趋化剂(MCP-1)。进而,巨噬细胞通过清道夫受体聚积OxLDL,转变为泡沫细胞。
OxLDL激活内皮细胞,促使趋化因子、粘附分子、粒细胞一单核细胞集落剌激因子(GMCSF)和单核细胞集落剌激因子(M-CSF)分泌。所有这一切都会剌激巨噬细胞的增生和分化。M-CSF诱导巨噬细胞表面清道夫受体的表达,使OxLDL摄取增多,巨噬细胞泡沫化(图9-8)。
2.促进中性白细胞粘附
研究发现注射OxLDL,可在体外诱导内皮结合白细胞,Lehr等人进一步证实这一作用涉及血小板活性因子受体和CD11b/CD18粘附受体复合物。
(三)诱导平滑肌细胞增生、移行,产生平滑肌细胞源性泡沫细胞
OxLDL通过诱导巨噬细胞和平滑肌细胞产生血小板源生长因子(PDGF),促进平滑肌细胞移行。通过诱导内皮细胞产生碱性成纤维细胞生长因子(bFGF),促进平滑肌细胞增生。最终,OxLDL诱导平滑肌细胞表面清道夫受体的表达,导致平滑肌细胞内吞OxLDL,继而产生平滑肌源性泡沫细胞(图9-9)。
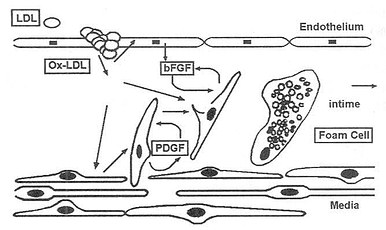
图9-9 平滑肌细胞源泡沫细胞的产生
bFGF,碱性成纤维细胞生长因子
PDGF,血小板源生长因子
OxLDL引起平滑肌细胞从中膜移行入内膜,结果内膜增厚。激活平滑肌细胞和巨噬细胞分泌PDGF和bFGF,它们可诱导平滑肌细胞增生和移行。而且bFGF诱导清道夫受体表达。通过这些受体,平滑肌细胞聚积OxLDL,转变成泡沫细胞。
(四)促进血小板粘附、聚集、血栓形成
OxLDL抑制内皮细胞衍生的舒张因子(EDRF)或NO的合成,损伤动脉壁正常的舒张功能。而且OxLDL中的溶血卵磷脂诱导合成内皮细胞衍生的收缩因子(EDCF),诱使血管收缩。
氧化LDL可以促使血小板聚集、增强花生四烯酸代谢及血栓素B2(TXB2)的产生,减少膜脂流动性。OxLDL抑制前列腺素I2合成酶,使前列腺素I2(PGI2)合成减少,激活血小板环氧化酶,使血栓素A2(TXA2)产生增加,破坏了PGI2/TXA2平衡,促进血小板聚集,引起血管痉挛和血栓形成。
(五)损伤内皮细胞
内皮细胞的损伤和功能改变是动脉粥样硬化发生的基础。内皮细胞的损伤在动脉粥样硬化的发病机理中作为起始机制,被认为具有重要作用。多种研究提示内皮细胞对自由基和脂质过氧化作用非常敏感。
LDL氧化过程中产生的脂氢过氧化物可以直接损伤内皮细胞。OxLDL可使内皮细胞对LDL的通透性增高,胞浆发生空泡变性,浆膜皱缩,甚至可使细胞最终坏死。内皮细胞受损又使内皮细胞保护剂PGI2的合成进一步减少,促进中性粒细胞对内皮的粘着及呼吸爆发,促进血小板在内皮聚集、释放O2-,进一步加重内皮损伤。
OxLDL对细胞的毒性无需受体介导。细胞对OxLDL的易感性取决于细胞分裂所处的细胞周期和细胞内谷胱甘肽的含量。丙丁酚可转移并渗入细胞膜作为一种捕捉自由基的抗氧化剂对抗氧化压力。细胞和OxLDL孵育会使基质中TBARS增多。这以上二点似乎提示内皮细胞膜自由基反应特别是脂质过氧化,与OxLDL激发的内皮细胞损伤有关。内皮细胞膜脂质过氧化降低膜脂质流动性,增加膜对离子渗透性,抑制膜结合酶活性。OxLDL怎样诱导细胞膜脂质过氧化,还不清楚。
(六)产生抗OxLDL的自身抗体
在兔和人的血清中都发现了抗OxLDL的自身抗体,且抗体的滴度和心血管动脉粥样硬化进程密切相关,表明免疫机制在动脉粥样硬化发病机理中起了作用。
最近还发现粥样斑块区的炎性浸润物包含T淋巴细胞和B淋巴细胞。这些T淋巴细胞主要是由局部抗原激活的淋巴细胞。斑块区沉积的胆固醇还能通过诱导人类主要组织相容性Ⅱ类抗原表达,加强巨噬细胞呈递抗原的功能。
OxLDL通过以上多种途径在动脉粥样硬化的起始和进展中发挥了举足轻重的作用。
既然OxLDL和动脉粥样硬化的关系如此密切,那么抗LDL的氧化修饰就成为阻断动脉粥样硬化进程的关键环节。有可靠的证据表明LDL的氧化修饰,只有在LDL内源性、亲脂性抗氧化剂消耗殆尽后才会发生,其中维生素E作为第一线抗氧化剂,β-胡罗卜素作为抗LDL氧化的最后一层屏障。如果的确是这样,就可以解释摄食的抗氧化剂的血浆水平为什么和心血管疾病的危险性呈负相关。流行病学研究也进一步表明血浆中维生素E水平高的人群,心血管疾病患病的危险性低。这些研究给动脉粥样硬化的预防和治疗提供了新的思路。
第五节 一氧化氮
Humphrey于1935年在研究“笑气”(N2O)时发现一氧化氮(nitricoxide,NO)以来,NO一直被看作是对生物有毒的简单无机分子。NO在常温下为气体,水中溶解度很小,仅1mmol/L,极易透过细胞膜扩散,NO拥有额外电子,具有高度的化学反应能力,在生物组织中半寿期仅有几秒种。近年来研究表明,NO作为可能的突触前递质和突触后逆信使在神经系统信息传递和发音中起作用;NO作为生物信使分子也在机体免疫和血液血压调节中起着重要作用。
一、NO的自由性质
在NO分子中,N原子外层有五个电子,O原子外层有六个电子,形成共价键后,在分子轨道上含有不成对电子(:N::O:),因此它是自由基,不稳定,半寿期短,易生成过氧亚硝基阴离子ONOO-,质子化后很快分解生成HO和NO2自由基,在生物体内还可生成一系列的具有生物功能的自由基和硝基化合物。
二、NO的生成
NO在体内经一氧化氮合酶(nitricoxide synthase,NOS)的作用才能生成。NOS以L-精氨酸(L-Arg)和分子氧为底物,尼克酰胺腺嘌呤二核苷酸磷酸(NADPH)为辅因子提供电子,由黄素腺嘌呤二核苷酸(FAD)和四喋呤传递电子,生成中间体对羟基-精氨酸,然后形成NO和L-胍氨酸(L-Citr),其中NOS是NO生成的最主要的限速因子。

三、一氧化氮合酶
NOS由1025个氨基酸残基组成,分子量为13.3kD。NOS广泛分布于机体内。按其存在的细胞类型不同,NOS可以为三种类型,即神经型NOS(nNOS)、内皮型NOS(eNOS)和诱导型NOS(iNOS)。nNOS存在于视网膜、植物神经纤维、大脑皮层、海马、垂体后叶、丘脑、嗅球区粒细胞层、骨骼肌细胞和平滑肌细胞。iNOS存在于肝细胞、单核巨噬细胞、内皮细胞和成纤维细胞。eNOS存在于血管内皮、支气管内皮和海马锥体细胞层。按同工酶分类,NOS可分为同工酶Ⅰ(NOSⅠ),又称为神经型(nNOS),主要分布在神经元的上皮细胞中。同工酶Ⅱ(NOSⅡ),又称为诱导型(iNOS),主要分布在细胞因子诱导的巨噬细胞中;同工酶Ⅲ(NOSⅢ)又称为内皮型(eNOS),主要分布在内皮细胞中。
利用特异的DNA探针已经证明NOSⅠ、Ⅱ、Ⅲ基因分别定位于12号(12q24.2~24.3)、17号(17p11~17q11)、7号(7q35~36)染色体。
根据克隆及cDNA结果推测,NOSⅠ的mRNA长度>10kb,而其编码基因>100kb,其基因详细结构不清楚。人NOSⅡ基因全长37kb,由26个外显子组成,人NOSⅢ基因全长21kb,由26个外显子组成。
第六节 自由基与细胞凋亡
细胞凋亡(apoptosis)是细胞的主动死亡,它参与机体许多生理和病理过程,并起着调节作用。
一、细胞凋亡
细胞凋亡是Kerr等于1972年首先提出的一种不同于细胞坏死的细胞死亡方式,它具有特征性形态和生化改变,是细胞自身主动死亡的过程,又称为程序性细胞死亡(programmed cell death, PCD),生命体内细胞死亡有两种完全不同的形式,当细胞遭受急性和严重损害时,细胞肿胀破裂,胞液外溢导致周围组织发生炎症,即坏死过程。细胞在正常死亡时,出现细胞收缩,细胞核成片状,电镜可见到细胞膜上有很多的小泡生成。DNA电泳区带呈梯状,这种方式称为细胞凋亡。细胞凋亡是指细胞在生理和病理情况下的一种死亡模式,参与胚胎发育及变形胸腺细胞的克隆选择、细胞介导的细胞毒作用、衰老造血细胞的清除、肿瘤发生、人类免疫缺陷、病毒感染及化学治疗等。因此,对细胞凋亡的研究成为免疫学、细胞生物学、肿瘤学和分子生物学等领域的热门课题。
二、细胞凋亡与自由基作用的关系
众所周知,氧化还原反应是人体内最为广泛和重要的化学反应,自由基尤其是活性氧(reactive oxygen species, ROS)及其衍生物自由基是氧化反应中的重要成分。ROS与衰老密切相关,而衰老细胞的死亡实质上就是细胞凋亡。
目前,研究较多的肿瘤坏死因子(tumor necrosis factor, TNF)是由巨噬细胞和单核细胞产生,激活TNF受体可使细胞内ROS明显增加。体外试验表明TNF能诱导细胞凋亡,细胞对TNF的敏感性还与SOD的降低有关,如缺乏SOD的T细胞对TNF、电离辐射和高温引起的细胞凋亡更敏感。
据报道,能引起细胞氧化的因素均能引起细胞凋亡。电离辐射和紫外线照射能通过直接攻击水分子而在水中产生·OH,并能诱导细胞凋亡,如图9-10所示。H2O2在体内Fe2+分子反应生成超氧阴离子O2-和H2O2,通过对巨噬细胞和单核细胞的研究,Albina等提出NO也是细胞凋亡的诱导剂。抗肿瘤药物如阿霉素和顺铂等虽然本身不是自由基,但是它们可以引起ROS的增加;而另一种药物如Bathionine Sulfoxamine等则能消耗细胞内GSH,两类抗肿瘤药物能使细胞对多种因素诱导的细胞凋亡更敏感。
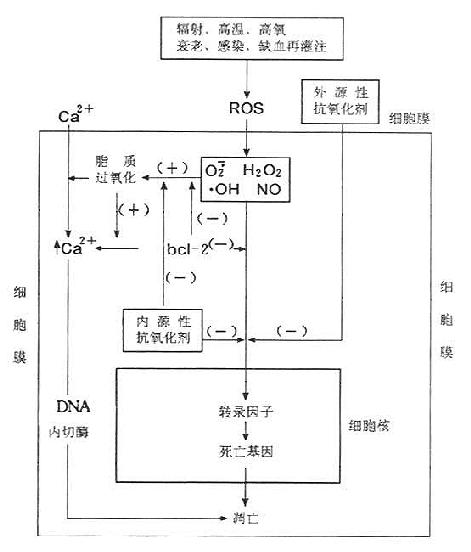
图9-10 氧化诱导细胞凋亡的机制及其调节
(源自:陆怡等生物化学与生物物理进展.23(2))
现已报道,有25个癌基因与细胞凋亡有关。与自由基尤其是氧化关系最密切的是bcl-2基因,bcl-2基因是人类发现的第一个死亡抑制基因。已证实,bcl-2基因表达能抑制多种因素(电离辐射、高温、GSH合成抑制剂、生长因子缺乏)引起的细胞凋亡,其机制不清,Kane等报导,bcl-2的表达并不能增加细胞SOD活性,可能是通过阻断电子传递链中ROS的产生,或者起了ROS清除剂的作用而调节细胞的氧化还原状态,从而调节细胞凋亡。
三、细胞凋亡相关基因
细胞凋亡相关基因大致可分为两大类,即凋亡促进(apoptosis on)基因和凋亡抑制(apoptosis off )基因。它们分别起着促进凋亡和抑制凋亡的作用,彼此之间还存在一定的相互关联。
1.凋亡促进基因
凋亡促进基因有ced-3,4、p53、ICE、Bax、bcl-Xs、TGFβ等。其中ced-3,4是在线虫索中发现的,而p53、ICE等存在于哺乳动物中。p53为肿瘤的抑制基因,分为两型,一型是使细胞周期停止在GI期,抑制细胞繁殖的野生型;另一型是具有突变能力的变异型。野生型p53可诱导易感细胞发生凋亡。白介素1β转换酶(interlukin 1-β-converting enzyme, ICE),与线虫细胞凋亡相关基因ced-3有较高的同源性,具有直接诱导细胞凋亡的作用。Bax和bcl-Xs均为bcl-2基因家族成员,两者可结合形成二聚体或异体二聚体,两者之间的比例决定了细胞的命运。若Bax占多数,则bcl-2被抑制,诱导细胞死亡;反之,则Bax受到抑制,细胞得以生存。
2.凋亡抑制基因
凋亡抑制基因包括bcl-2、ced-9、bcl-X,其中最主要也是当前研究最多的是bcl-2,bcl-2是癌基因的一种,在人体多种形态的肿瘤中过度表达,可抑制由多种剌激包括化疗和放疗引起的细胞凋亡。bcl-2常在淋巴细胞系统(胸腺、脾、淋巴结)和神经系统(右脑、中脑,小脑)中表达,抑制该部位的细胞凋亡。淋巴性白血病细胞中bcl-2也是过度表达的。Bcl-X1也是bcl-2家族成员,是由bcl-X编码的两种不同bcl-XmRNA而产生。bcl-X1有抑制神经细胞凋亡的作用。
四、细胞凋亡与脂质代谢紊乱的关系
Forrest等[3]发现H2O2诱导的细胞凋亡中,让H2O2作用于细胞膜两h后,用膜保护剂Trolox(VitE类似物)能阻止细胞凋亡的发生。由于ROS很容易与膜的多聚不饱和脂肪酸(PUFA)和胆固醇反应,引起氧化链式反应,因此膜脂质过氧化以后才有DNA损伤、细胞损害。最近Isabelle等[5]报道,氧化低密度脂蛋白(OxLDL)可诱导细胞凋亡。
自由基尤其是ROS具有很强的生物活性,很容易与生物大分子反应,直接损害或者通过一系列过氧化链式反应而引起广泛的生物结构的破坏。为了减少有氧代谢过程中自由基对细胞的损害,细胞内有一系列有效的抗氧化防御机制,包括清除ROS的SOD、过氧化氢酶(CAT),谷胱甘肽过氧化物酶(GSHPX)、硫氧还原蛋白(phioredoxin)等和阻断过氧化链式反应的生育酚、胡罗卜素和抗坏血酸等。通常细胞处于氧化与抗氧化平衡中而维持着正常的功能。一旦氧化与抗氧化作用失衡,细胞的功能将会受到影响,细胞凋亡可能就是这种失衡的结局之一。
(周翔 郑芳)
(自由基与细胞凋亡)参考文献
1.周新,自由基及其对机体作用,见:徐学峰主编,生理生化学与医学(第二版),北京:科学出版社,1987年,504-515
2.周新,红细胞代谢的某些进展,见:生物科学参考资料(第七集)。北京:科学出版社,1977,23-41
3.周新,超氧化物歧化酶化与活性氧,国外医学分子生物学分册,1980,2:84-89
4.惠宏襄,赵小宁,金明,等,自由基与细胞凋亡,生物化学与生物物理进展,1996,23:12-16
5.陆怡,潘华珍,许彩民,氧化与细胞凋亡,生物化学与生理进展,1996,23:118-121
6.Southorn PA,Powis G,Free radicals in Medicne Ⅱ,Involvement in Human Disease MayoClin Proc,1988,63:390-408
7.MitchelJD,et al.Cu/Zu Superoxide dismutase ,free radicals ,and motor neurone disease.Lancet ,1993,342:1051-1054
8.FecondoJV,Auqusteyn R,Superoxide dismutase ,catalase and glutathione peroxidase in thehuman cetaractous lens.Exp Eye Res,1983,36:15-23
9.HalliwellB,et al.Free radicals and human disease where are we now J.Lab ClinMed,1992,119-:598-620
10.LeffJA,et al .Serum antioxidants as predictors of adult tespiratory distresssgndrome in patients with sepsis,Lancet ,1993,341:777-780
11.RimmEB,et al .Vitamin E consumption and the risk of coronary heart disease in menNew Eng J Med ,1993,328:450-456
12.WitztumJL,Steinberg D.Role of low density lipoprotein in atherogenesis .J ClinInvest,1991,88:1785-1792
13,NeveJ.et al Usual values for selenium and glutathione peroxidase in a belgianpoprlation .Am Biol Chem,1989,47:138-143
14.BlockG.A role for antioxidants in reducing cancer risk .Nutr Rev,1992,50:207-213
15.CeruttiPA.Oxy radicals and cancer .Lancet ,1994,344:862-863.
16.StampferM,et al.Vitamin E consumption and the risk of coronary disease in women.New EngJ Med ,1993:1444-19449
17.PetersenRC,Smith,G,Irnik RJ,et al .Apolipoprtein E statrs as a predictor of thederelopment of Alzheimer’s disease in memory impaired inpedualsJAMA,1995,273:1274-1278
第十章 脂类代谢紊乱
临床上对脂质代谢紊乱的认识与血浆脂质及脂蛋白、载脂蛋白的测定方法的发展密不可分。50年代只能测定血浆胆固醇的含量以确诊高胆固醇血症。到60年代初期血浆甘油三酯测定方法的应用,使研究者把高脂血症分为三种:高胆固醇血症、高甘油三酯血症、高胆固醇血症合并高甘油三酯血症。60年代纸上电泳技术得到改进,提高了对血浆脂蛋白的分辨力和检出率。可将血浆脂蛋白分为α-脂蛋白、前β-脂蛋白、β-脂蛋白及乳糜微粒四种,并通过密度梯度离心,明确了血浆脂质是以脂蛋白的形式存在,临床上逐渐用高脂蛋白血症代替高脂血症。1967年Fredrickson等用改进的纸上电泳分离血浆脂蛋白,将高脂血症分为五种类型,即Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ。1970年WHO加以改进,将Ⅱ型分为Ⅱa和Ⅱb,共六型。这些标志着对脂类代谢与动脉粥样硬化关系的研究已从血浆脂质水平发展到血浆脂蛋白水平。
但是血浆高脂蛋白血症分型,经各国实验研究及临床工作者应用,发现其存在局限性,如高脂蛋白血症分型仅以表型分类。不能反应其病因,HDL含量改变也未包括在内。1973年Goldstein和Brown对细胞膜LDL受体的研究成果表明,对脂质代谢与动脉粥样硬化关系的研究从脂蛋白水平进入载脂蛋白的分子水平,并发现了多种载脂蛋白缺乏或缺陷的疾患。近年来,为了便于从分子水平研究脂质代谢紊乱,主张以载脂蛋白的改变作为异常脂蛋白血症分类的依据,以完善1970年WHO的分型法。故本章主要介绍脂蛋白和载脂蛋白,以兼顾习惯用法和发展趋势。
第一节 高脂血症
高脂血症(hyperlipidemia)是指血中脂类浓度升高。血浆中主要脂类有总胆固醇即游离胆固醇和胆固醇酯、甘油三酯。当其中一种或几种脂类升高均称为高脂血症。
高脂血症中90%以上是高脂蛋白血症。测定血浆胆固醇和甘油三酯浓度即可诊断高脂蛋白血症。最主要的例外是LDL增加伴随HDL降低,对这种个体所测定血浆胆固醇和甘油三酯水平均无法解释这一现象。
NIH认为成人血清胆固醇超过5.18mmol/L应开始治疗。而血甘油三酯超过4.52mmol/L 即可认为是高于正常,一旦超过11.29mmol/L,认为患急性胰腺炎的危险很大。当血胆固醇和/或甘油三酯超过极限,为了预防和降低冠心病发病率,应开始进行饮食疗法。此外并发其他危险因素。如遗传、高血压、吸烟和肥胖者,若血清总胆固醇浓度低于3.89mmol/L的个体则发生动脉粥样硬化的可能性很小。
第二节 高脂蛋白血症
高脂蛋白血症(hyperlipoproteinemia)指的是血清脂蛋白浓度升高。根据异常脂蛋白的表型,辅以其他方法对高脂蛋白血症进行分类。如将高脂蛋白血症分为原发性和继发性,继发性高脂蛋白血症是指由其他已知疾病引起的高脂蛋白血症;也分为遗传性的和非遗传性;还可根据脂蛋白组分含量的不同进行分类,如高VLDL胆固醇血症、高LDL胆固醇和高HDL胆固醇血症。
表10-1 继发性高脂蛋白血症的病因
| 表型 | 病因 |
| 高乳糜微粒血症 | 胰岛素依赖性糖尿病 异常球蛋白血症 盘状红斑狼疮 胰腺炎 |
| 高β脂蛋白血症 | 肾病综合症 胸腺机能减退 阻塞性肝病 卟啉尿 多发性骨髓瘤 门脉性肝硬变 急性病毒性肝炎 粘液性水肿 应激反应 神经性厌食 自发性高钙血症 |
| 甲状腺机能减退 异常r球蛋白血症 粘液性水肿 原发性胆硬变 糖尿病酸中毒 | |
| 高前β脂蛋白血症 | 糖尿病 肾病综合症 妊娠 激素治疗(如口服避孕药) 糖原积累病 酒精中毒 高雪氏病 尼曼-皮克氏病 胰腺炎 甲状腺机能减退 异常球蛋白血症 |
| 混合型脂蛋白血症 | 胰岛素依赖性糖尿病 肾病综合症 酒精中毒 骨髓瘤 自发性高钙血症 胰腺炎 巨球蛋白血症 糖尿病(胰岛素非依赖型) |
高脂蛋白血症的类型很多,但主要是遗传性高脂血症,共有六种常见异常脂蛋白类型,可用表10-1来概括。主要用四种脂蛋白系列中的三种即乳糜微粒、VLDL和LDL(包括IDL)作为依据来划分。Fredrickson表型分类系统没有考虑HDL和其他脂蛋白的重要性。最近世界范围的流行病学调查发现HDL胆固醇浓度与冠心病风险存在有统计上的负相关系。因此,测定LDL胆固醇和HDL胆固醇可从侧面反映血中脂蛋白的水平。
临床上,高脂蛋白血症的分类主要依靠血浆脂类及异常脂蛋白的电泳图谱,进行综合分类,如表10-2所示。每型的琼脂糖脂蛋白电泳分类图见图10-1。
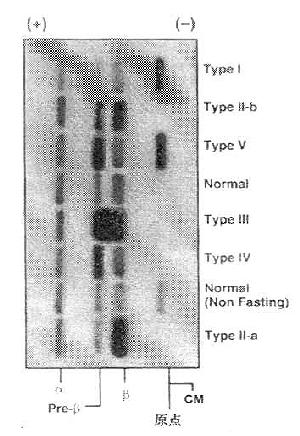
图10-1 高脂血症的脂蛋白琼脂糖电泳图
表10-2 人高脂血症分型及其特征
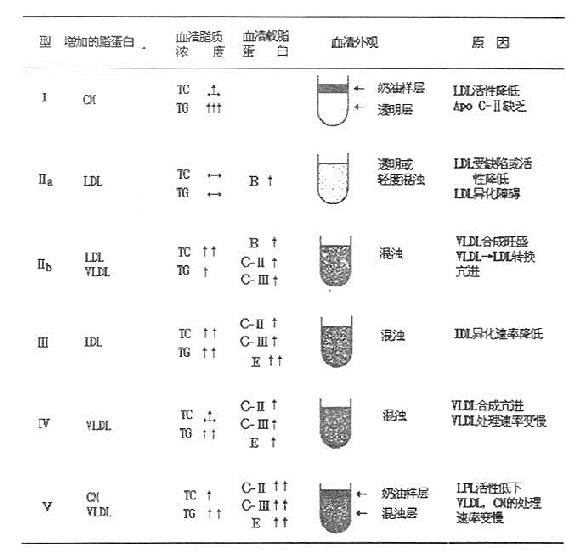
一、高乳糜微粒血症
高乳糜微粒血症(hyperchylomicronemia)患者新鲜血清外观呈乳白色混浊,4℃冷藏过夜血清外观:上层因有乳糜微粒漂浮而呈现糜状,下层清亮透明状。本症为常染色体隐性遗传,家族遗传性纯合子型患者除血脂改变外,临床症状也明显。而杂合子患者,虽呈现高甘油三酯血症,但症状不显着。
因乳糜微粒含量增加的缘故,该型脂蛋白异常以高血甘油三酯浓度为特征,一般高于11.29mmol/L。因乳糜微粒也含胆固醇,其胆固醇随甘油三酯升高亦增加,LDL和HDL通常偏低,而VLDL可轻度增加。
由于肝外组织脂蛋白脂肪酶活性缺陷,从肠粘膜细胞输入血液中的乳糜微粒不能经脂肪组织进行正常的分解代谢,使血中乳糜微粒贮留。近年来从载脂蛋白的角度研究证实,此类患者ApoCⅡ含量不足,不能激活脂蛋白脂肪酶,为其主要病因。CM中TG不能水解转变成CM残粒,无法被LDL受体识别摄取进行代谢,从而造成CM在血液中堆积。
原发性高乳糜微粒血症常在儿童期发病。虽然这种脂蛋白异常常为原发性和家族性,但也可由几种其他疾病或代谢状态而引起。因此,应排除继发性脂蛋白异常的可能性(见表10-1)。
排除继发性原因后,原发性可根据如下表现进行证实:①脸黄疣、肝脾肿大、视网膜脂血、腹痛和早发胰腺炎;②服药可引起继发性高甘油三酯血症;③血浆甘油三酯脂酶活性降低;④无脂肪饮食甘油三酯降低和乳糜微粒消失;⑤家系分析证实为常染色体隐性遗传。
当今降脂药对降低血清甘油三酯无效,因此治疗这种异常症只能采用低脂肪饮食,因乳糜微粒随进食脂肪的消化而产生,治疗方法是将饮食脂肪降到占总能量消耗的10%,可在24h内降低血清甘油三酯,一般是先将血清甘油三酯降到11.29mmol/L以下,从而降低急性胰腺炎的发病风险。第二步再降至正常。一般推荐健康人甘油三酯水平<2.26mmol/L,如表10-3所示。
表10-3 NECP推荐甘油三酯风险分级
| 甘油三酯(mmol/L) | 风 险 |
| <2.26 | 正 常 |
| 2.26~4.52 | 较 高 |
| 4.52~11.29 | 高 |
| >11.29 | 很 高 |
二、高β脂蛋白血症
高β脂蛋白血症(hyperbetalipoproteinemia)的特点为血浆胆固醇浓度升高而甘油三酯大多正常,血清外观清晰属于Ⅱa型,又称为家族性高胆固醇血症,血清脂蛋白电泳呈现浓染的β-脂蛋白带,提示脂蛋白升高,故又称为高β脂蛋白血症。引起原发性高胆固醇血症的原因有:①VLDL产生过多;②VLDL转换成LDL速率增加;③LDL含胆固醇酯过多;④LDL结构缺陷;⑤每个细胞上LDL受体数量减少或活性降低。据估计约50%的胆固醇浓度改变是由遗传决定的,脂蛋白电泳图谱显示β-脂蛋白升高而前β-脂蛋白正常,该病有如下特征:①培养的成纤维细胞上有功能的LDL受体数量减少,此项具有确诊价值,具体有LDL受体缺乏、LDL受体缺陷和入胞缺陷三种表现;②婴儿呈现Ⅱ型表现;③严重者有黄色瘤;④30~40岁者,常见有早发冠心病。
胸腺机能减退、急性卟啉综合症、异常γ球蛋白血症、阻塞性肝病、高饱和脂肪和胆固醇饮食引起的继发性高β脂蛋白血症与原发性高β脂蛋白血症区分开来。原发性高β脂蛋白血症可用下面几条确证:①家系分析,包括儿童;②连续8周进低胆固醇(<300mg/日),高多不饱和脂肪酸饮食(多不饱和/饱和脂肪酸为1:1.2)后仍有顽固性高胆固醇血症;③腱黄瘤、黄色瘤和角膜弓的出现;④LDL受体缺乏或缺陷。
家族性高胆固醇血症(12.95~38.85mmol/L)需要特殊治疗。除了下面要提到的饮食疗法和药物疗法外,很多家族性高胆固醇血症病人要求每3~4周滤出血浆中的LDL。特别严重则应进行肝移植。对非家族性高胆固醇血症,第一步治疗是严格降低饮食脂肪。如没有效果,可用降脂药。
食物疗法的目的在于保持充足营养前提下降低血LDL胆固醇。NECP成人治疗小组推荐食物疗法分两步,病人体重过重时应降低总脂肪和饱和脂肪酸及胆固醇的摄入,降低体重,这一步是通过降血压、升HDL胆固醇、降低糖尿病发病率来降低冠心病发病率,第一步食物疗法开始4~6周后检测LDL胆固醇和HDL-胆固醇水平,3个月后继续监测。如降胆固醇目的未达到,病人应接受第二步疗法。
如食物疗法没有效果,应用药物治疗,降胆固醇药物包括胆酸多价螯合剂(消胆胺或Cholestipol);HMG-CoA还原酶抑制剂,如Lovastatin(Mevacor)、Prarastatin(Pravacol)、Simvastatin(Zocor)、Fluvastatin(Lescol)、烟酸和Probucol。药物降脂效果应在4~6周和3月进行监测。
三、复合性高脂蛋白血症
家族性复合性高脂蛋白血症(combinedhyperlipoproteinemia)的特点有:①培养的患者成纤维细胞LDL受体数目正常;②儿童缺乏高β脂蛋白带;③很早即出现高甘油三酯血症;④患者家系连续几代出现多种脂蛋白异常图谱;⑤通常为高β脂蛋白且伴有高胆固醇血症,如图10-2所示。
复合性高脂蛋白血症最常见的原发性高脂蛋白血症之一。在一个家系内脂蛋白表型散在分布,病人的LDL和VLDL同时升高。同一个家族中,高β脂蛋白血症和前β脂蛋白血症可分别存在于不同病人中。复合性家族性高脂蛋白血症一般要到成年时才能发现。临床上,这种病人冠心病发病率增加,常伴糖尿病,有高尿酸血倾向,而肌腱炎和结节黄色瘤发病率相对较低。家族性复合高脂血症的遗传方式还未确定。
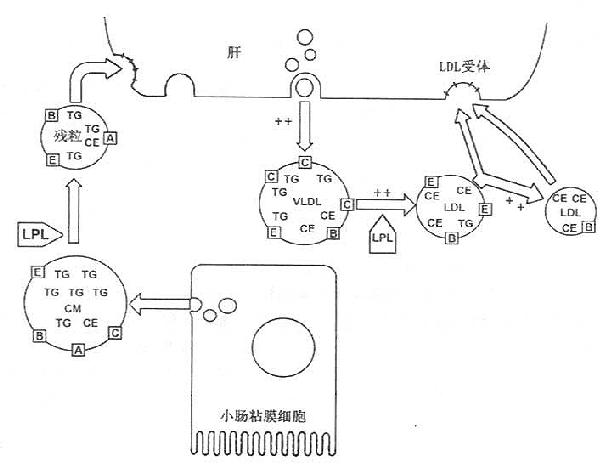
图10-2 家族性复合型高脂血症与高载脂蛋白
β-脂蛋白血症的脂蛋白代谢
ApoB异化正常,因VLDL的ApoB合成亢进,促使
LDL的ApoB再次合成增加
这种脂蛋白异常的特点是:总胆固醇、LDL、甘油三酯、VLDL等升高,有漂浮β脂蛋白出现。血浆电泳图谱中,除β-脂蛋白增高外,前β脂蛋白含量升高,但二者并不融合,又称为Ⅱb型高脂血症。Ⅱb型与Ⅱa型的主要区别是LDL受体活性正常,患者多合并肥胖,糖代谢及胰岛素分泌异常。Ⅱb型为显性遗传性疾患。本病VLDL合成量过多,ApoB100合成量比正常高两倍,LDL也增高,另外VLDL合成增加的同时,VLDL代谢分解速度并未增强,从而使过量合成的VLDL不能加速分解,造成血浆中VLDL蓄积,同时LDL代谢速度也减慢。在确诊本型原发性脂蛋白异常时必须排除继发性高胆固醇和高甘油三酯的病因,应进行家系分析,应了解影响甘油三酯的因素。人群调查研究表明,随着年龄增加,甘油三酯水平也增加,四分之一的中年男性的甘油三酯超过规定的极限值,这说明甘油三酯极限值虽有统计意义,但不能代表其生理极限。
在评估该型脂蛋白异常时,应考虑食物中碳水化合物的作用。据报道,高甘油三酯血症患者禁食后可因进食碳水化合物而产生本型的电泳图谱。因此,确诊复合性高脂蛋白血症不能象β脂蛋白血症或高前β脂蛋白血症一样仅用脂蛋白电泳即可确诊。下面要提到的宽β脂蛋白血症不再被认为是独特的和纯合子的家族性高胆固醇血症,而是由高浓度的Lp(α)或称“沉淀性”前β脂蛋白引起的,电泳图谱易与复合性高脂血症相混淆。
对复合性高脂蛋白血症的治疗应集中在降LDL-胆固醇和甘油三酯浓度。降LDL-胆固醇的方案在高β-脂蛋白血症中已详述。降甘油三酯和VLDL胆固醇稍有区别,先进行食物疗法,关键是碳水化合物和能量,要求限制乙醇、加强体育锻炼、控制体重。当病人有很高甘油三酯时需用药物治疗。降甘油三酯药物有安妥明和Gemfibrizol,它们同时可使VLDL和LDL胆固醇也随之降低。治疗复合性高脂血症的药物常选烟酸,它能有效降胆固醇(LDL胆固醇)和甘油三酯,同时升高HDL胆固醇。
四、异常β脂蛋白血症
异常β脂蛋白血症(dysbetalipoproteinemia),也称阔或宽β脂蛋白血症。主要特征是血浆胆固醇和甘油三酯升高、异常LDL(更确切地说是IDL处于密度<1.006g/ml组分中)。这种异常LDL常与前β带融合产生“阔β带”,因而出现β-移动度的VLDL,故又称为高β-VLDL血症。用超速离心法测量密度小于1.006g/ml组分的脂固醇和甘油三酯有助于异常β脂蛋白血症的确诊。
测定密度小于1.006g/ml组分的脂蛋白组成比单纯用电泳测定漂浮β脂蛋白来诊断异常β脂蛋白血症更可靠。临床上,当甘油三脂浓度在1.68mmol/L以上时,用血浆VLDL-胆固醇/甘油三酯来区分这种高脂蛋白血症,若甘油三酯超过11.29mmol/L时易出现错误的诊断。有主张以VLDL-胆固醇/甘油三酯≥0.3诊断为异常β脂蛋白血症;比值在0.25~0.29时为可疑,再用等电聚焦检测ApoE的E2~E3进行证实。该型又称为Ⅲ型高脂血症,属显性遗传。多见于ApoE2/E2型,LDL受体的结合能力仅是ApoE2/E3型的20%~40%。其代谢改变是:①β-VLDL经肝脏的ApoE受体清除受阻;②肝脏从CM残粒获得的外源性胆固醇减少,自身合成Ch并分泌VLDL增多,使VLDL过度生成而堆积于血浆;③LPL活性降低,VLDL在体外不能转变成LDL,Ⅲ型患者除β-VLDL出现外,Ch和TG均升高如图10-2所示,Ⅲ型比较罕见。
临床上,本病因年龄、性别和肥胖程度不同而表现不一。还与胸腺机能减退和酒精中毒有关。阔β脂蛋白血症引起的黄色瘤称为斑状黄瘤(xanthoma striatum palmare),这种桔黄色或黄色掌斑状黄色瘤是最轻微的损害,很容易发现。如进一步发展可产生旋涡状突起甚至掌纹消失和数字式皱折。轻者损伤存在于局部掌面,严重者产生结节,更甚者使手掌残废。
阔β脂蛋白血症与冠心病正相关,可用饮食疗法和药物疗法治疗。这种脂蛋白异常与心血管病的联系明显不同于其他家族性高β脂蛋白血症与心血管病的联系,本型对外周血管损害与心血管病的损害或冠心病一样多见。继发性阔β脂蛋白血症常由胸腺机能不全、痛风、糖尿病和急性肾功衰接受血液透析引起。
五、高前β脂蛋白血症
阔β脂蛋白血症(hyperprebetalipoproteinemia)也称内源性高脂血症或碳水化合物诱导的高脂血症,很多学者不再接受后一种说法,因碳水化合物诱导的高甘油三酯血症也可在正常脂代谢个体中出现。
根据甘油三酯浓度增加,总胆固醇正常或中度升高、血浆4℃静置10~12h没有乳糜微粒可对高前β脂蛋白症作出初步诊断属于Ⅳ型高脂蛋白血症或者称为高VLDL血症。电泳后有明显的前β脂蛋白带、浓染、增宽,而LDL胆固醇仍在正常范围,还可用生化指标用来证实高前β脂蛋白血症。确定高前β脂蛋白血症后,应进一步区分是原发性还是继发性的。
原发性高前β脂蛋白血症的诊断标准如下:①高前β脂蛋白的电泳图谱;②VLDL胆固醇升高;③一个或更多一级亲属有这种异常;④近亲没有其他原发性脂蛋白异常。
治疗方案在复合性高脂血症中已详述。
六、混合性高脂蛋白血症
电泳图谱呈现乳糜微粒及前β-脂蛋白染色带的浓染。属于高乳糜微粒和高前β脂蛋白二者都存在的混合型高脂蛋白血症(mixedHyperlipoproteinemia),即Ⅴ型高脂血症。将患者血清置4℃冷藏10h后发现血清上层有漂浮的奶油盖状乳糜微粒层形成奶油盖,下层呈混浊状,属于罕见的血清外观。甘油三酯水平与高CM血症相似。血LDL-C和HDL-C低于正常,Ch在正常范围,VLDL-C超出正常范围,VLDL-C/VLDL-TG低于0.3。若给予患者注射肝素后,血清CM消失。与Ⅲ型不同点是Ⅴ型人血清VLDL-C/VLDL-TG在0.3以上。该型患者,若仅是LPL活性降低,属显性遗传;若既有LPL活性降低又有ApoCⅡ减少,则属于隐性遗传,常于20岁前发病,家族史明显的Ⅴ型者,丘疹状黄色瘤的发病率可高达30%~50%,并伴有急性胰腺炎和肝脾肿大。因ApoCⅡ缺乏,LPL活性降低,VLDL生成过多而代谢速率降低等原因导致VLDL在血浆中堆积。
这一类型脂蛋白异常,常见腹部症状,有胰腺炎、疹样黄色瘤、脂质肾炎、肝脾肿大。与高乳糜微粒血症相反,本型好发生于成年人,一般50~60岁发病,女性发病迟于男性。
`此型也可由很多不同疾病、药物、饮食习惯等原因引起,故应仔细区分原发性和继发性。分析饮酒史,服用雌激素或固醇药物,进行尿液分析,检测禁食或餐后2h血糖和肝、甲状腺、肾功能均有助于区分原发性和继发性的诊断。
混合型高脂蛋白血症的生化缺陷仍不是很清楚。患者体内VLDL合成过剩,分解代谢迟缓,同时乳糜微粒分解代谢也缓慢,致使该型出现高CM血症与高VLDL血症混合存在。
唯一治疗高乳糜微粒的方法是低脂肪饮食。用限制饮食来减轻体重以治疗混合型高脂蛋白血症可取得很好疗效。也可用如下药物进行治疗:烟酸、novethindroml、oxandrolone、benzafibrate、gemfibrizol或clofibrate。
七、高HDL血症
有报道,血浆HDL含量过高导致高HDL血症,也属于病理状态,HDL具有抗动脉粥样硬化作用,是人们公认的,然而并非血浆HDL含量越高越好,血浆HDL-胆固醇(HDL-C)含量超过2.59mmol/dl定义为高HDL血症,现已查明,高HDL血症是因为有CETP和HTGL等活性异常所致,高HDL血症又分为原发性和继发性,原发性高HDL血症的病因有以下几种①CETP缺损;②HTGL活性降低;③以及其他不明原因。继发性高HDL血症病因有:运动失调;饮酒过量;④原发性胆汁性肝硬化;⑤治疗高脂血症的药物引起;⑥其他原因。总之,CETP及HTGL活性降低是引起高HDL血症主要的原因。CETP缺陷,HDL上的CE蓄积,使HDL增多;若HTGL活性降低,HTGL与HDL被肝细胞摄取并使HDL2→HDL3转换过程有关。HTGL活性降低使HDL被肝细胞摄取量减少而停留在血液中并使其浓度增加,出现高HDL血症。血清中总胆固醇轻度或中度升高,HDL-C高达正常人3~5倍的高值,血清ApoAⅠ、CⅢ,E明显增加,ApoB呈低值。CE量增加,因为CETP活性低,从HDL转运到含ApoB的脂蛋白的CE量减少,即运输障碍所致。高HDL血症多见于CETP缺乏者,易出现多分散LDL,而HDL颗粒变大,有实验表明,CETP活性低的动物作胆固醇负荷实验很容易形成动脉粥样硬化,对人而言,高HDL血症与动脉粥样硬化的关系有待进一步研究。
HDL按超速离心法可分为HDL2和HDL3,Blanche及Albers等报道,用聚丙烯酰胺梯度凝胶电泳可将HDL分为HDL1,2a,2b,3a,3b,3c六种亚组份颗粒,如图10-4所示。健康人HDL3c Stokes直径7.8nm;HDL3b为8.4mn;HDL3a为9.0mn,HDL2a为9.6nm和HDL2b为10.8nm。并报道冠心病患者大型颗粒HDL2b减少,小颗粒HDL3b增加,认为HDL2b的上升有抗动脉粥样硬化的作用,HDL3b颗粒的增加与动脉粥样硬化形成有关,进而推测高HDL3b血症中若是HDL3b组份增加者,则可以引起脂质代谢障碍。
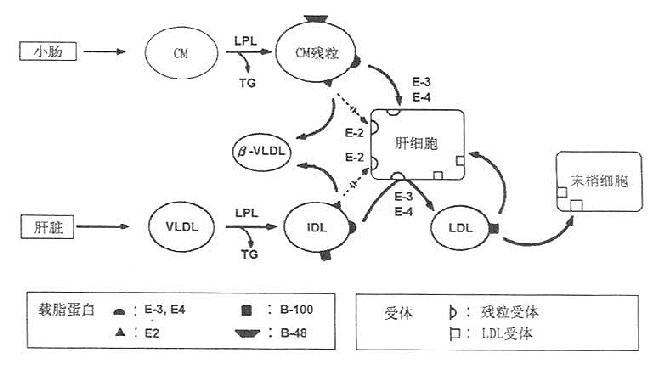
图10-3 富含TG脂蛋白的代谢与Ⅲ型高脂血症发病机制
近期有作者提出HDL-C与长寿的问题。Jeffery等于1996年报告的一例59岁的妇女,血胆固醇为9.1mmol/L,HDL-C为5.7mmol/L、LDL-C为2.8mmol/L,TC与HDL-C的比值为1.6(心血管病危险因素比值为5.0),ApoAⅠ含量超过正常对照者。该患者经其他有关的物理检查,未发现有任何动脉粥样硬化的征兆。将患者血浆ApoAⅠ提纯作体内的代谢研究提示,患者血浆ApoAⅠ的清除率是正常的,并诊断为高α-脂蛋白(HDL)血症。经家族史调查,该妇女父母亲及外祖父均为长寿者,尚未发现与脂代谢有关的疾患。
该例提示了长寿的遗传倾向问题。导致动脉粥样硬化形式的因素是多方面的,环境因素与遗传因素对其病理生理的过程具有重要影响。众所周知,环境因素与吸烟、饱和脂肪酸和食物胆固醇消耗以及营养过剩,均与症状性心血管病的发生有关。同样,基因变异所致的LDL-C极度增高HDL-C总量低下均可加速动脉粥样硬化的形成。1988年leaf报道百岁老人的共同特点是每日体力劳动和低饱和脂肪饮食。Schaefer等于1989年报导,80岁以上的长者均无血浆HDL-C含减少,并认为HDL-C与长寿有关。Gofman报导,提高HDL-C基因可以防止动脉粥样硬化的发生,为此提出,通过基因能否预防动脉粥样硬化的问题。流行病学研究表明HDL-C浓度愈高,发生心血管病的危险性愈低。根据Framingham的1988年的报道,HDL-C含量为1.5mmol/L或更高者,即使同时有HDL-C的增高,对心血管病的发生LDL-C仍属于阴性危险因素。此外,降低LDL-C浓度的干预试验提示,HDL-C可以提供相对的保护作用,LDL-C浓度降1%,可使心血管危险性降低2%;然而HDL-C浓度增加1%,则使心血管病发病率至少降低2%~3%。该研究表明,HDL-C对心血管疾病确实有预防作用。
临床已注意到HDL-C的预防作用。HDL的生理功能是通过HDL中各组份介导的。HDL的主要载脂蛋白是ApoAⅠ、AⅡ,ApoAⅠ在肝和肠内合成,ApoAⅡ仅在肝内合成。HDL中各不同密度的颗粒,其载脂蛋白组成是有差异的。含有AⅠ颗粒而不含AⅡ颗粒,称为脂蛋白AⅠ唯一颗粒,代号为LpAⅠ-Only particles,该颗粒可以防止心血管疾病。其他各种蛋白质,也可影响HDL颗粒的成份和代谢,LCAT和HL是HDL中脂质代谢调节中心,CTP在该颗粒核心内,以TG从易致粥样硬化的含有ApoB的脂蛋白中交换胆固醇酯。血小板活化因子酰转移酶能使HDL和LDL中的磷脂生成具有生物活性的溶血磷脂酰胆碱及小板活化因子(PAF)。还有系列活性代谢酶,可以保护HDL的脂质受氧化性损伤,从而增强HDL对心脏的保护功能。
目前所知,HDL-C浓度升高有三种遗传原因。其一是遗传性ApoAⅠ基因过度表达;其二是家族性高α脂蛋白血症,这两种遗传因素导致HDL-C浓度升高,ApoAⅠ含量增加,使心血管发病率降低;其三是CTP基因突变,使胆固醇酯在血浆脂蛋白中与甘油三酯交换能力降低,进而导致HDL-C浓度增高。有报导,CTP缺乏的纯合子个体,HDL-C浓度可超过3.9mmol/L,与此相反,在ApoAⅠ产生过多的患者,HDL浓度过高则是HDL从血液循环中清除过缓所致。然而HDL浓度增高可防止早发性心血管病,还有待证实。
HDL可以通过不同的机理发挥作用。它能影响血管舒缩力或诱导内皮细胞增殖,有助于动脉壁对抗内皮下组织直接暴露于血循环所致的损伤;HDL又能缓冲LDL的氧化;HDL能清除自由基保护LDL免遭氧化的损害。HDL可清除细胞内过多的胆固醇,以减少粥样硬化斑的形成。其中的ApoAⅠ基因过表达可使HDL-C浓度增加并减弱粥样化的发展。ApoAⅠ基因可能是一种杂交基因(Methuselah genes),该基因可以改变动脉粥样硬化的慢性病的多种遗传因子的性状。ApoAⅠ基因过度表达能降低心血管疾病发病率的事实,指示可以通过基因传递技术的使用,使人们可以采用各种杂交基因治疗甚至预防心脑血管性疾病。
Fredrickson于1963年将高脂蛋白血症分为六型,在临床诊治疾病过程中有一定的意义,然而从临床实验室诊断方法学考虑,作脂蛋白检测有一定难度,电泳分离法欠准确,按超速离心法,操作时间过长,难以快速定量。另外,高脂蛋白血症多数与遗传有关,目前可采用载脂蛋白基因分型。载脂蛋白的基因分型是目前研究脂质代谢及探讨动脉粥样硬化发病机制的热门话题。
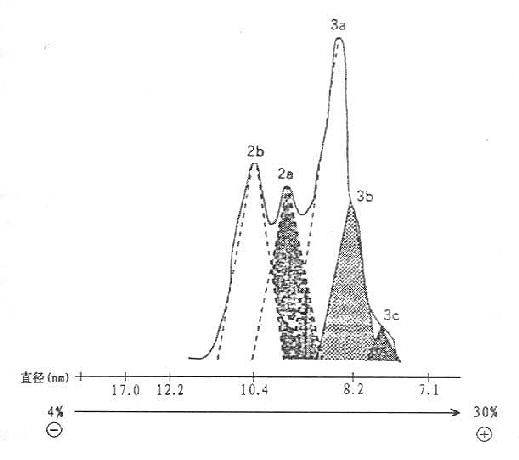
图10-4 健康人HDL亚组份颗粒的聚丙烯酰胺梯度(4%~30%PAG)电泳图
(源自:Blanche,P.J.et al B.B.A,1981)
第三节 遗传性载脂蛋白代谢异常
一、ApoAⅠ异常症
Assmann分析近2万人发现500人中有1例结构基因杂合子出现,比野生型ApoAⅠ多一个或少一个正电荷或负电荷,大多数变异体无明显血脂的变化,仅有ApoAⅠMarburg病在107位上的Lys缺失,引起轻度的TG升高。ApoAⅠ的Milano变异体(173Arg→Cys)血浆中HDL有所降低,然而冠心病发病率未见增加,ApoAⅠ和ApoCⅢ基因重排导致的变异是可引起家族性ApoAⅠ和ApoCⅢ缺乏症,Karathansis首先用EcoRⅠ限制性内切酶分析ApoAⅠ基因,发现家族性早发冠心病患者都出现6.5kb片段纯合子,正常人为13kb纯合子,其杂合子为13kb/6.5kb,推测纯合子6.5kb与动脉粥样硬化发病有关。
ApoAⅠ与ApoCⅢ缺陷者表现为血HDL水平降低,易出现早期动脉粥样硬化。有报道ApoAⅠ减少,会导致LCAT活性降低,使ApoAⅠ、ApoAⅢ的脂蛋白如CM置换发生障碍,从而在体内蓄积。
单一氨基酸变异的ApoAⅠ变异体如表10-4所示。
表10-4 单氨基酸置换的ApoAⅠ变异体
| 变异 | 名甲叉双丙烯酰胺(Bis),Serva产品;⑸TEMED(Sigma产品);⑹电泳缓冲液:1mol/lNaOH,1mol/L H3PO4;⑺转移电泳缓冲液:含20%甲醇,39mmol/L甘氨酸,48mmol/lTris和0.0375%SDS;⑻洗涤液(TPBS)含0.05%吐温-20,0.9%NaCl的10mmol/LPBS,pH7.4;⑼封闭液:含0.18%兔血清的TPBS或含3%BSA的TPBS;⑽羊抗人ApoE多克隆抗血清;⑾HRP标记的兔抗羊IgG:⑿4-氯-1-萘酚(Sigma产品)。 2.实验方法 (1)样品处理:抽取空腹血1~2ml,分离血清。取血清10μ置于预冷乙醇/乙醚(3:1)脱脂液中-20℃脱10h以上,离心(2500r/min)15min,弃上清后的加等量预冷的无水乙醚继续脱脂0.5h,再次离心,将沉淀样品用氮气吹干或抽真空使残余乙醚挥发;(2)IEF电泳:电泳前将样本溶解在100μl溶解液中(0.01mol/l Tris,pH8.6,内含0.01mol/LDTT,8mol/L尿素),放置37℃,1h。PAG凝胶浓度为5%,内含尿素(8mol/L),2%Ampholine,0.025%过硫酸胺(AP)及0.033%TEMED。电极液:阴极为1mol/LNaOH,阳极为1mol/LH3PO4。每份样品加样20μl,IEF条件初为300V,0.5h,然后调至700V,电泳5h。或1000V预冰30min(10℃)后,关电源,在靠阴极处放上IEF加样箔,每一空内加样后,继续电泳2h30min;(3)免疫印迹:转移电泳条件18V/cm,按转移电泳槽要求将凝胶上的蛋白电泳转移到NC膜上。5h后取出NC膜,放入封闭液内,室温过夜。用TPBS洗3次,然后用羊抗人ApoE抗血清(1:2000TPBS稀释)室温孵育6h。倾去液体,充分洗涤后,加入HRP标记的兔抗羊IgG(1:200)室温孵育2h。用PBS洗膜3次,每次10min。称取12mg4-氯-1-萘酚溶在4ml冷甲醇(-20℃)中,放入20mlPBS,加入10μ130%H2O2,放入已洗净的NC膜,缓缓摇动至蛋白带显出,蒸馏水洗后,晾干,暗处保存;(4)ApoE表型判定:根据所显示ApoE区带图谱即可确定ApoE表型,见图19-4所示。
图19-4 6种ApoE表型免疫印迹图(模式) 此方法样品用量少(10~20μl血清即可),故特别适合临床检验与大规模人群调查。由于ApoE糖类含量会影响IEF结果,所以在IEF前常用唾液酸酶预处理标本,以除去唾液酸残基。唾液酸酶的处理加强了主要区带,减弱了干扰的唾液酸型区带,克服了未用酶处理时,E3/2和E3/3有时难以分辨的困难,提高了表型判别的准确性。另外,如选用pH4~8范围的梯度作IEF电泳,则几乎能检测出至今为止所发现的所有异构体表型。国内吕新跃等应用自制E6C3株ApoE单克隆抗体作为一抗,用兔抗鼠IgG-辣根过氧化物酶标二抗,建立微量脱脂血清IEF及免疫印迹检测ApoE表型,亦取得较好效果。 四、ApoE基因型的检测采用聚合酶链反应(PCR)限制性片段长度多态性(RFLP),即PCR-RFLP技术从基因水平检测ApoE基因多态性(基因型),操作简便、快速准确。 1.仪器与试剂 (1)仪器:电泳仪、基因扩增仪; (2)试剂:Taq DNA聚合酶、dNTPs、DNA参考物(pBR322DNA/HacⅢmarkers)、HhaⅠ,其余试剂均为分析纯。 2.实验方法 (1)引物的设计与合成:引物参考文献设计,由Ranson Hill Bio Ssience Inc合成。序列为P1:5’-AACAACTGACCCCGGTGGCG-3’;P2:5’-ATGGCGCTGAGGCCGCGCTC-3’。特异性扩增ApoE基因第4外显子区含编码112位与158位氨基酸的基因序列(如图19-5)。产物片段292bp。
图19-5 PCR扩增产物经HhaⅠ酶切后RFLP模式 (2)模板DNA提取 ①经典法,取全血100μl,蛋白酶K消化,按标准酚、氯仿、异戊醇法提取DNA;②碘化钠法,参照Loparev等法加以改良,取全血100μl加无菌双蒸水100μl混匀,加6mol/lNaⅠ200μl涡旋震荡30秒,加等体积氯仿/异戊醇(24:1),涡旋震荡30秒,离心后取上清加0.6体积异丙醇混匀,室温(或4℃)静置15min,离心后沉淀以37%异丙醇洗1次,晾干后溶于TE中。以上两法提取DNA经紫外分光光度计定量后,置-20℃保存备用;③微量血斑水煮法,取50μl全血点至无菌滤纸上,自然干燥后用甲醇固定,室温贮存。临用时,剪成一直径5mm的圆形血斑纸块,将其混至100μl无菌双蒸水中,100℃煮沸30min以裂解细胞。取混合物15μl作膜板用。 (3)PCR扩增;反应体系为50μl。其中含1×扩增缓冲液(Tris-HC167mmol,pH8.3;MgCl225mmol/L;KCl50mmol/L)5μl,1%二甲亚砜5μl,dNTP各200μmol/L(5μl),引物P1、P2各5μl(分别为0.5μmol/L,模板DNA200mg(5μl),双蒸水15μl,加石蜡油30μl,离心混匀,置热循环仪(PE2400型,Perkin Elmer Cetus)中95℃预变性12min后,再加入TaqDNA聚合酶2U(5μl),然后按下列程序循环35次,即94℃变性1min,65℃退火1min,72℃延伸1.5min,最后于72℃再延伸10min,取产物10μl经2%琼脂糖凝胶电泳(溴化乙啶),紫外灯下观察扩增为292bp。 (4)扩增产物的限制性酶切:PCR扩增产物17μl直接用10UHhaⅠ酶切,37℃消化4h。反应终止后产物经10%聚丙烯酰胺凝胶电泳,EB染色35min,以DNA片段长度标准物为参考,紫外灯下观察结果并照像。ApoE基因型判定参照Richard等方法加以简化,即ε2/2出现3条带(91bp,83bp,61bp),ε3/2出现5条带(91bp,83bp,61bp,48bp,35bp),ε3/3出现4条带(91bp,61bp,48bp,35bp),ε4/3出现5条带(91bp,83bp,61bp,48bp,35bp),(91bp,72bp,61bp,48bp,35bp),ε4/2出现6条带(91bp,83bp,72bp,61bp,48bp,35bp),ε4/4出现4条带(72bp,61bp,48bp,35bp)。 该法检测的ApoE基因型图谱如表19-2所示。表中所示动脉粥样硬化性脑梗死(ABI)。 表19-2 人ApoE基因型和等位基因频率分布(%)
*:P<0.05;**P<0.01(均与对照组比较) 病人ε4/3基因型频率(30.0%)与ε4等位基因频率(18.0%)均显著高于健康对照组。 五、ApoE表型检测的临床意义临床上对ApoE表型多态性的研究已有20多年的历史,许多研究表明,ApoE多态性与个体患冠心病(CHD)或脑卒中可能存在某种内在联系。1993年以来,又发现ApoE多态性与AD及老化有关。通过对不同人群ApoE表型频率分布差异、ApoE多态性对血脂水平的影响及在某些疾病状态时ApoE等位基因频率分布的系统深入研究,已取得许多研究成果。 1.人群ApoE表型人群中存在六种ApoE表型,其由位于一个基因位点的三个共显性等位基因所控制。正常人群中以E3/3表型频率最高(超过50%);含E3的杂合子(E4/3、E3/2)居中(二者之和超过20%);E2/2、E4/4和E4/2表型频率最低(三者之和不超过8%)。 2.ApoE表型分布ApoE表型与等位基因频率分布具有一定种族差异性(如表19-3),无性别差异。中国人与日本人群十分相似,E3频率均高于80%,而欧美人群均低于80%。欧洲人E4等位基因频率从北到南呈下降梯度分布,亚洲人E4频率低(4.9%~12.7%),相比之下,非洲黑人及巴布亚新几内亚人E4频率高(约分别为30%、36.8%)。 表19-3 不同国家人群ApoE表型及等位基因频率分布
3.ApoE表型与高脂血症 ApoE多态性可能与不同的高脂血症(HLP)、CHD发生的种族差异及家族倾向有关。已发现Ⅲ型HLP患者几乎无例外的均为E2/2表型,易早发严重的AS。V型HLP患者ApoE4含量比正常人高。CHD患者E4/3表型和E4基因频率明显高于正常对照组。ε4与高TC、高LDL-C和高ApoB水平密切相关,可能是高胆固醇血症和CHD的遗传易患因子。 4.ApoE表型与脑病 ApoE多态性与缺血性脑血管病(ICVD)关系密切。Pedro-Botet等研究发现ICVD组E4/3表型频率明显高于对照组,E3/3表型频率明显低于对照组,认为ε4基因可能是ICVD的一种遗传标记。而Couderc等采用病例一对照的方法研究认为ICVD组E3/3表型频率明显低于对照组,而E3/2明显高于对照组,认为ε2基因可能是ICVD的危险因素。这些结论之间的差异可能与研究方法、所选病例及研究人群之间差异有关。 5.ApoE表型与AD ApoE多态性是Alzheimer病(AD)危险性的重要决定因子。Shimaro等(1989)首先描述AD与ε4的关系,他们运用IEF研究发现AD患者ε4频率比对照组高2倍。此后,Rose研究组等相继报道迟发性家族性AD(FAD)病人ε4频率增高,都描述、证实和讨论了ε4与AD的关系。Schachter等(1994)率先报道百岁老人普遍拎携带ε2等位基因。高龄老人携带ε2数量是年轻人的2倍。因此,ε2基因似乎不仅可保护人们免患AD,而且还与长寿有关。 第三节 载脂蛋白B基因多态性的检测ApoB是富含胆固醇和甘油三酯脂蛋白的重要组成成分,对脂质在人体转运、代谢、维持体内脂质水平的恒定起重要作用。大量临床资料及流行病学调查表明:血清ApoB及低密度脂蛋白(LDL)水平与动脉粥样硬化呈正相关,是其主要危险因素之一。近十年来,从分子水平研究ApoB,阐明动脉粥样硬化及高脂血症的发病机理,寻找其遗传标志受到广泛重视,现已发现:ApoB基因具有明显的多态性,其核苷酸变异有75处,其中导致氨基酸变异的有54处,例如多种酶限制性片段长度多态性(RFLPs),3’端高变区的数目可变的串联重复顺序(VNTR),信号肽(SP)多态性。大量研究表明,ApoB的基因多态性与动脉粥样硬化有不同程度的关系。 一、分析ApoB基因多态性的方法对ApoB基因多态性进行检测、分析的方法很多,如:限制性内切酶的酶谱分析法,PCR直接分析法,PCR产物RFLP分析法,等位基因特异性寡核苷酸(ASO)杂交法等等,其中最多用且简单的方法有PCR产物直接分析法和PCR产物RFLP分析法。 PCR产物直接分析法,是采用合适的引物,通过多次扩增,获得靶基因序列扩增片段,直接分析法片段的大小,可用于分析基因的缺失与插入。这种方法简便、快速、灵敏,可分析ApoB基因VNTR、SP多态性。 基因突变往往会造成限制性内切酶识别位点的改变,如位点丢失或产生新位点,通过PCR扩增某一特定片段,再用限制性内切酶酶切扩增产物,电泳观察片段的大小,这种方法用于检测酶切位点改变的基因突变,可直接判断基因型,是研究ApoB基因PFLPs的较好方法,具有灵敏、简便、可同时对大量样品进行分析等优点。 二、ApoB基因多态性的检测ApoB基因多态性研究较多的有RFLP、VNTR、SP多态性,分别叙述如下: 1.RFLP的检测 ApoB有10种RFLP,一般采用PCR-RPLPs方法进行分析,研究较多的有第26外显子XbaⅠ、MspⅠ位点,第29外显子EcoRⅠ位点,在Apob DNA上的位置如图19-6,图19-7所示:
图19-6 ApoB基因部分RFLPS示意图
图19-6 ApoB基因多态性位置示意图 用于PCR的引物如下: XbaⅠ-5’GGAGACTATTCAGAAGCTAA XbaⅠ-3’GAAGAGCCTGAAGACTGACT EcoRⅠ-5’CTGAGAGAAGTGTCTTCGAAG EcoRⅠ-3’CTCGAAAGGAAGTGTAATCAC MspⅠ-5’TCTCGGGAATATTCAGGAACTATTG MspⅠ-3’CTAAGGATCCTACAATGTCAAGGT XbaⅠ酶切位点的RFLP是由于2488位密码子第三个碱基突变(ACC→ACT),产生一个XbaⅠ酶切位点,但并未改变所编码的氨基酸序列,存在XbaⅠ酶切位点(X+)的等位基因,其PCR产物酶切后出现433bp和277bp两个片段,不存在XbaⅠ酶切位点(X-)的等位基因,PCR产物经酶切后仍为其产物710bp片段。 RFLP是由于4154位密码子改变(GAA→AAA),使原有的EcoRⅠ酶切位点消失,氨基酸序列中赖氨酸取代谷氨酸,存在EcoRⅠ酶切位点(R+)的等位基因,其PCR产物经EcoRⅠ酶切后得到253bp及227bp两个片段,不存在EcoRⅠ酶切位点(R-)的等位基因,其PCR产物酶切后仍为480bp的片段。 MspⅠ酶切位点的RFLP,是由于3611位密码子改变(CGG→CAG),谷氨酰胺取代了精氨酸,含MspⅠ酶切位点(M+)的等位基因,PCR产物经MspⅠ酶切后可见到395bp和85bp的片段,不含MspⅠ酶切位点(M-)的等位基因,PCR产物酶切后仍为480bp。 众多学者对ApoB基因RFLPs与动脉粥样硬化之间的关系进行了研究。多数学者认为ApoE有XbaⅠ酶切位点(X+),无EcoRⅠ酶切位点(E-),无MspⅠ酶切位点(M-)的基因频率,在动脉粥样硬化性疾病的患者中比正常对照组高,但也有学者持不同甚至相反意见,究其原因,可能有以下几点:①研究样品例数不够,有的少于100个甚至少于50个,可能使一些有意义的联系被忽略;②对照组的选择没有统一的、严格的、明确的标准,有时与病员组缺乏可比性;③存在种族差异,例如XbaⅠRFLP基因频率,X+等位基因在高加索人为0.4~0.5,日本人和中国人则仅为0.04、0.01;④某些遗传标记之间可能存在连锁关系,可导致结论互不相同。 2.VNTR的检测 VNTR(数目可变的串联重复顺序)是继RFLPs之后的又一类具有高度多态性的遗传标记,广泛分布于人类基因组中。ApoB基因3’端高变区(HVR)包含VNTR,由富含AT的DNA序列组成,其多态性特点是由10~15bp的核苷酸序列构成不同的等位基因,产生不同的重复序列拷贝数。以VNTR两侧特异性序列为引物,经PCR扩增后直接电泳分析产物,片段之间的差异在于AT重复次数不同,重复37次称为3β37。依此类推,PCR引物可用以下序列: VNTR-5’ATGGAAACGGAGAAATTATG VNTR-3’CCTTCTCACTTGGCAAATAC Boerwinkle等首先检测出12种等位基因片段,现有学者已检出22种不同等位基因。Frield等的研究发现,产生38、44、46或48个15bp长度重复序列的等位基因与冠心病、血浆胆固醇水平升高有关,且与EcoRi RFLP呈连锁不平衡,与MspⅠRFLP呈连锁平衡,Robinson等的研究则没有发现ApoB的VNTR多态性与血浆胆固醇、甘油三酯、ApoB等水平有关。 3.信号肽(SP)多态性的检测 ApoB基因5’信号肽(SP)由27个(插入型Ins)或24个(缺失型Del)氨基酸组成,可经PCR扩增后直接分析,用于PCR的引物序列为: IN/DE-5’CAGCTGGCGATGGACCCGCCGA IN/DE-3’ACCGGCCCTGGCGCCCGCCAGCA Wu等报告del/del基因型在高胆固醇血症患者中比对照组中多见。Renges等对伦敦地区亚洲后裔的研究也发现带del基因型者血浆总胆固醇升高,但与冠心病无明显关系。Peacock等提出Ins/del多态性与冠心病的发展,即其严重程度有关,也有报道Ins/del多态性在冠心病与对照组中无明显差别。 三、ApoB基因多态性检测方法举例以ApoB基因第26个外显子MspⅠ RFLP为例,具体介绍检测的方法和步骤,笔者对湖北地区健康成人(120例)进行了检测。 (一)材料 引物(如前所述),TaqDNA聚合酶、dNTP、限制性内切酶MspⅠ、高速离心机、基因扩增仪、恒温水浴箱、电泳系统、紫外监测仪。 (二)方法 1.模板DNA的提取 可采用改良的TritonX-100法提取人白细胞DNA,此法结果稳定,但操作较繁琐,在此采用改进的Na裂解法提取人白细胞DNA,简便、快速、灵敏、经济,步骤如下: 取EDTANa2抗凝血100μl,15000r/min离心5min,弃上层血浆,加无菌双蒸水200μl,摇匀20s,加6mNaI200μl,摇匀20s,再加入氯仿/异戊醇(24/1)400μl,摇匀后15000r/min离心12min,小心吸取上层水相,移入另一离心管,加0.6倍体积的异丙醇,混匀后4℃放置15min,15000r/min离心12min,弃异丙醇,加入70%乙醇洗涤2~3次,室温干燥,加入5μlTE缓冲液(pH=8.0)溶解DNA12~24h,4℃备用。 2.模板DNA的扩增 采用聚合酶链反应(PCR)。反应总体积50μl,MgCl2终浓度为1.5mmol/L的1×Buffer,dNTp 0.2mmol/l,引物各20pmol,模板DNA约1.0μg,混匀,短暂离心,95℃预变性10min,加入Taq酶1.5U,液体石蜡50μl,短暂离心,按94℃ 45sec,60℃ 45sec,72℃1mim 15s循环30次,72℃延伸5min,置4℃贮存。 3.扩增产物的提纯及酶切 取扩增产物20μl,加入醋酸铵至2.5mol/L,与无水乙醇混匀,4℃沉淀15min,12000r/min离心10min,弃上清,70%乙醇漂洗两次,室温干燥后加入含Mspi 10U的缓冲液37℃保温2h,加入EDTA至10mmol/L终止反应。 4.扩增及酶切产物的检测 (1)琼脂糖电泳:制备2%琼脂糖(含0.5μg/ml EB),将扩增产物与标准DNA(PGEM3zf(+)/HaeⅢ)点样,电压4v/cm,电泳,紫外灯下观察。 (2)聚丙烯酰胺凝胶电泳:将扩增及酶切产物加样于8%聚丙烯酰胺凝胶上,电压6V/cm,电泳4h,EB染色,紫外灯下观察。 (3)结果:扩增产物经2%琼脂糖电泳,紫外灯下呈一条强荧光带,与已知DNa Marker相比较,约位于480bp的位置,与设计相符。 扩增产物经MspⅠ酶切后,在8%PAGE上,可见到三种类型:①原始带消失,出现两条新带,长度为395bp和85bp,为含酶切位点的M+M+纯合子;②酶切后除与扩增产物相同位置的原始带外,还有两条长度为395bp和85bp的带,共三条带,为M+M-杂合子;③酶切后仅有一条带,与扩增产物位置相同,为无酶切位点的M-M-纯合子。 以上三种基因型,以含酶切位点的纯合型(M+M+)最多见,120例中有114例,不含酶切位点的M-M-型最少见,仅有1例,杂合型(M+M-)有5例,根据基因频率计算方法,等位基因M+频率为0.97,少见等位基因M-频率为0.03。 若对冠心病患者同时进行检测,计算基因频率,可见到:少见等位基因M-在冠心病组比健康对照组高,有显著性差异,但无论在冠心病组还是健康对照组,各基因型个体间的血脂、脂蛋白、载脂蛋白水平均无显著性差异,这说明Apob MspⅠ多态性与冠心病有关,但与血中脂类水平的关系不明显,这可能是由于环境因素,激素及其他遗传因素对脂质水平的影响较明显,掩盖了Apob MspⅠRFLP对脂质的影响,也可能是这种多态性与ApoB基因上其他位点的多态性有连锁关系。另外,由于少见等位基因M-的频率很低,有必要加大样本例数,进行进一步的研究。 第四节 载脂蛋白CⅢ基因型检测载脂蛋白CⅢ基因位于11号染色体与载脂蛋白AⅠ-AⅣ形成一基因族,它位于载脂蛋白AⅠ下游,有三个内含子和四个外显子。目前对载脂蛋白CⅢ基因3末端非编码区C-G对换产生一个Sac-Ⅰ酶切位点与冠心病的关系未有定论。用多聚酶链反应(PCR)扩增载脂蛋白CⅢ基因3末端233bp,再用Sac-1酶切扩增产物,可以检测载脂蛋白CⅢ基因3末端的突变及其与动脉粥样硬化相关性。本节采用PCR-RFLP检测ApoCⅢ基因型。 一、仪器与试剂 1.仪器:电泳仪,基因扩增仪。 2.试剂:TaqDNA聚合酶,dNTP,DNA参考物,Sca-1酶。 二、操作方法 1.模DNA提取 取用EDTA抗凝全血100μl加试剂(0.32mol/L蔗糖,5mmol/l MgCl2,1%TritonX-100,0.01mol/L Tris-HClpH7.6),振摇至溶解均匀透明,3000r/min离心10min,弃上清,沉淀部分加0.9NaCl溶液洗一次,加预冷试剂Ⅱ(75mmol/l NaCl,24mmol/L EDTA)100μl,20%SDS15μl,蛋白酶K10μl(6g/L)于65℃水浴4h,加200μl酚和氯仿:异戊醇(24:1)各提两次,上清加无水乙醇1.0ml放置于-20℃2h,以12kr/min离心5min,真空干燥后加50μlTE缓冲液溶解,4℃保存备用。 2.多聚酶链反应 Primer1:5-GTGACC GAT GGC TTC AGT TCC CTG-3,primer2:5-GGt AGG AGAGCA CTC AGA ATA CA-3。反应总体积为50μl,扩增缓冲液所含物质终浓度为:Tris-HCl,pH8.3,67mmol/L;MgCl225mmol/L;KCl 50mmol/L;明胶0.01%,dNTP各0.2~0.5μmol/L,模板约10μg,加40μl液体石蜡,94℃预变性4min,加Tag聚合酶1.5U,以93℃1min、65℃1.5min、72℃1.5min,循环30次。 3.扩增产物酶切 取扩增产物20μl加入NH4AC20μl,再加300μl无水乙醇混均置-20℃1h,10000r/min离心7min弃上清,干燥后加Sac-1酶液10μl37℃保温2h。 4.扩增产物碱基对分子量测定 采用GB公司产DNamarker,以已知DNA片段bp数相对应的电泳迁移距离,取半对数作图制成标准曲线,再根据等测定扩增产物DNA片段移动距离在标准曲线上求出其bp数。 三、结果分析 采用本节设计引物扩增产物为ApoCⅢ基因3非编码区233bp,该产物经Sac-1酶切可出现三种结果;①酶切后仍为一条带,电泳迁移率未发生改变,为S1S1纯合子;②酶切后除原始带外又增加了两条带,查标准DNa marker曲线在158bp和75bp相同,为S2S2杂合子;③酶切后原始带消失,出现两条新带,其电泳迁移率与158bp和75bp相同,为S2S2纯合子。S2为扩增的基因产物中C-G对换增加一个酶切位点。 检查100名正常人中有S2杂合子28名,纯合子2名;68名冠心病人中S2杂合16名,纯合子4名,它们的频率变化见表(19-4)。S2基因频率两组间无明显差别。 表19-4 载脂蛋白CⅢ基因Sac-Ⅰ酶切频率表
X=0.079,p>0.05(两组比较) (徐琼) (载脂蛋白表型及基因型的检测)参考文献1.鄢盛恺,载脂蛋白(a)研究近况,国外医学临床生物化学与检验学分册,1996,7:38 2.Utermann,G.The,mysteries oflipoprotein(a).Science,1989,246:904 3.Utermann G,Menzel HJ,KraftHG,et al.Lp(a)glycoprotein phenotypes ,inheritance and relation toLp(a)lipoprotein concentratios in plasma.J Clin Invest,1987,80:458 4.Utermann G,Kraft HG,MenzelHJ,et al.Genetics of the quantitative Lp(a)lipoprotein trati.I.Relation tolp(a)glycoprotein phenotypes to Lp(a)lipoprotein concentrations in plasma.HumGenet,1988,78:41 5.Kraft HG,Dieplinger ,Hoye E,etal.Lp(a)phenotyping by immunoblotting with polyclonal and monoclonalantibodies.Arteriosclerosis,1988,8:212 6.Huang CM,Kraft HG,GreggRE,Modified immunoblotting technique for phenotyping lipoprotein (a),ClinChem,1991,37:576 7.Gaubtz JW,Ghanem KI,Geavara JJr,et al.Polymorphism of human apolipoprotein (a):Inhertance and relationshipof their molecular weights to plasma levels of lipoprotein(a).JlipidRes,1990,31:603 8.Kamboh MI ,Ferrell RE,KottkeBA.Expressed hypervariable polymorphism of apolipoprotein (a)Am J HumGenet.1991,49:1063 9.Getoldi D,Bellotti V,BuscagliaP,et al .Characterization of Apo(a) polymorphism by a modified immunoblottingtechnique in an Italian poprlation sample.Clin Chim Acta,1993,221:159 10.Marcovina SM,Zhang ZH,GaurVP,et al.Identification of 34apolipoprotein (a)siofoms:differential expressionof apolipoprotein(a) alleles between American blacks and whites.Biochem BiophysRes Commun,1993,191:1192 11.李建军,压一义,汪俊军,人血清脂蛋白(a)的多肽性检油,中华医学检测杂志,1994,17:22 12.Sandholzer C,boerwinkle E,SahaN,et al.Apolipoprotein(a)phenotypes,Lp(a) concentration and plasma lipid levelsin relation to coronary heart disease in a Chinese population ;evidence for therole of the Apo(a) gene in coronary heart disease.J Clin Invest,1992,89:1040 13.秦树存,王士雯,李成文等,载脂蛋白(a)多态性与冠心病的关系,中健医学杂志,1995,75:588 14.庄一义,李建军,汪俊军,心脑血管疾病患者载脂蛋白(a)多态性研究,中华医学杂志,1995,75:149 15.Pedro-Botet J,Senti M,AuguetT,et al.Apolipoprotein(a)genetic polymorphism and serumlipoprotein(a)concentration in paticnts with peripheral vascular disease.Atherosclerosis ,1993,104:87 16.Dieplinger H,Lackner,LacknerC,Kronenberg F,et al.Elevated plasma concentrations of lipoprotein(a) inpatients with end-stage renal disease are not related to the size polymorphismof apolipoprotein(a).J Clin Invest,1993,91:397 17.Utermann G,Jaeschke M,MenzelJ.Familial hyperlipoproteinemia type Ⅲ.Deficiency of a specificpaolipoprteins.FEBS Lett,1975,56:352 18.Rall SC Jr,WeisgraberKH,Mahley RW.Human apolipoprotein e heterogeneity cysteine-arginineinterchanges in the amino acid sequence of the ApoE isoforms.J Bio L Chem,1981,256:9077 19.Wardell MR,Suckling PA,JanusED.Genetic variation in human apolipoprotein E.J Lipid Res,1982,23:1174 20.Zannis VI,Breslow JL.Humanvery low density lipoprotein apolipoprotein isoprotein polymorphism isexplained by genetic vartion and post-translational modifications.Biochemistry,1981,20:1033 21.Davignon J,Gregg RE,SingCF.Apolipoprotein E polymorphism and atherosclerosis.Arteriosclerosis,1988,8:11 22.解用虹,何锦林,王克勤,载脂蛋白E异构体的分离及其表型测定,生物化学与生物物理学报,1987,19:272 23.王克勤,解用虹,何锦麟。中国人群(京津地区)载脂蛋白E基因多态性和表型分布的研究,生物化学杂志1988,4:274 24.Utemann G,Steinmetz A,WeberW.Genetic control of human apolipoprotein E polymorphism:Comparison of one andtwo dimensional techniques of isoprotein analysis. Hum Genet,1982,60:34 25.吕新跃,陈保生,薜红等。微量血清等电聚焦电泳及免疫印这类法测定人载脂蛋白E表型,中华医学检验杂志,1994,17:26 26.牛庆田,国汉帮,山村卓等,免疫印迹法测定血清载脂蛋白E的表型,中华医学检验杂志,1994,17:16 27.Havekes LM,De KnijffP,Beisiegel V,et al.Arapid micromethod for apolipoprotein E phenotypingdirectly in serum.J Lipid Res,1987,28:455 28.Kataoka,S,Paidi M,HowardBV,Simplified isoelectric focusing/immunoblotting determination ofapolipoprotein E phenotype.Clin Chem,1944,40:11 29.Scana AM,EdelsteinC.Solubility in aqueous solution of ethjenol of thems all molecular weightpeptides of the serum VLDL and HDL.Anal Biochem,1971,44:576 30.Menzel HJ,Kladetsky RG,Assmann G,Apoprotein Epolymorphism and coronary arterydisease.Arteriosclerosis,1983,3:310 31.Siest G,Pillot T,Regis-BaillyA,et al .Apoliprotein E:An important gene and protein to follow in laboratorymedicine.Clin Chem,1995,41:1068 32.Yamamura T,YamamotoA,Sumiyoshi T,et al.New mutants of apolipoprotein E associated withatherosclerotic disease but not to type Ⅲhyperlipoproteinemia .J ClinInvest,1984,74:1229 33.Cumming AM,RobertsonF.Polymorphism at the apolipoprotein Elocus in relation to risk of coronarydisease.Clin Genet ,1984,25:310 34.Sing CF.Davignon,J.Role of theapolipoprotein e polymorphism in determing mormal plasma lipid and lipoproteinvariation Am J Hum Genet,1985,37:268 35.Borwinkle E,Visvkis S,WelshD,et al.The use of measured genotype information in the analysis of quanitationphenotypes in man.Am J Hum Genet.1987,27:567 36.Ehnholm C,Lukka M,Kuusi T,etApolipoprotein E polymorphism in the Finish poprlation ;gene frequencies andrelation to lipoprotein concentrations.J Lipid Res,1986,27:227 37.Ghiselli G,Schaefer EJ,ZechLA,et al.Increased prevalence of apolipoprotein E4,in type V hyperlipoproteinemia.J Clin Invest,1982,70:474 38.Utermann G.Apolipoprotein Epolymorphism in healyty and disease.Am Heart J,1987,113:433 39.Pedro-Botet J,Senti(a),triglyceride-rich lipoproteins and apolipoprotein Epolymorphism.Stroke,1992,23:1556 40.Couderc R,Mahieuk F,BailleulS,et al.Prevalence of apolipoprotein E phenotypes in ischemic cerebrovasculardisease:A case-control study.Stroke,1993,24:661 41.Shimano H,Ishibashi S,MuraseT,et al.Plasma apolipoproteins in patients with multiinfarctdementia.Atherosclerosis,1989,79:257 42.Strittmatter WJ,SaundersAM,Schmechel D,et al.Apolipoprotein E:High-avdity blinding to beta-amyloid andincreased frequency of type 4 allele in late-ornset familial Alzheimerdisease.Proc Natl Acad Sci USA,1993,90:1977 43.Schachter F,Faure-DelanefL,Guenot F,et al .Genetic assocations with human longevity at the AopE and ACEloci.Nat Gengt,1994,6:29 44.Shoulders CC,Ball MJ,MannJI,et al.Genetic marder in apolipoprotein AI/CⅢgene complex associated withhypercholwseterlemia.Lancet,1986,11:1286 45.Ordovas J,Civeira F,GenestJJr,et al.Restriction fragment length polymorphisms of the apolipoproteins ,andpremature coronary disease.Atherosclerosis,1991,87:75 46.Yang CY,Gu ZW,Weng S,etal.Structure of apolipoprotein B—100 of human low densitylipoproteins.Arteriosclerosis,1989,9:96-108 47.Boerwinkle E,lee SS,Balter Ret al.Rapid typing of apolipoprotein B DNA polymorphism by DNaamplification.Atherosclerosis,1990,81:115-232 48.Soria LF,Ludwig EH ,ClarkeHRG,et al.Association between a specific apolipoprotein B mutation and familialdefective apoprotein B-100 Pro Natl Acad Sci USA,1989,96:587-591 49.Priestley,Knott T,Wallis S,etal.RFLP for the humam apolipoprotein B gene V:Xba I,Nucleic AcidsRes,1985,13:6793 50.Wu H,Wen MS,Lo SK,et al.DNApolymorphisms of apolipoprotein Bin the population of Taiwan.J Formos MedAssoc,1993,92:330-335 51.Young SG,Recent progress inunderstanding apolipoproteinB,Circulation,1990,82:1574-1579 52.Boerwinkle E,Xiong W.FourestE,et al Rapid typing of tandemly repeated hypervariable loci by the polymerasechain reaction :Application to the apolipoprotein B3 hypervariable region.ProcNatl Acad Sci USA 1989,86:212-216 53.Hixon JE,PK,McMahan CA,etal.The human apolipoprotein B3hypervariable region :detection of eight newalleles and comparisons of allele frequencies in blcks and whites.HumGenet,1993,91:475-479 54.Friele W,Ludwig EH,PaulweberB,et al.Hypervariability in a minisatellite3 of the apoipoprotein B gene inpatients with coronary heart disease compared with normal controls.J LipidRes,1990,31:659-665 55.Borwinkle E,chan L.Athreecodon insertion /deletion polymorphism in the signal peptide region of thehuman apolipoprotein B gene directly typed by the popymerade chain reactionNucleic Acids Res,1989,17:4003 56.Wu JH,Wen MS,Lo SK,etal.Increased frequency of apolipoprotein B signal peptede SP 24/24 in patentswith coronary artery disease.General allele surey in the population of Taiwanand comparison with caucasians,Clin Genet,1994,45:250-254 57.Renges HH,Wile DB,MckeigueDM,et al.Apolipoprotein B gene polymorphisms are associated with lipid levelsin men of South Asian descent.Atheroscleosis,1991,91:267-275 58.Peacock R,Dunning A,HamstenA,et al.Apolipoprotein B gene polymorphisms,lipophisms ,lipoproteins andatherosclerosis:a study of young mycardial infarction survivors and healyhypoprlation base inpduals.Atherosclerosis,1992,92:151-164 59.Saha W,Tong MC,Tay JS,etal.DNA polymorphisms of the apolipoprotein B gene in Chinese artery diseasepatients ,Clin Genet,1992,42:164-170 60.Loparev VN,Cartas MA,MonkenCE,et al.An efficient and simple method of DNA extraction from whole bolod andcell line to identify infectious agents .J Virol Methods ,1991,34:105-112 61.周新,甘佩珍,杨香玖等,健康成人与Ⅱ型糖尿病人ApoE遗传表型,武汉大学学报生物工程专利,1990,109-112 62.涂建成,周新,哈黛文等,聚合酶链反应技术检测ApoE基因型,中国病理生理杂志,1997,65 63.况少青,金桦,陈保生等,高脂血症患儿载脂蛋白AI-CⅢ基因限制性片段长度多态性研究,中华医学检验杂志,1994,17:19-21 64.鄢盛恺,周新,哈黛文等,聚合酶链反应限制性片段长度多态性检测ApoE基因型,中华医学检验杂志,1997,20:28-31 第二十章 低密度脂蛋白受体的检测脂蛋白受体主要包括乳糜粒受体(CM-R)、极低密度脂蛋白受体(VLDL-R)、低密度脂蛋白受体(LDL-R)、高密度脂蛋白受体(HDL-R)和清道夫受体(scavenger receptor)等。脂蛋白受体的检测与一般受体检测方法的原理及操作基本类同。目前研究最多,应用最广的要属LDL-R,其他脂蛋白受体如清道夫受体、VLDL-R等的检测方法与LDL-R基本相似,多采用125Ⅰ标记的配体检测或是3HTdR掺入法等。本章以LDL-R为代表介绍脂蛋白的检测方法。 低密度脂蛋白受体(LDL-R)广泛分布于人与动物的各种细胞和组织,如肝细胞,成纤维细胞,血管平滑肌细胞,淋巴细胞,单核细胞及肾上腺、卵巢等。LDL-R是一种跨膜糖蛋白,位于细胞表面被膜凹的浆膜部位。主要功能是参与LDL-R的代谢过程,与含有ApoB100、ApoE的LDL、β-VLDL等结合,并内吞入细胞,LDL-R缺乏则导致血中胆固醇异常。家族性高胆固醇血症(FH)是LDL-R基因突变引起的LDL-R缺乏以致胆固醇异常的显性遗传性疾病。其特征为血胆固醇显著升高、黄色瘤和早发心肌梗塞。人群中杂合子型FH(LDL-R减少)发生频率为1/500,纯合子型FH(LDL-R缺乏)较少见,发生频率约为1/1000000,通常在儿童期即发生心肌梗塞。FH的发病率在我国也是比较高的,因此LDL-R的检测对于筛选人群中的FH患者及预防冠心病、心肌梗塞等具有重要意义。 细胞表面的LDL-R的分析可通过以下几种检测方法进行:检测同位素或非同位素标记的LDL与LDL-R的结合力(或率),推算受体最大结合浓度,在限制性生长条件下检测细胞分裂抑制率。判断LDL受体活性;用抗体直接测定LDL-R量或者对受体直接进行蛋白质结构和基因图谱分析。 第一节 受体与标记配体的结合分析为了体外研究脂蛋白的细胞代谢和脂蛋白受体活性,早在1974年Goldstein和Brown就建立了成纤维细胞125I标记LDL的配体-受体结合分析法。其基本原理是:用放射性同位素(常用125I)标记LDL后,与细胞(通常为培养的单层成纤维细胞)、组织或含有LDL-R的制剂一起孵育,使LDL-R与125I-LDL充分结合,形成受体-配体复合物,再除去未结合的125I-LDL,测定结合沉淀物中的放射性。同时检测细胞、组织或受体制剂的蛋白质含量,即可计算出与125I-LDL结合的LDL-R量。本法由于使用同位素,采样困难和操作过程繁琐,且费时、昂贵,故在临床诊断上难以广泛开展。 Teupser等于1996年建立了直接荧光法检测LDL-R,他们采用1,1’二(十八烷基)-3,3,3,3-四甲基吲哚羰基花青高氯酸盐(1,1-dioctadecy1-3,3,3,3-tetramethylindocarbocyanine perchlorate,DiI)标记LDL,原理与同位素标记LDL相同。其操作步骤见图20-1。直接荧光法可定量检测附着的或非附着的各种类型的培养细胞(如正常人或FH病人的皮肤成纤维细胞、淋巴细胞、人U-937和鼠P388D1巨噬细胞系)的LDL-R和清道夫受体,其特点是特异性强,灵敏度高,不使用有机溶剂、不需预先进行脂质抽提,并省去了多步抽提步骤。正常人平均最大结合浓度为10.3±1.1μg/mg细胞蛋白,FH杂合子为5.2±0.8μg/mg细胞蛋白,FH纯合子0.9±0.2μg/mg细胞蛋白。
图20-1 直接荧光法测LDL-R操作步骤 亦有用胶体金标记LDL的,但是在受体-配体结合分析法中,正常人与FH患者的测定值有较明显的交叉现象,且操作比较繁琐。 1987年Roach等比较了在硝化纤维素上用125I-LDL、生物素-LDL、生物素-LDL、胶体金-LDL和胶体金-LDL结合银染四种方法检测LDL-R,发现胶体金-LDL结合银染的方法最为敏感,且安全、简单、快速、便宜。比较结果见表20-1。 表20-1 硝化纤维上检测LDL-R的几种方法比较
第二节 3H-TdR掺入法与MTT比色法Cutbert等发现缺乏内源性和外源性胆固醇时,培养于仅含微量LDL营养液中的人外围血淋巴细胞,其生长和增生均依赖与细胞膜表面LDL-R的存在,根据这一原理建立了3H-TdR(3H-thymidine,3H-胸腺嘧啶)掺入法检测人淋巴细胞LDL-R的活性。杨建新等改进了本法,减少用血量,但是未能避免使用同位素,简述止法。 检测原理:细胞分裂增殖所需的大量胆固醇主要通过内源性胆固醇合成,以及加速细胞膜LDL-R介导的特异性结合,摄取血LDL中的外源性胆固醇而获得,当用mevinolin(胆固醇合成的限速酶HMG-CoA还原酶的抑制剂)阻断细胞内源性胆固醇的合成,并使细胞外环境中LDL浓度降低至无非特异性外源胆固醇摄取时,细胞分裂生长完全取决与细胞膜表面LDL-R活性,掺入3H-TdR量与细胞生长成正比例关系。 实验方法:采空腹静脉血5~6ml,肝素抗凝,测血浆血脂,并分离出淋巴细胞;将细胞分成实验组(加含mevinolin的二甲亚矾)和对照组(加不含mevinolin的二甲亚矾),在同样条件下(50μg/mlPHA,5μg/mlLDL-C,37℃,5%CO2,饱和湿度)培养96h,分别加入0.5μCi3H-TdR,混匀后继续培养6h,收集细胞至玻璃纤维纸上测cpm值。 其计算公式为: 淋巴细胞分裂抑制率(%)=(1-Δcpm实验组/Δcpm对照组)×100% 采用本法正常淋巴细胞分裂抑制率<20%;FH杂合子淋巴细胞分裂抑制率>60%,故可将FH患者与正常人以及普通的高脂血症区别开来。 MTT比色法是孟凡青等根据3H-TdR掺入法为避免使用同位素而改用四甲基偶氮唑盐(MTT)建立的一种快速、方便的方法。MTT比色法仅需采空腹静脉血1~2ml,培养90h后,实验组和对照组分别加入MTT溶液(3mg/ml),再培养2h,抽吸上清,加0.04mol/HCL-异内醇,充分溶解,在酶标仪上测吸光度(A)值。详细操作流程见图20-2。
图20-2 MTT比色法检测LDL-R操作流程 细胞分裂抑制率计算公式为: 淋巴细胞分裂抑制率(%)=(1-ΔA实验组/ΔA对照组)×100% 正常人淋巴细胞分裂抑制率为0~18%;FH杂合子淋巴细胞分裂抑制率为21%~58%;FH纯合子淋巴细胞分裂抑制率为36%~60%。 经实验比较MTT比色法与经典的3H-TdR掺入法测定的结果基本相符,但是后者敏感性更强,可以一步将FH杂合子和FH纯合子区分开来。由于MTT比色法不需使用昂贵的仪器和同位素,用血量少,适合一般实验室及临床检验科室的临床诊断,可用于人群FH筛查,这对于减少杂合子之间的婚配,降低FH发病率有重要意义。 第三节 抗体法检测LDL-RFelgines等在研究RICO鼠的肝载脂蛋白时报道了抗体法的应用。 用来源于牛肾皮质的LDL-R免疫兔,得到兔抗牛-LDL-R抗体,离心法收集纯化细胞膜蛋白,点样于硝化纤维膜上,于猝灭液中温育1h,以TTBS洗3次,加入稀释的抗LDL-R抗体血清,再温育90min,TTBS洗后,纤维膜用结合有辣根过氧化物酶的第二抗体羊抗兔-IgG温育1h30min,TTBS洗3次,TBS洗1次,15min后用4-氯-1-奈酚和H2O2显色。 TTBS:Tris-HCL20mM,pH7.5NaCl500mM,Tween200.05%;TBS:Tris-HCL20mM。pH7.5,NaCl 500mM 第四节 LDL-R基因突变分析自Shneider等于1992年成功地纯化出牛肾上腺的LDL-R基因,Yamamoto等1984年成功地分离和克隆出5.3kb受体基因的全cDNA,并制成探针后,FH患者LDL-R基因突变在NDA分子水平上的研究有了新进展。 LDL-R基因位于人类第19号染色体p13.1~13.3,长45kb,由18个外显子和17个内显子组成(见图20-3),编码860个氨基酸的受体前体蛋白,分子量为120000,此前体蛋白在由内质网向高尔基体转运的过程中切去21个氨基酸残基组成的信号肽,加上18个O-连接和2个N-连接的寡糖链,成为分子量为160000的成熟LDL-R。LDL-R蛋白根据结构与功能的关系分成5个功能区,见第六章。
图20 -3 LDL-R基因结构示意图 图中细线为内含子,宽线为外显子 在LDL-R外显子与其功能结构区也有密切的对应关系,如表20-1所示。17个内含子分别在LDL-R氨基酸序列中第2、43、84、211、252、293、333、375、432、508、548、594、642、693、750、776和828位点处插断外显子的序列。 表20-1 LDL-R外显子与功能结构区的对应关系
在对FH病人LDL-R基因的分析中,已发现了几十种不同的基因突变,按照突变对LDL-R结构与功能的影响,将LDL-R基因突变分成四型,如表20-2所示。 表20-2 LDL-R基因突变类类型
从DNA分子水平上看,LDL-R突变包括缺失、插入、无义突变和错义突变,影响受体的5个功能区,目前至少已发现180种LDL-R基因突变型,其中以5’端>10kb片段突变最为常见。LDL-R的各种基因突变及其对LDL-R功能的影响见表20-3、表20-4、表20-5。 表20-3 LDL-R 的各种基因突变及其对LDL-R功能的影响(缺失)
表20-4 LDL-R的各种基因突变及其对LDL-R功能的影响(错义突变)
表20-5 LDL-R的各种基因突变及其对LDL-R功能的影响(无义突变、插入)
第五节 LDL-R基因突变的常用研究方法一、Southern印迹法 Southern印迹法在鉴定LDL-R基因缺失突变中得到了广泛的应用。采用多种限制性内切酶切,以LDL-R基因片段和外显子特异性片段作探针,进行杂交,再放射自显影,对FH进行限制性酶切图谱分析,可检测FH患者的不同外显子区域不同长度的部分缺失类型。 二、PCR法和核苷酸序列分析法 采用PCR法将包括点突变的受体基因片段扩增,再经核苷酸序列分析即可发现点突变位点。影响酶切位点的点突变可经PCR扩增、特定的限制性酶切、电泳,检测出异常片段。 三、寡核苷酸探针法 本法采用的是一对寡核苷酸探针,其中一个与正常基因顺序互补,另一个与突变序列互补,因此需用到多种特异的寡核苷酸探针,是鉴定点突变的一种快速而简便的方法,当一个或二个点突变在某一特定人群中成为突变的主要原因时,就可建立这种方法对某一地区的某一主要突变进行筛查。 四、RFLP连锁分析法 限制性片段长度多态性(restriction fragment lengthpolymorphism,RFLP)是采用不同的限制性核酸内切酶酶切和多种cDNA片段探针,根据DNA多态性片段的出现,确定LDL-R基因的连锁相。 本法需进行家系分析,多态位点必须有一个以上是杂合的,并且要排除细胞减数分裂时基因重组对多态位点的影响。 五、长链PCR法 常规的PCR扩增长度不超过3kb,不适合检测大片段的受体基因缺失突变,Southern印迹法亦繁琐复杂,近年来长链PCR技术的研究为检测LDL-R开辟了新途径。下面详细介绍由周天鸿等建立的长链PCR法在检测LDL-R基因大片段缺失突型中的应用。 引物:设计5对寡核苷酸引物,见表20-6。 表20-6 PCR扩增引物序列
DNA:由健康人和FH患者外周血制备DNA。 长链DNA扩增:采用引物PA1和PA2扩增LDL-R基因中外显子5~10的片段。 PCR扩增制备探针:采用引物PB1/PB2、PC1/PC2、PD1/PD2、PE1/PE2制备LDL-R基因外显子7、8、9、10的同位素探针。 PA1对应于LDL-R基因外显子5的5端侧翼序列,PA2对应于外显子10的部分序列,此对引物扩增产物为含外显5~10的基因片段。正常人得到1条7kbDNA片段,FH患者得到2条DNA片段,一条7kb,一条4.4kb,表明FH患者是杂合子,其一个LDL-R等位基因正常,另一个等位基因外显子5~10之间存在着一个2.6kb的缺失,见图20-4。将产物用EcoR1酶切,得到的产物电泳图谱见图20-5。最后用PB、PC、PD、PE4对引物,以正常基因的长链PCR产物为模板,用PCR法获得外显子7、8、9、10的探针,将这些探针分别与正常基因的突变基因的长链PCR产物杂交,其结果见表20-7。 采用长链PCR技术可快速、简单、准确地检测大片段的缺失突变,可应用于临床基因诊断,尤其是有遗传背景的FH高危人群的基因筛查。
图20-4 FH患者LDL-R基因缺失示意图
图20-5 长链PCR产物电泳示意图 a:FH患者基因PCR扩增产物;b:健康人基因PCR扩增产物;c:CNA分子量标记。 表20-7 LDL-R突变基因和正常基因长链PCR产物与外显子7~10探针的杂交结果
(刘芳) (低密度脂蛋白受体的检测)参考文献1.Golstein JL and BrownMS.Binding and Degradation of Low Density Lipoproteins by Cultured HumanFibroblast.J Biol Chem,1979,249(16J 5131-5162. 2.Teupser D,Thiery,J,WalliAK,Seidel D.Detrmination of LDL-and scavenger-receptor activity in adherent andnon-adherent cultured cells with a new single-step fluoromertric assay,BiochimBiophis,1996,1303:193-198 3.Roach PD,Zollinger M andSimon-Pierre N.Detection of low density lipoprtein(LDL)receptoronnitrocellulose paper with colloical gold-LDl conjugates.J LipidRes,1987,28:1515-1521 4.Cuthbert JA,East CA,BilheimerDW and Lipsky PE,Dtection of familial hypercholesterolemia by assayingfunctional low-density-lipoprotein receptors on lymphocytes.New Engl JMedicine,1986,314(14):879-883. 5.孟凡青,蔡海江,陈秀英等LDL受体活性检测新方法,中华医学检验杂志,1994,17(4):204-206 6.Felgines C,Serougne C,MazurA,et al.Hepatic apolipoprotein and LDL receptor gene expression in thegenetically hypercholesterolemic(RICO)RAT,Atherosclerosis ,1995,117:15-24 7.Scheider WT ,et al J BiolChem,1982,257:2664. 8.Yamamoto et al Cell,1984,39:27 9.王艳林,刘孝全,家族性高胆固醇血症患者低密度脂蛋白受体及其基因缺陷,国外医学遗传学册,1992,5:235-240 10.范乐民,蔡海江,姜传仓等,低密度脂蛋白受体基因多态性及其与血清胆固醇水平的关系,中华医学杂志,1993,73(4):242-224 11.周天鸿,李月琴,王彤歌等,长链PCR技术扩增低密度脂蛋白受体基因大片段的研究,中华医学遗传学杂志,1996,13(4):221-224 12.周天鸿,李月琴,王彤歌等,长PCR技术在检测LDL受体基因大片段缺失突变型中的应用, 第二十一章 动脉血管壁的生化分析动脉粥样硬化(AS)的发生发展从动脉血管壁病理形态上可分为脂纹、纤维斑块、复合病变三期。脂纹期外观为小圆形或卵圆形黄色斑点分布于血管内膜表面。病灶内平滑肌细胞呈弥散或灶性分布,泡沫细胞增多。其中平滑肌源泡沫细胞多于吞噬细胞源泡沫细胞,细胞间质增多。纤维斑块期为脂质斑表面有大量致密胶原纤维,其间夹杂着少量以平滑肌细胞为主的细胞,深层为无定形坏死物,后者多为胆固醇。复合病变期的重要特征为出现钙化性坏死病灶。对AS形成的细胞形态变化已经明了,但对导致形态变化的机理还未完全清楚。生物化学技术为分析血管壁细胞、细胞器、细胞间质的化学组成以及各种因素对细胞增殖、细胞基质基因表达提供了基本的研究方法。 第一节 动脉壁的组成与结构一、血管内皮细胞 动脉血管内皮细胞多为长椭圆多角形,呈镶嵌排列,细胞长轴与血流方向平行,胞核圆形,表面有小孔和小窗。在内皮表面有50~1000A呈茸毛状的多糖,这些多糖与细胞的通透性有关。细胞浆中有肌球蛋白和肌动蛋白能够收缩,细胞间有紧密连接和裂隙连接两种连接形式。内皮基质与基底膜相连,前者厚600~700A,含有糖蛋白、胶原、弹性蛋白,它可作为基底膜的一个滤过膜。 血管内皮细胞功能:①是防止血液成分向血管壁渗透的第一道防线,防止大分子物质通过血管;②可分泌多种物质如细胞因子、PG12、组胺和心钠素等;③有多种受体存在,如脂蛋白受体、激素受体、药物受体等;④内皮细胞内含有肌动蛋白和肌球蛋白可伸张和收缩,调节内皮细胞小孔的大小,影响其细胞通透性。 二、平滑肌细胞 平滑肌细胞为不规则多凸起,呈长梭形,长约6μm,宽约2μm。细胞核为圆形或椭圆形,多位于细胞中央。 平滑肌细胞功能:①可分泌多种细胞因子PG12、PGE,还分泌细胞趋化因子使平滑肌细胞和吞噬细胞增殖;②平滑肌细胞表面有脂蛋白受体,如LDL-R结合LDL并吞入细胞内参与血液脂蛋白代谢;③平滑肌细胞表面有多种细胞因子受体和生长因子受体;④可合成分泌血管壁结缔组织间质成分。 三、单核-吞噬细胞 血管壁内吞噬细胞来源于血液单核细胞。细胞为不规则圆形,大小15~30nm,表面有伪足样凸起,细胞核位于中央,呈圆形或椭圆形,胞浆溶酶体发达。单核-吞噬细胞功能:①吞噬细胞能分泌ILI并存在有ILI受体,ILI使吞噬细胞活化增强吞噬能力;②Shimokado报道吞噬细胞能分泌促进纤维母细胞、平滑肌细胞及内皮细胞生长因子;③细胞表面有β-VLDL受体、LDL受体、化学修饰脂蛋白受体等调节细胞内脂质代谢。 四、蛋白多糖 蛋白多糖是由核心蛋白以共价键连接多个氨基葡萄糖构成,不同排列顺序及长度的氨基多糖链对蛋白多糖的生物学功能有重要作用。组成蛋白多糖的多糖阴离子分别由两种氨基已糖(氨基葡萄糖、氨基半乳糖)之一和乙醛糖通过不同糖苷键连接而成。 生物学功能:①蛋白多糖与胶原呈网架结构排列,使血管富有弹性;②调节血管壁中水的含量,由于蛋白多糖具有弹性螺旋结构及凝胶样特性,尤其是透明质酸本身分子量大,与水的结合能力强,在AS中蛋白多糖增多,结合水也增多,呈胨胶样;③具有抗凝血酶的作用,蛋白多糖可加速抗凝血酶与凝血酶结合,防止凝血和血栓形成;④对抗平滑肌细胞增生,HS较CS、DS、HA明显,当动脉受损时,血小板释放出EGF因子或由内皮细胞单核细胞释放的PDGF的作用,强于蛋白多糖而使平滑肌细胞增生。 五、胶原 胶原是由数目不等的微纤维组成,每个微纤维含有数根原胶原分子,原胶原是由三条右手旋转α-肽链,通过共价键交联。α-肽链含有大量重复的(Gly-X-Y)n结构,X、Y代表氨基酸,并含有较多的赖氨酸和羟赖氨酸,其含量可达20%~25%。胶原的功能:①胶原与蛋白多聚糖共同组成网架结构,支撑血管壁细胞和保持血管弹性;②影响血管壁细胞的形态和集聚方式;③粘附细胞的功能,内皮细胞、平滑肌细胞都粘附到胶原上才能使纤维粘连蛋白增殖,并参与细胞与胶原间的连结。 六、弹性蛋白 弹性蛋白为黄色胶样物质,电镜下为弯曲状单条纤维,外形不规则,直径1~10μm,长短不一,具有弹性。氨基酸组成与胶原相似,含有1/3的甘氨酸,非极性氨基酸达到90%以上,脯氨酸可达到1/9,但羟脯氨酸极少。弹性蛋白极易交联,其蛋白中赖氨酸在赖氨酰氧化酶作用下转变成携带活泼的ε-醛基,可与未醛化的赖氨酸发生羟醛缩合反应。 弹性蛋白的功能:①与胶原一起组成网架样结构,具有弹样,维持血管的韧性;②可网格血浆成分参与AS形成。 七、粘连蛋白 血管中粘连蛋白主要为基膜粘连蛋白(laminin,LN),基膜粘连蛋白呈“+”字形结构,有一条长臂和三条短臂,臂的末端为球形区域。 LN经蛋白酶水解,可被分解成7个片段,片段1可抵御胃蛋白酶的降解,LN中多数半胱氨酸和二硫键都集聚于此,抗原决定簇也在此,片段3对蛋白酶敏感,呈α-螺旋结构,其他片段呈β-螺旋结构和周期性重复结构。 第二节 动脉血管壁细胞组分的提取一、血管壁细胞提取 1.以无菌术取动脉,立即放入4℃、5%水解乳蛋白Hanks液中漂洗,除去凝血。 2.用小镊剔除外膜纤维、脂肪组织,用剪子沿血管壁纵向剪开血管,用Hanks液洗2次。 3.可先分开内皮细胞和平滑肌细胞,也可不区分两类细胞,将血管切成小块,放入2%胶原酶,温浴12~18h。 4.梯度液选择40%~70%,40%梯度液应是4份precoll、1份小牛血清、5份BPS,其他浓度配制与此相同。 5.把密度梯度液按从管底至管口密度梯度逐渐减少的顺序铺入试管,将操作3.细胞液铺于顶层,4kr/min离心,收集各层细胞鉴定。 二、细胞核提取 1.取制备血管细胞悬液放于试管中,加五倍体积缓冲液(10mmol/l TrisHCL,pH7.4含10mol/L NaCl,1.5mmol/L Mgcl2),加1%SDS10 μl用匀浆器轻轻匀浆。 2. 加蔗糖液(0.34mol/L,蔗糖10mol/LMgCl2)2份再匀浆1次,下面铺一层0.88mol/L蔗糖,800g离心5min,收集沉淀部分。 3.在0.88mol/L蔗糖液中再纯化1次,然后将细胞悬于10ml蔗糖液(0.34mol/L0.05mmol.LMgCl2)液中,用超声波处理10S。 4.将两倍体积的0.88mol/L蔗糖加于上述处理液中,800g离心30min收集沉淀部分。 5.将沉淀加入0.88mol/L蔗糖,5kg离心1h,沉淀部分为细胞核,将其保存于0.25mol/L蔗糖,0.55mmol/LMgCl中备用。 三、细胞膜的提取 1.取一定量酶处理的细胞,用匀浆器破碎,操作要温和,使细胞膜保持完整。由于水与膜的疏水部分之间有反应,因此要精确掌握分离介质中的离心强度和渗透压,以每克细胞湿重加40ml介质。 2.用Potter-Elvehiem匀浆器,杆与壁间间隙0.5~0.6μm,14.4kr/min上下匀浆4~6次,每次5S。 3.过滤匀浆液,150g离心10min,保留上清,沉淀部分加入50μl介质,用匀浆器1kr/min匀浆3次,150g离心10min,沉淀部分再加入上次匀浆的上清液。 4.合并3次上清液,2kg离心10min,弃上清,沉淀部分溶于100μl介质,离心10min,弃上清,留沉淀。 5.将沉淀部分加入70%蔗糖15份,然后分别置于三个离心管中,上面依次叠加54%、49%、45%,41%,37%蔗糖溶液各2、2、5、5、3份。 6.700kg离心90min,分离介质在1.16~1.18之间形成介面。 7.收集d为1.16~1.18g/ml之间的细胞膜,加30倍的介质以2.5kg离心10min,洗涤2次。 8.保存于2.7mmol/L Tris-HCl pH7.5缓冲液中,用于细胞膜的研究分析。 四、溶酶体的分离 1.在梯度混合器的两个小杯中分别加入2.1mol/L和1.1mol/L蔗糖(比例9:1)。 2.收集血管壁细胞,用特制匀浆器1kr/min匀浆10次。 3.以150g离心10min,上清液以同样条件离心1次,弃沉淀,上清液以9kg离心3min弃上清液, 4.沉淀分三种不同颜色,褐色为半纯化的溶酶体,中间黄褐色为线粒体部分,上层白色为膜成分混合物。首先小心吸取上层,然后加入0.3mol/L蔗糖数毫升,慢慢摇匀使界面层悬浮,再用0.3mol/L蔗糖洗1次。 5.将悬浮的半纯化溶酶体铺在梯度平面上,用玻棒搅匀最上层梯度液,使溶酶体和梯度液之间的介面破坏,然后以10kg离心15min,离心后可出现三条明显的区带及少许沉淀,最下面黄褐色为纯化的溶酶体,中间黄色的为线粒体。 五、线粒体的分离 1.浆分离的血管浸入缓冲液(250mmol/L甘露醇、0.5mmol/l EDTA、 5mmol/L Hepes、0.1%BSA、pH7.4)匀浆破碎细胞,600g离心5min,除去细胞核及碎片。 2.上清液在100kg离心10min,留取沉淀部分。 3.将沉淀部分悬浮于5ml操作1.的缓冲液中,加入5倍体积30%Percon、225mmol/L甘露醇、1mmol/L,EDTA、25mmol/LHepes 0.1%BSA,5000g离心30min。 4.将上述沉淀溶于适量10mmol/L KH2PO4,pH7.4中,轻轻振荡15min。 5.加入10ml蔗糖液缓冲液(32%蔗糖、30%甘油、10mmol/l MgCl2、10mmol/L KH2PO4,pH7.4)振荡15min。 6.用BransonB-12超声波碎仪60~70W处理2次,每次15min,12kg离心10min。 7.将沉淀部分溶于10倍体积缓冲液中并铺于试管底层,试管中层铺成不连续蔗糖梯度(25.3%、37.9%和51.3%)蔗糖各4mm厚,上层铺上清液。 8.2kg离心3h,在25.3%/37.9%界面处为线粒体外膜,在51.3%蔗糖层分别回收内膜和基质。 第三节 动脉血管壁细胞间质成分的提取一、胶原的提取动脉血管壁胶原提取的基本方法是,首先除去凝血等其他杂质,由于胶原为杆状三螺旋结构,能耐受胃蛋白酶的作用,但是两端球蛋白结构能被胃蛋白酶水解。胶原纤维内分子间的共价交联是由分子末端赖氨酸或羟赖氨酸形成,用胃蛋白酶切断末端交联结构,使胶原分子的巨形结构被破坏,从完整分子可提出各种类型的胶原。 (一)胶原的初步分离 1.小心取出动脉血管,用0.05mol/L BPS pH7.8洗净凝血块,3kr/min离心10min。 2.冷丙酮酸浸泡24h除去脂肪,蒸馏水洗涤3次。 3.将组织破碎,加三倍体积组织匀浆处理液(0.5mol/L乙酸,pH2.5,1%胃蛋白酶)于4℃48h,16kr/min离心45min,同样方法重复3次。 4.向留取的上清液中缓缓加入NaCl,最终达到4mol/L浓度,搅拌12~24h,15kr/min离心45min,弃上清。 5.进一步分离各种胶原可用分段盐析和柱层析法进行操作。 (二)胶原的分段盐析 1.取初级提取物加0.1mmol/L乙酸,加NaCl至0.7mmol/L,15kr/min离心20min。沉淀提取Ⅰ、Ⅲ、Ⅳ型胶原,上清提取Ⅳ、Ⅴ型胶原。 2.沉淀,加0.14mol/L PBS pH7.6,37℃保湿16h,10kr/min离心20min,上清液加NaCl至4mol/L,离心,沉淀物为Ⅳ型胶原。 3.1mol/L NaCl溶解沉淀,加3倍体积Tris-HCl pH7.4,10kr/min离心20min,沉淀为Ⅲ型胶原。 4.上清加NaCl至2.5mol/L,10kr/min离心20min,沉淀为Ⅰ胶原。 5.取1.操作的上清加NaCl至1.2mol/L,15kr/min离心20min。 6.沉淀溶于4倍体积1.0mol/L NaCl、0.05mol/l Tris-HCl pH7.4,加NaCl至4mol/L 10kr/min离心20min。 7.上清加NaCl至4mol/L,调pH到3.5,离心得沉淀再加5倍体积0.2mol/l NaCl、1mol/L脲、0.01mol/L Tris-HCl pH7.4的DEAE液悬浮16h,小心取上清加NaCl至4mol/L,10kr/min离心10min,沉淀为Ⅳ型胶原。 8.将6.沉淀部分加0.2mol/LNaCl,10.05mol/l Tirs-HCl pH7.4的DEAE悬浮16h,上清加NaCl至4mol/l,10kr/min离心10min,沉淀为Ⅴ型胶原。 (三)将初步提取的胶原加到DEAE纤维柱上,用0.2mmol/l NaCl、0.05mol/L Tris-HCl pH7.5的溶液洗脱,230nm波长检测洗脱物。因为胶原在pH7.5时均带正电荷,不与DEAE柱结合,所以被柱结合的则为非胶原蛋白。 二、蛋白多糖的提取蛋白多糖具有可溶于4mol/L盐酸胍的性质,再经DEAE-纤维素层析除去其他杂质,非蛋白多糖与蛋白多糖用不同浓度尿素可分段层析分开。 1.取动脉血管小心除去血管周围脂肪组织和纤维膜,用冷0.5mol/l PBS pH7.8洗涤,2kr/min离心10min。 2.用匀浆器破碎,加入15倍体积的提取液(0.05mol/L乙酸pH5.8、4.0mol/L盐酸胍、0.1mol/l6-氨基乙酸EDTA、3mol/L苄脒),于4℃缓慢振荡24h,10kr/min离心30min。 3.取上清透析浓缩30倍。 4.将提取液加入已经平衡好的DEAE-纤维素柱上,分别用0.15mol/l NaCl和2mol/LNaCl洗脱,均用280nm波长紫外监测仪连续监测。 三、弹性蛋白的提取提取方法较多,各有优缺点。1969年Bornstein和Ross先用5mol/L盐酸胍抽提,再用胶原酶水解其他非弹性蛋白组分,最后还原二硫键,分离提取弹性蛋白。具体方法如下: 1.将动脉血管壁洗净,小心除去附着结缔组织。 2.将血管壁组织浸于4℃ 50%的吡啶液,破碎组织,3kr/min离心15min。 3.取沉淀用蒸馏水洗涤3次,真空干燥后研成粉末。 4.将粉末悬浮于2mol/L NaCl,4℃搅拌24h,3kr/min离心20min,弃上清,沉淀用蒸馏水洗3次。 5.将沉淀用无水乙醇脱脂20min,用氯仿-甲醇(2:1)处理20min,再用乙醚冲洗干燥,3kr/min离心20min,真空干燥沉渣。 6.干燥的沉淀物用5倍处理液(0.5mol/LCaCl2、10.05mol/l Tris-HClpH7.5、2%胶原酶)洗涤,3kr/min离心20min。 7.将沉淀移入带塞的瓶中,加含0.5mol/L盐酸胍、0.1mol/l Tris-HClpH8.5、0.05mol/L二硫赤藓糖醇,2.0mol/L EDTA液4℃过夜。 8.3kr/min离心20min,沉淀用蒸馏水洗涤2次。 9,沉淀物加入处理液(6mol/L尿素、0.1%SDS、0.05mol/L二硫赤藓糖醇、0.05mol/l Tris-HCl pH7.7),通过氮氧真空过夜,3kr/min离心20min。 10.沉淀再真空干燥,即为弹性蛋白。 四、粘连蛋白的提取提取粘连蛋白的基本原理是用NaCl脱氧胆酸钠液提取血管壁中的粘连蛋白,再用高盐除去杂质,然后进一步用Sephacryl层析纯化,方法如下: 1.将动脉血管壁组织加10倍体积处理液(0.05mol/lTris-HCL pH7.6、0.5%核酸酶),4℃搅拌20min,10kr/min离心10min。 2.沉淀用含0.05mol/L Tris-HCl pH7.6、0.5%PMSF、10%甲醇液,洗涤2次,10kr/min离心10min。 3.沉淀物中,加40倍体积处理液(0.05mol/lTris-HCl pH7.6、0.5%PMSF、0.5mol/LNaCl,)4℃过夜后,10kr/min离心10min。 4.上清用PEG6000浓缩,最后加入已平衡好的SephacrylS-3000层析柱上,用0.05mol/L Tris-HCl pH7.6、0.5%NaCl洗脱,第一峰即为粘连蛋白。 第四节 动脉血管壁免疫化学鉴定方法免疫化学方法是利用抗原与其相应抗体具有特异结合的特性,用荧光素、酶、发光素、同位素、胶体金标记某种抗原的抗体,借助荧光显微镜、电镜、图像分析仪、同位素监测仪、分光亮度仪便可对组织中的抗原进行定性或定量,可用于胶原、蛋白多糖、弹性蛋白、粘连蛋白、血浆成分的定位和定量分析。 1.抗原提取及单克隆抗体的制备(从略)。 2.抗体的标记:基本原理是将抗体与标记物以共价键结合。 3.组织取材。 因为抗原组织容易降解和扩散,取材要及时和低温操作,取动脉壁冰冻切成4~8μm,贴于玻片上立即干燥,用95%乙醇固定15min,然后用0.5mol/l pH7.4 BPS洗1次。 4.抗体染色 抗体染色是利用抗原与抗体特异性结合的原理,37℃30~60min,间接法结合第二抗体,37℃ 30~60min。每步间隔都用PBS pH7.4洗涤5~10min共洗3次。抗体染色方法有直接法、间接法、补体法: (1)直接法:标记抗体直接于组织中进行抗原结合反应,用于鉴定未知抗原。 优点:①结果判定简单;②特异性强,因反应过程中只有两个因素,与抗原交叉反应较少。 缺点:①不能鉴定未知抗原;②一种标记抗体只能检测一种抗原;③敏感性差。 (2)用已知未标记抗体与未知抗原相互结合或用未知抗体与已知抗原相互结合,一定时间后洗掉未结合成分,加第二标记的抗体。若第一步反应中有Ag-Ab的特异结合,才会有第二步后续反应。 优点:①既能检查Ag又能检查Ab;②标记一种抗体,就能与一种以上的相应抗原结合鉴定多种抗原或抗体;③敏感性比直接法高。 缺点:①参加反应因素多,易出现非特异性反应;②实验方法复杂。 (3)补体结合法:是标记补体抗体的方法,第一步是将抗体和补体加入反应体系;第二步是加入标记补体抗体,若第一步有Ag-Ab反应,补体抗体则可结合于补体上。 5.染色定性定量分析 荧光素标记抗体可用荧光显微镜作定性分析。用显微荧光分光光度计可定量。酶标抗体可用普通显微镜定性,也可定量。放射性同位素和发光素标记可用同位素检测仪和发光计作定性、定量分析。 (孙续国) (动脉血管壁的生化分析)参考文献1.高野达哉等,动脉硬化,1989,17(3),407 2.RellyCF,et al,J cell physiol ,1986,129:11 3.CuraderA,et al,Atherosclerosis,1985,57:293 4.KeemplerF et al.Jclinic Invest,1983,7(1):1435 5.FriedrichG, et al. Eur Jbiochem,1976,64:307 6.蔡有余竺,中国医学科学学报,1984(3);167 7.AmesBN et al.Mutation Res,1980,75:215 9.KleinmanHK,et al.Biochemistry,1986,25:321 10.MassayukiO,et al,J Biol Chem,1983,258:497 11.BoccherB ,et al Hum Genet,1980,544:207 12.徐永源等,上海免疫杂志,1989,9(4):581 13.金灵等,生物化学生生物生理进展,1989,1:52 14.EduardA,et al Biophy Methods,1986,13:103 15.VernerT,et,J cell Biology ,1982,93:918 16.川上正舒,名取泰博.血管壁细胞 第二十二章 动脉粥样硬化模型及细胞培养第一节 动物模型制作动物模型是研究疾病发生、发展、治疗的一个重要方法和手段,动脉粥样硬化及血脂代谢紊乱(如高脂血症)的动物模型,随着对疾病研究的深入和发展自身也不断地完善和发展。特别是由于生物化学,分子生物学,基因工程和细胞学技术的进步,动物模型的制作和研究水平有了质的飞跃。本章就怎样制作一个理想的动物模型,提供一般的制作方法并对其必要条件作一扼要介绍。 一、理想动物模型必备条件 怎样做好一个动物模型,一个动物模型是否标准是对某一疾病研究成功的关键因素之一。影响动物模型制作的因素很多,主要包括选种、饲育条件和环境、饲养方法和时间。 1.选种:不同动物有各自的生活方式,食性和代谢特点,饲养方法和实验反应性均有很大的差异,因此,选种应该选择对实验反应敏感容易发生该疾病的动物。 2.制作时间要尽量短:如动脉粥样硬化在机体自然形成是一个缓慢过程,若动物模型亦如此自然过程,耗费时间,则实际上失去研究价值。 3.相似性;动物模型在病理形态学和生物化学方面应与人部分类似;是有这种类似,对人才有一定参考价值。 4.制作过程要尽量避免非生理条件下进行。特殊环境下制作的模型,在致病机理上可能有一定差异,其可比性肯定会受到影响,所以应尽量模拟自然过程进行模型制作。 5.动物模型可重复,且重复性稳定。 6.具有定量性,即可用客观的方法和标准测定。 7.动物容易获得且价格便宜。 8.容易饲养、操作简便。 9.各种测定指标容易获得。 第二节 动脉粥样硬化动物模型一、常用动脉粥样硬化动物模型的比较 动脉粥样硬化模型所用的动物有鼠、兔、猪、狗、猴,依上述理想动物模型的要求最常用的是兔、猪和鼠。各种动物诱导方法和形成特征的差异,见表22-1。 表22-1 动脉粥样硬化模型的种类
二、动脉粥样硬化动物模型制作过程 主要介绍猪和兔两种动物模型的制作过程。因其容易获得、价格便宜、操作简单,常为首选动物。 1.猪的动物模型 健康雄性中国小型猪,按统计学需要,自定数量。5~6月龄,称其体重并记录,随机分为实验组和对照组,每组数量相等,单笼饲养,对照组只给基础饲料,实验组基础饲料每只动物按25g·kg-1/d分两次给予,上午在少量基础饲料中拌入10%蛋黄粉和1.2%胆固醇,待吃完后再添足饲料。每月根据体重变化情况调整饲料量。两组均自由摄水。为使动脉粥样硬化模型更接近人的病变,可采用间接饲养法,于第17周停喂胆固醇和蛋黄粉4周,到第21周再恢复,并不再调整饲料量,直至第29周。 2.兔的动物模型 兔可选日本大白兔或新西兰白兔(常用作内膜剥脱造型)。8周龄或成年兔,称其体重记录,随机分组,单笼饲养。每日给胆固醇1.5g,上午以少量基础饲料拌食,待吃完后,再添足基础饲料(每日每只120g),对照组则只供基础饲料,两组均自由摄水,饲养10周。 以上均为高脂膳食法,此外还有一种较常见的造型法是剥脱内膜法,其操作是选用我国的大耳白兔,每天只给0.5g胆固醇和大油1.5g,蛋黄5g,1周后经右股浅动脉,将3.5F球囊扩张导管插至腹主动脉20cm,球囊充液膨胀至2个大气压缓慢拉出,反复3次。 三、相关指标检测 动脉粥样硬化的模型检测,大体包括病理形态学检查,免疫组织化学检查以及生化检查三个方面。 1.病理形态学观察 为了对比,猪在14~29周,兔在5~10周,处死两组动物(每周各一只),作饲养过程的经过观察。 (1)肉眼观察主动脉沿纵轴剪开,苏丹Ⅲ、Ⅳ混合染色,投影格子计数法分别计算每条主动脉内膜总面积,胸、腹主动脉内膜面积以及苏丹Ⅲ、Ⅳ染色阳性的脂质条纹及隆起的纤维斑面积,求出各类病变面积百分比。冠状动脉自心脏剥下,沿纵轴切开,苏丹Ⅲ、Ⅳ混合液染色,按上述方法计算每条冠状动脉内膜及其病变面积,求出病变面积百分比。在实验组(猪)14周时脂质条纹面积和纤维斑面积的百分比分别是9.64%和1.56%左右。冠状动脉在主支近端1/3处可见纤维斑。 (2)光镜观察从胸主动脉和冠状动脉典型病变处分别取材,常规石蜡切片,厚4μm,HE染色。用目镜测微尺于200倍镜下测量动脉纤维斑或脂质条纹的最大厚度及中膜厚度,求其厚度比值,两组的值应有显著的差异。Masson染色片,光镜下400倍计数三个视野的腹主动脉和冠状动脉左前降支纤维斑内胞浆红染的梭形细胞(视为平滑肌细胞)数。其值在两组间亦应有显著的差异。此外,尚可在实验组见到内膜缺损或裂隙。 (3)电镜观察动脉处死后迅速取材(部位同光镜),2.5g戊二醛及1%锇酸双重固定,常规制备样品,以超薄切片机切片,乙酸钠,柠檬酸铝染色,透射电镜观察。扫描电镜样品经逐级酒精脱水,临界点干燥,镀膜后观察。在动物模型组应见到内皮细胞变性坏死脱落,见到髓磷脂小体,细胞间连接变直变宽,内皮下间隙扩大,有较多的平滑肌细胞(SMC)和泡沫细胞。泡沫细胞胞质内密集成群分布的大脂滴和胆固醇结晶,结晶使细胞核移位,胞体肿大,部分泡沫细胞崩解,如图22-1所示。线粒体肿胀变性,多数SMC胞浆内充满大量细胞器(粗面内质网,高尔基体等)。但肌丝成分较少,间质可见弹力纤维增生,细胞外脂质沉积。
图22-1 猴大动脉硬化灶电镜图 喂饲一年形成的高胆固醇血症猴的大动脉呈高度动脉粥样硬化斑块(fattystreak)表面,内皮细胞呈复杂的凸凹不平。一部分细胞接合分离、巨噬细胞祼落、血小板粘着凝集。 2.免疫组化定性定位观察 目前市场上有多种免疫组化所需的抗原抗体提供,针对LDL的动脉粥样硬化斑可采用组化分析,用相应的LDL抗体为第一抗体的PAP法观察LDL在动脉粥样硬化病灶内的分布。LDL免疫活性阳性的颗粒主要分布在泡沫细胞周边,在纤维斑块内,LDL颗粒呈弥漫性分布,在病灶深部内弹力板附近,有大量LDL颗粒聚集成带状。 3.生化指标检测 在动物饲养全过程中,每周应进行一次血脂测定。可在耳垂静脉取血或心脏直接抽血。常测指标有血清总胆固醇(TC),某油三酯(TG),低密度脂蛋白(LDL),高密度脂蛋白(HDL),载脂蛋白AⅠ(ApoAⅠ),载脂蛋白B(ApoB)等,其动物模型,除ApoAⅠ和HDL外,其他各项指标与对照组比较出现不同程度的升高,尤其以TC、LDL、ApoB最为显著。此外,血小板膜流动性(PMF)及丙二醛(MDA)也可用作参考指标。 第三节 家族性高脂血症动物模型家族性高胆固醇血症是由于遗传因素导致LDL受体(LDL-R)缺陷,从而引起LDL代谢障碍。其症状表现为在幼儿期即可形成动脉粥样硬化,可早于10岁左右发生心肌梗塞。 由于该病是LDL-R基因突变引发的疾病,所以很难用前述的方法制作成功动物模型,而是通过育种学和遗传学的方法获得的。1974年渡边从日本白色种兔发现一只高脂血症的变种,经传代筛选于1979年获得成功。是现在唯一的LDL受体缺陷动物。这种兔被名命为“watanble heritablehyperlipidemic rabbit,WHHL”,WHHL的LDL受体先天性缺陷,从出生时表现为高胆固醇血症,幼龄时自发形成动脉硬化、心肌梗塞、黄色瘤,其症状与FH患者极其相似。因此,WHHL是作为脂质代谢、动脉硬化不可多得的模型,已被世界各地广泛应用于研究。直接购买WHHL种兔,进行饲养即可。 一、WHHL特征 脂质代谢异常是WHHL的主要特征。血液胆固醇大部分以低密度脂蛋白(LDL)为载体被转运,其中2/3的LDL与细胞膜的LDL受体结合被摄入细胞内,在细胞内被分解为氨基酸和游离胆固醇。游离胆固醇作为细胞膜的构成成份,或者作为胆汁酸、固醇类激素的前体物质而被利用。此外,当细胞内胆固醇过剩时可通过几方面调节,①经过再酯化(ACAT活化)贮存于细胞内;②胆固醇合成的限速酶HMG-CoA还原酶活性被抑制,胆固醇合成量减少;③LDL受体合成被抑制,从血中摄取LDL也受到抑制从而导致细胞内胆固醇含量下降。当细胞内胆固醇不足时,HMG-CoA还原酶活性被激活,胆固醇合成加速。同时,LDL受体合成加速,从血中摄取LDL的量也增加,细胞内胆固醇增加。正常细胞通过这种机制调节LDL代谢。 WHHL同FH患者一样,由于LDL受体缺陷,LDL受体途径受阴,使血脂在血液中堆积。WHHL的皮肤纤维母细胞、肝、肾上腺及其他器官细胞的LDL受体,结合血中LDL的能力仅为正常兔的5%。 表22-2 正常兔与WHHL血脂对照表
LDL受体由DNA基因转录为mRNA到合成蛋白质,必须在高尔基体结合糖链转变成成熟的受体被运至细胞表面。在WHHL,由于受体的前体运输到高尔基体的过程受阻,因此被运送到细胞表面的LDL受体很少,LDL进入细胞内的代谢量极少,导致LDL大量停滞于血液形成高LDL血症。从表22-1看,WHHL血中胆固醇浓度是正常兔的25倍以上,脂蛋白中的胆固醇,包括极低密度脂蛋白(VLDL)、中密度脂蛋白(IDL)和LDL也大大高于正常兔的浓度,特别是被称为动脉硬化的危险因子LDL是正常兔的70倍以上。另一方面,由于细胞内经受体途径摄取LDL不足,导致HMG-CoA还原酶的活化,细胞内胆固醇不断地生成。 二、大动脉,冠状动脉的病变 动脉粥样硬化是内膜纤维性增厚形成粥样斑块的病理改变。其形成机制是不明原因使内皮细胞损害,受损部位引起血小板的凝集,血小板、白细胞等释放的物质促使中膜平滑肌增殖,增殖的平滑肌细胞浸入内膜层;另一方面,过剩的脂蛋白等血浆成分侵入内皮细胞缺损部分,使平滑肌细胞或由单核细胞转化的巨噬细胞对这些物质进行吞噬后形成大量泡沫细胞,这种变化的反复作用导致粥样硬化的发生。WHHL的情况是LDL的大部分不能经受体途径在细胞内代谢,滞留于血,不断积蓄。LDL长期滞留血液间,由化学因素氧化成变性LDL,巨噬细胞摄取变性LDL而泡沫化。从新生兔开始,发生含平滑肌细胞的内膜增厚。肉眼即可观察断乳兔(生后约40天)的病理改变。表22-3所示,4月龄的发病率为100%,经组织学观察,含泡沫细胞的内膜出现增厚。成熟龄(7月龄)的大动脉内膜面约36%的面积发生病变。随着年龄增加病变面积扩大,在内膜深层可见粥样斑块形成,弹性纤维变得肥厚、膨胀、断裂、钙盐沉着等典型的粥样硬化特点。 冠状动脉由于粥样硬化引起狭窄,是导致心肌梗塞的重要原因。心肌坏死是由于缺血而发生的,原则上必须有75%以上的冠状动脉发生狭窄。1980年以前的WHHL系冠状动脉发病率6月龄约占15%,20月龄也仅是50%的低发生率。这样低发生率的动物模型难以为实验所利用,通过用遗传学、育种学的方法开发了好发冠状动脉疾患的种系。现在6月龄发生率是100%,75%以上狭窄病变从幼龄到13月龄就有发生(见表22-3)。因此,以前20月龄以上高龄才发生心肌梗塞,现在则从7~20月龄就有大部分发生。这种用育种学的方法能够扩大冠状动脉狭窄病变的现象,说明这种病变的进展与遗传有很大的关系。 三、其他的病变 WHHL的LDL受体缺陷引起高胆固醇血症,带来大动脉、冠状动脉、头颈头脉、肾动脉、胰腺动脉等等的粥样斑化。而LDL受体缺陷的人还会在胰腺引起类似慢性炎症的一系列变化。黄色瘤多发于关节部位与人高胆固醇血症患者相同。人高脂血症患者可见自然发生的股骨头坏死,以及听力障碍等症状,在WHHL中也有类似的病理改变。 表22-3 WHHL模型大动脉、冠状动脉病变进展
*:以大动脉或冠状动脉内膜面积为100%。 四、与人病态异同的应用研究 WHHL的高胆固醇血症,动脉硬化,黄色瘤等症状同FH患者症状十分相似。一个较大的差异点是在WHHL高胆固醇血症并发高甘油三酯血症,WHHL的异种杂交体没有发生高胆固醇血症。前者可能是人与兔种系差异,后者则是生活环境的不同所引起的。 WHHL常用于脂质代谢、脂蛋白的相关研究和动脉硬化、心肌梗塞成因和进展机制的研究,降脂药、抗动脉硬化剂的开发研究等,以及涉及相关方面的研究WHHL是不可多得地动物模型,被广泛利用并取得了巨大的成果。 第四节 血管壁细胞的培养和鉴定动脉粥样硬化病灶主要涉及两类血管细胞即血管内皮细胞和中膜平滑肌细胞(SMC),本节主要就这两类细胞进行讨论,介绍一般培养和鉴定方法。 一、血管内皮细胞的培养方法和特性 人和动脉不同部位、不同血管如大动脉与小动脉、毛细血管,以及静脉血管之间存在差异,在处理这些细胞时应分别对待。血管内皮细胞形态较小,近似圆形,呈均匀排列,一般取材于人和动物的脐带。 1.人大动脉内皮细胞培养 人大动脉内皮细胞可来自手术、病理活检组织,也可来自尸体(需在死后24h内取材),在取材过程中应注意无菌操作。 (1)方法:小心剥除已游离的大血管外膜,置于盛有冷的磷酸盐平衡盐溶液平皿中反复漂洗,洗净血管内、外面的血液和脂质,然后剪开血管,放入37℃消化液中,60min,消化结合后,用23号针头注射器吸取消化液冲洗血管内腔,最后收集消化液置无菌试管中,离心(1000rpm 7min)弃上清,加入含血清培养基中,使细胞重新悬并调整细胞数,接种于相应大小培养瓶或培养皿中,37℃恒温温箱培养,一周后内皮细胞可长成单层,呈多角形铺成石状排列。 (2)注意事项:①如果小于23号针头则回收内皮细胞效果差,若针头过大则注射器内压大会吸入紧贴内皮细胞的平滑肌细胞,因此注意使用恰当的针头;②人血管内皮细胞对营养条件要求高,是依赖于生长因子的一种细胞。常用的培养基为RPMi 1640,培养时添加15% FBS,15%Nu-Serum,5~20μg/ml的内皮细胞生长因子(ECGF)以及100μg/ml的肝素。改进的培养基有MCDB109培养基,市场上也有内皮细胞商品培养基,可根据需要选择购买;③培养基中必须加入相应抗生素,最终浓度:庆大霉素为15μg/ml,氨苄青霉素为50μg/ml,二性霉素B1~2μg/ml,二甲胺四环素1μg/ml。在48h内可以防止细胞感染,3日后还应添加庆大毒素。此方法也适用于人大静脉内皮细胞的培养,但静脉壁薄,操作困难,细胞容易老化。 2.高度动脉硬化的血管内皮细胞的培养动脉硬化血管内皮细胞培养,对培养基的要求同正常内皮细胞,技术关键是分离细胞。动脉硬化内皮细胞层混有脂肪斑化,粥样肿胀的巨噬细胞。除去这种巨噬细胞最有效的方法是利用内皮细胞和巨噬细胞比重的差异,通过离心的方法达到分离的目的。通常用淋巴细胞分离液,首先经消化液处理,将所得内皮细胞的沉渣放入不含血清的8mlRPMi 1640液再漂浮后,预先在另一试管加入5ml淋巴细胞分层液(比重1.0717),再将细胞轻轻加入。加完后,800xg,23℃离心30min,内皮细胞沉着于管底,巨噬细胞漂浮于上层。 3.脐带静脉内皮细胞培养 在婴儿出生时立即将脐带放置于无菌的500ml磷酸盐溶液(PBS)中低温保存。次日分离细胞。脐带有一根静脉两根动脉,通常用内腔大静脉。将洗净的静脉一端用夹子夹紧,一端注入消化液,静置孵育片刻。然后PBS或培养液反复抽吸内腔,收集后与消化液一并离心、沉淀内皮细胞。所用培养基与大动脉内皮细胞培养基相同,脐带静脉内皮细胞、大动脉内皮细胞易于培养,既使不加生长因子在最初几代细胞也会增殖良好。 二、血管内皮细胞特性 1.血管内皮细胞重要标志 (1)第Ⅷ因子关连抗原(von willebrand factor,VWF),可以由全身所有血管内皮细胞产生,检测这一因子主要用相应抗体。VWF有其特异性,人的VWF抗体对牛的内皮细胞没有交叉反应。兔疫荧光间接法测定该因子,阳性细胞出现细长的荧光颗粒,在核周围的颗粒较密,细胞边缘颗粒较少。 (2)Weibel-Palade小体,该小体是血管内皮细胞又一特异性的标志。电子显微镜下,呈现0.1~0.3μm,长0.5~5μm的椭圆形棒状结构。上述的VWF就是该小体产生的。 2.培养的大动脉内皮细胞形态 培养的内皮细胞从形态学上可分为两类。其一,占培养内皮细胞的大部分,直径在50~70μm,类圆形或多角形的小型细胞,这一类被称为典型内皮细胞,呈单层铺路石样排列,占婴幼儿、青少年血管内皮细胞的大部分。另一类是直径在100~200μm的大型内皮细胞,这类细胞通常带有两个以上的细胞核,被称为非典型内皮细胞。非典型内皮细胞是成人的大动脉内皮细胞,与动脉硬化和老化有关。 一般来说,血管内皮细胞随着年龄的增加,使典型的内皮细胞慢慢地转变为非典型内皮细胞;年龄越大,非典型的内皮细胞含量越高。细胞生长方面,动脉内皮细胞比静脉内皮细胞增殖能力强,婴幼儿血管内皮细胞比成人或高龄者内皮细胞生长能力强,体外培养的这两种细胞与对照组细胞间存在显著差异。 第五节 动脉平滑肌细胞的培养一、血管平滑肌细胞的培养 血管平滑肌细胞培养常用的方法有贴块法(explant)和酶解离法(enzyme disperse)。贴块法具有获得平滑肌细胞纯度高,量多,操作简便的优点。但用贴块法易使平滑肌细胞胞质内肌丝丧失,亚细胞器增加。相反,酶解离法,由于酶的作用使细胞间失去连接,细胞内肌丝含量丰富,保持收缩型状态。培养平滑肌细胞常取材于兔、猪、鼠、猴的胸腹主动脉段。 1. 方法:动物经颈动脉放血后,在无菌操作下迅速取出胸腹主动脉段,置于含Hanks液的平皿中漂洗3次,将凝块洗干净后剥除外膜的纤维脂肪层,然后纵行切开血管,刮除内膜即内皮细胞迅速撕下中膜内、中层,切成约1mm宽的小条,浸泡在含血清的Hanks液中,并将撕下小组织块种植于培养瓶壁。置于37℃恒温箱,2h左右,取出培养瓶加入20%胎牛血清的培养液,再放回培养箱内静止培养4天。4天后可见细胞从组织中迁移游出。 不同动物血管结构有差异,猪和猴较易操作,但小动物如兔、鼠因其血管小,血管壁薄等特点,使之难以分离。另外组织块太薄,不易粘附培养基,也使细胞较难生长。为了保证培养的成功,应注意:①种植组织块的数目,如75cm2的长颈瓶组织块不得少于30个;②根据培养细胞的种属加入适量的不同血清,一般可加入牛血清,若小牛血清增殖效果差,应加胎牛血清(FBS),通常浓度为10%~20%;③培养基的选择:常用的有DMEM(Dulbeccos modified Eaglesmedium),M199培养基。培养兔的平滑肌细胞用DMEM效果较好。 2.酶解离法 沿动脉纵轴切开后,刮除内皮细胞撕下中膜的内2/3,注意不要混入内皮细胞,将组织块切成1-2mm2,放入加有3mg/ml胶原酶的无血清M199培养基中,37℃,0.5~1.5h。离心去上清,重复上述消化步骤,然后再离心(9000r,4min),收集细胞,在5%~10%同种血清或胎牛血清的M199培养基中调整细胞数,然后转入30~90mm培养皿中培养,对于兔子应加入高浓度的谷氨酰胺(0.2g/L)较佳。不同研究者在培养基、酶浓度以及消化时间等的选择都有很大的差异。 二、动脉平滑肌的特性 由于贴块法和解离法处理方式不同,在细胞培养的最初阶段细胞形态和性质存在差异。随着培养时间的延长,培养环境趋于一致,细胞特性上也趋于近似。 光学倒置显微镜下观察:原代平滑肌细胞形状多样,一般常为梭形、带形、三角形或星形。贴块法培养,细胞可于2周后长成单层;而酶解离只需6~7天,镜下可见明显“峰-谷”样生长。 透射电子显微镜下观察:贴块法,细胞多为合成型,肌丝减少,胞体缩小,细胞胞质内粗面内质网、游离核糖体、线粒体等亚细胞器逐渐增多。消化法,细胞初期表现为收缩型,细胞内核位于中心,胞质内含丰富的肌丝及致密度体。亚细胞器少,且位于细胞边缘处,基底膜最初未见,后来逐渐形成。传代后,细胞逐渐转为合成型,胞体增大且变扁平,核增大,核小体数目增加,亚细胞器也增加,肌丝开始减少,占胞内35.4%~11.5%,甚至更少。 另外,在体外实验中,来自幼龄动物(兔,猪)的血管平滑肌增殖生长早且快,相反,老龄动物则生长缓慢。在生化性质方面,收缩型细胞比合成型细胞的β-极密度脂蛋白(β-VLDL)对其受体结合能力强,低密度脂蛋白(LDL)分解降低,即脂质容易在胞质沉着。此外,像基底膜中的肝素样物质、胆固醇代谢等也有改变。合成型细胞内色素C氧化还原酶成倍增加,酸性磷酸酶亦呈3~4倍增加,说明这两类细胞不仅在形态学上,在生化、生理反应方面也发生了较大改变。 第六节 血管细胞培养的鉴定一、血管内皮细胞鉴定 在操作过程中,可能混入成纤维细胞平滑肌细胞。鉴定血管内皮细胞基础是根据他自身的形态、性质。内皮细胞有三个显着特点:①形态学呈单层铺路石样排列,如前所述;②电子显微镜下可发现Weibel-Palade小体;③存在第Ⅷ因子关连抗原(VWF),用免疫法测定为阳性反应。此外,在硬化血管取材时,巨噬细胞转化的泡沫细胞可能混入,除形态学的差异外,泡沫细胞含有丰富的氧化修饰的LDL,氧化LDL与相应抗体反应后在荧光显微镜下极易区别。 二、平滑肌细胞的鉴定 如前所述,平滑肌细胞除形态、排列有其自身特点外,重要一点是胞浆内有很多与细胞纵轴平行的肌丝及与其相连的致密体。在培养时,对正常组织而言,主要混有成纤维细胞,内皮细胞。能够准确识别其中一、二类细胞,其他细胞也就不难鉴别了。 三、常用的鉴定方法和条件 细胞鉴定法一般有细胞形态学观察法、免疫化学技术观察法、活细胞直接观察法和培养细胞生物化学性状检测。 1.细胞一般形态学观察法 常用方法有两种,一是用普通显微镜,将细胞固定,染色后观察;二是用电子显微镜将组织细胞切片、固定、包埋后观察。 2.免疫化学技术观察法 免疫细胞化学技术是用荧光素或酶等标记物或显示物标记特异性抗体,通过免疫学中的抗原抗体反应与细胞内的相应抗原结合,形成带有荧光素或显色物的抗原抗体复合物,用荧光显微镜或普通显微镜观察复合物存在与否,达到鉴别细胞的目的。这一技术包括标本处理(制备、保存、固定等),染色和结果判断。 3.活细胞直接观察法 细胞培养法可直接观察活细胞,是组织培养技术的一个突出优点。培养的活细胞在一般显微镜下,由于细胞透明,反差很少,不易看清细胞内的结构,因此这一技术需要采用相差显微镜。较新的显微摄影术(time-lapse cinemicrophotagraphy,TLCM)是直接记录活细胞动态变化最为理想的方法,能记录细胞连续动态变化过程,具有客观性和示教性。 4.培养细胞生物学性状检测 观察细胞在体外培养过程中,从初代培养开始,到继续培养和传代培养必须每天进行常规观察细胞是否有污染,生长状况,培养液是否需要更换,这是保证实验成功的基础。所谓生物性状检测包括上述三种方法的运用,这里主要谈以下几个方面:①形态学观察,培养的细胞可能每日每时都会发生形态改变,形态观察又包括一般形态学观察,超微结构观察如亚细胞器微绒毛的形态,微丝微管,核仁的形态和数量排列分布状况等;②细胞增殖生长观察,包括细胞计数,计数细胞是测定细胞绝对增长数量常用最简便的方法;细胞分裂指数(mitotic index,MD)即细胞分裂指数=细胞分数相数/1000细胞×100。计算分裂相时要注意掌握确定分裂相标准,其中主要是确定好划分间期和前期、末期和间期等的界限。另外,还有两个指标即接种存活率和克隆形成率,细胞接种存活率=形成克隆数/接种细胞数×100,细胞数接种率=贴壁存活细胞数/接种细胞数×100;③其他观察,如癌细胞具有浸润性生长能力,这一能力是检测癌细胞的指标。 总之,动脉粥样硬化是多因素、多细胞相互作用的结果,细胞培养是研究这一疾病最有效方法之一。不同的动物血管组成、性质不同;不同研究者有不同的实验目的,所采用的方法也不尽相同。这里只是将血管内皮细胞和血管中膜平滑肌细胞的培养和鉴定作一扼要叙述,随着研究的深入,方法和手段也会不断改进和发展。 (黄俊军 周新) (动脉粥样硬化模型及细胞培养)参考文献1.PengSK,Cholesterol oxidation derivatves and arterial endothelialdamage.Atherosclerosis,1995,54:122 2.秦树存,硝苯吡啶对中国小型猪实验性动脉粥样硬化的抑制作用,中华心血管病杂志,1992,20(1):41-44 3.李侠,实验性动脉粥样硬化海拨差异的超威结构研究,中华心血管杂志,1994,22(30:209-211 4.孙宝贵,实验性动脉粥样硬化狭窄及球襄腔内成形术的形态学变化,中华心血管杂志,1992,20(2):126 5.徐小平,Isradipine对动脉粥样硬化进程影响的实验研究,中华心血管杂志,1994,22(6):455-457 6.NomotoA.Antiatherogenic activety of FR 34235(Nilvadipine),a new potent calciumantagonist effect on cuffinduced intimal thickening of rabbit carotid arteryhAtherosderosis.1987,64:255 7.NickersonCJ.Effects of hypertention and hyperlipidemia on the myocardium and coronaryvasculature of the WHHL rabbit,Exp Mol Pathol,1992,56:174 8.RainesEW,Smooth muscle cells and the ,pathogensis of the leions of atherosclerosis,BrHeart J,1993,69(suppl):S30 9.Chamley-CampbellJ,The smooth muscle cell in culture .Physiol Rev,1976,59:1 10.江 第二十三章 转基因动物在动脉粥样硬化研究中的应用转基因动物(transgenicanimal)是指用实验方法导入的外源基因在其染色体基因组内稳定地整合并可以表达和传与后代的一类动物。自1980年Gordon等将猿猴病毒(SV40)和人单纯疮疹病毒(HSV)的tk(thgmidinekinase)基因整合后的质粒直接注入到小鼠受精卵原核中,首次成功地培养出转基因小鼠(transgenicmice,TGM)后,已先后有牛、羊、猪、兔、鱼等动物基因转移成功。研究的目的主要是采用人为的方法改变动物的基因组组成,以获得各类疾病模型;基因工程育种;将动物做为分子工厂,生产对人类有价值的产品等。 转基因动物是实验动物学与分子生物学紧密结合的成果,是在胚胎和重组DNA技术发展的基础上产生的,能有活体中接近真实地再现某一特定基因的表达和所导致的后果,把复杂系统简化进行研究,是目前层次最高的实验体系。建立特定的转基因动物模型,研究外源基因在整体动物中的表达调控规律,具有系统的整体性和独立性,能够从四维时空观察基因调控的整体效应。近十年来,转基因动物这一生命科学研究的新体系已被广泛应用于脂蛋白代谢及其紊乱与动脉粥样硬化(atherosclerosis,AS)的病因、发病机理及治疗等方面研究,并取得许多令人瞩目的研究成果。 第一节 建立转基因动物的方法1.目的基因的设计 在进行转基因动物研究时,首先要针对实验目的设计待转移的目的基因,如随机整合型基因或基因敲除(gene knockout)型载体基因。随机整合型基因可来自于同一基因,也可来自于不同基因(拼接基因)。从结构上看,随机整合型基因可分为结构基因与调控序列两部分。若来自于同一个基因,那么该基因必须完整,包括5上游启动子区和3下游的加尾信号(polyA signal)区等,可从基因组文库中分离完整的基因。拼接基因应用更为广泛,可通过选择不同的启动子来控制外源基因表达的组织特异性。进行基因剔除转基因动物研究时,首先要设计与待剔除基因的同源性的载体基因,包括正负选择标志基因,通过同源重组(同源取代或同源插入)而使目的基因失活,从而建立缺基因动物。在进行基因设计时,还应考虑转基因动物的遗传背景和设计相应的检测方法,必要时设计一个报道基因(reporter gene)。 2.载体的选择 运用转基因动物研究基因表达,特别是在研究遗传性疾病和进行基因治疗时,选择合适的基因载体是十分必要的。载体主要用于未克隆基因的扩增和选择,有关实验表明,载体有DNA序列可以干扰外源基因的表达,其原因可能与DNA的甲基化有关。最早用于哺乳类细胞表达载体的病毒是转化型DNA病毒,如SV40和腺病毒。这些载体的主要缺点是接受外源DNA容量太小,只能携带约7~8kb的外源序列,因此这类载体不可能表达其他许多与疾病有关的功能基因。与其他载体相比,从鸟类和鼠类中获得的逆转录病毒是目前应用广泛的一类最有前途的载体。这类病毒为失去致病能力但仍有感染能力的缺陷病毒,如通常使用的禽白血病病毒和罗氏肉瘤病毒。这类病毒载体能有效地把外源基因导入哺乳动物靶细胞,其整合方式在结构和功能上较稳定,功能基因插入和表达很容易。为避免逆转录病毒启动子干扰和携入诱变的可能性,许多研究者还构建出一类已被剪除了自身启动子和增强子序列的逆转录病毒。这类失活载体只表达由基因携带的启动子起始的载体编码序列,但这种载体因其滴度低而使应用受到限制。近来有报道指出,利用带有部分缺失失活的新霉素抗性基因(neor)的缺陷型整合逆转录病毒载体感染大鼠细胞,使整合到细胞中的neor缺陷基因功能得到恢复。非整合型病毒载体,如HSV载体已引起人们极大关注,这类病毒基因组较大(150kb),它们具有比其他已知载体接受更大外源序列的能力,故能够转移和表达较大的基因。 3.背景及种系的选择 由于不同种系的动物对不同疾病的易感性不同,在进行转基因动物研究时要考虑遗传背景及种系的问题。许多实验室在随机杂交背景下建立了转基因动物,同近亲交配的转基因动物相比,这一背景下产生的胚胎不但数量多,而且健康。尽管如此,随机交配下的碱基分离可能影响转基因动物的表型,降低了一个已知转基因动物的作用。在混合遗传背景下,碱基分离也直接影响基因动物的表达。已发现一种能够直接抑制了转基因的表达的种系特异性修饰因子(SSM-1)。在C57BL/6J鼠系中,SSM-1碱基分离直接抑制了转基因的表达。相反,在DBA/2JSSM-1鼠中可交配的DBA/2J小鼠,可以消除SSM-1碱基分离产生变异的转基因表达。 迄今为止,已相继报道了小鼠、大鼠、兔、猪、牛和羊等转基因的动物。目前,研究者均倾向于使用小鼠作转基因的动物。最初的转基因动物就是在小鼠体内完成的,已确定了小鼠的连锁图。尽管由于小鼠与人脂蛋白系统有很大差异,如小鼠缺乏胆固醇酯转移蛋白(CETP)、载脂蛋白(a)[Apo(a)]和脂蛋白(a)[Lp(a)],其多数胆固醇通过HDL而不像人那样通过LDL进行运输,但由于小鼠易于饲养管理,生长周期短,容易获得已经定性的近交交配鼠和遗传突变体,并且易于进行快速连锁分析,其作为研究动物也较为经济实惠,故常被用作建立转基因动物模型。但小鼠对AS具有抗性,为使小鼠产生AS,必需喂养非生理性食物,包括1.25%的胆固醇(为人类饮食的10~20倍),15%的脂肪和0.5%的胆酸(非正常食物组分)。严格地讲,这种饲料是具有毒性的,但可使小鼠的非高密度脂蛋白胆固醇(HDL-C)增至200~300mg/ml,4~5个月即可形成AS。 4.转基因方法 进行转基因动物研究的基因转移方法有多种,如早期的畸胎癌细胞(teratocarcinoma cell,TCC)植入法、逆转录病毒感染法、显微镜注射法以及近几年新出现的方法如电转移法,精子载体法,胚胎干细胞(embryonal sterm cell,ES细胞)法、基因直接导入法等。其中较常用的三种方法有显微注射法、逆转录病毒感染法和胚胎干细胞法(见图23-1)。
图23-1 三种常用的转基因方法 显微注射法是直接将重组DNA分子以微注射的方式导入单细胞卵的原核中,再将它植入假孕母鼠。大约20%的微注射胚胎能够将外源基因整合到染色体基因上组上;大多数的转基因的动物能够将整合的基因传给后代,建立起转基因鼠系。逆转录病毒感染法是用高滴度的、携带外源基因的重组逆转录病毒感染发育早期的胚胎,再将感染病毒后的胚胎植入假孕母鼠,以产生转基因的动物。逆转录病毒的整合并不影响宿主DNA序列的重排,感染的复数容易调整,每个卵大约有10次整合的机会。病毒染色体还能提供一个TAG分子,加速覆盖部位的迅速克隆。这些特征使逆转录病毒转基因法用于研究随机突变。从ES细胞到转基因动物是从哺乳动物胚胎中分离出ES细胞,通过转导或传染的方法,将外源基因转入ES细胞,再以微注射的方式将其植入鼠的胚胎。这种方法能够将外源基因定位导入靶细胞染色体上某一特定部位,或使某一基因发生定点突变。 上述三种方法各具有优缺点。显微注射法相对整合率较高(1%~10%),操作简便,易于获得成功。但外源基因通常以多拷贝串联的形式随机整合于受体基因组中,这种异常排列可能妨碍其表达的正常调节。逆转录病毒感染法的外源基因通常是单位点、单一拷贝整合,整合通常发生在逆转录病毒的长末端重复区(LTR),从而保证了外源基因结构的完整性。但整合效率较低,而且操作比较繁琐,能被导入的基因大小有一定限制(通常为10kb左右)。ES细胞法多只能建立嵌合体动物,如果注射有外源基因的ES细胞在胚胎内的发育过程中嵌合到生殖腺,则所建立的嵌合体动物不能把外源性基因传给后代。但通过ES细胞法可以进行基因打靶(gene targeting)或基因剔除产生缺基因动物,这是目前建立某些疾病动物模型的一种新的有效途径。 5.转基因动物模型的建立 新出生的转基因动物通过点杂交、聚合酶链反应(PCR)和免疫印迹杂交(Southern Northern blotting)等方法,先筛选出有外源基因整合的阳性动物,传代后分别在mRNA和蛋白水平上检测外源基因在转基因动物中的表达情况,对外源基因表达产物的生物活性和生化性质进行鉴定,以及检查转基因动物的生理功能和是否出现某些疾病病症状的表型等。进一步培育和筛选出转基因动物的纯合子,或/和某些相关种系的动物杂交,从而建立某种疾病的转基因动物模型。 利用转基因技术培育人类疾病动物模型比用其他方法更加优越,它可在动物原来遗传背景的基因上,通过改变某种基因的表达水平而实现。这种模型模拟动物症状单一,接近于病人症状,产生这些疾病症状的原因是外源基因的转入。转基因动物模型可按照人们的愿望进行设计和培育,其建立过程的本身就可进行疾病机理的研究。由于转基因动物的发育过程中又引入了时间和空间的因素,这样就建立了一个立体的实验动物体系,不但能从动物整体水平的组织器官水平上进行研究,而且还可以深入到细胞水平和分子水平,为发病机理、药物筛选和临床医学研究提供了比较理想的实验动物体系。自从1980年第一个转基因动物问世以来,经过科学家们的不懈努力,已相继建立了高脂血症(HLP)、AS、高血压、低血压等心血管疾病的转基因动物模型。其中应用最广的是各种转基因小鼠(TGM)模型。 第二节 转基因小鼠的制备在研究心血管疾病时,主要运用显微注射法、基因打靶或基因剔除等方法制备各种TGM模型。 1.显微注射法 Gordon等人首次成功地将含有HSV和SV40DNA片段的重组质粒DNA以显微注射法导入小鼠受精卵的雄原核内,得到了带有这种外源DNA顺序的TGM。1982年Palmiter等运用此法得到的所谓“超级巨鼠”(supermouse)曾引起整个生物学界的轰动。这一方法外源DNA整合率高、容量大,DNA长到50kb仍然有效,实验周期缩短,因而应用较广泛,是制备TGM的一种常用方法。 这一方法的实验程序如下:⑴准备假孕母鼠(养母):将可育雌鼠与输精管结扎后绝育的雄鼠交配,剌激雌鼠发生一系列妊娠变化而得到假孕母鼠作为受精卵转基因后的养母;⑵受精卵的准备:可育雌鼠注射孕马血清与绒毛膜促性腺激素(HCG)促使超排卵。处理后与可育雄鼠交配。次日从输卵管内收集受精卵备用;⑶基因导入:用显微注射装置将目的基因溶液导入受精卵雄性原核内;⑷胚胎移植:将已转入基因的受精卵自背部植入假孕母鼠的输卵管内,使胚胎在养母体内发育成熟;⑸对幼鼠的鉴定:①幼鼠发生断乳后自尾部提取DNA,与目的基因探针作分子杂交,鉴定外源基因是否整合,有整合的鼠称为首建鼠(founder);②建立鼠系,将带有外源基因的小鼠与未经转基因的小鼠交配、传代后,后代有50%机率带有整合的基因供实验用。也可将合适的组织进行细胞培养建立细胞系;③自小鼠内脏提取RNA,与目的基因探针做分子杂交,比鉴定外源基因的表达和表达的组织特异性。表达产物可以测定活性的,也可直接自血液或组织测定活性蛋白质,常用的方法如酶联免疫吸附试验(ELISA)或放射免疫测定(RIA)等。亦可取胚胎进行分析。显微注射法简化的实验过程如图23-2所示。我国已有少数实验室(如中国医学科学院基础医学研究所)应用此法进行载脂蛋白TGM研究。
图23-2 显微注射法制备转基因小鼠的程序 2.基因打靶与基因剔除技术 ES细胞是从哺乳动物早期胚胎发育产生的内胚团(inner,cell mass)中分离出来的。它本身是二倍体,能在体外培养,具有高度的全能性,可以形成包括生殖细胞在内的所有组织,并且在不同的培养条件下表现出不同的功能状态。这种细胞有两个特点,一是它本身可以分裂、增殖,形成细胞集落;另一特点是经过发育可以形成正常的动物后代。因此,借用ES细胞系可将人们企望的某种不完整的、无功能基因直接引入到ES细胞中,通过细胞增殖、筛选可得到丧失了某种基因功能的动物后代。正是由于ES细胞的研究成功与广泛应用,才使得基因打靶与基因剔除技术在转基因动物中的应用成为可能而且近来取得长足发展。 基因打靶是指外源DNA片段上带有与受体细胞染色体相应部位的同源序列,导入ES细胞后在同源部位发生定点整合,这种整合是通过同源重组的方式来实现的。Piedrahita等(1992)应用此技术已成功地筛选出携带突变ApoE基因杂交鼠后代。该方法的一般策略如下:
如果外源DNA含有突变失活的基因,定点整合人ES细胞染色体后取代原来的同源序列,即是基因剔除。将这样的ES细胞转入小鼠胚胎,便可得到基因剔除的基因小鼠。多采用突变基因(mutated gene)剔除正常基因以产生定位突变(target mutation)。即首先选定需要突变基因的全部或部分DNA序列,通过插入、修饰、删除或置换等手段落使其突变,成为靶载体,将靶载体导入小鼠ES细胞中,使之与细胞染色体内同源的靶序列进行重组,达到定位突变细胞内该基因的目的。然后在细胞水平和分子水平筛选富集发生突变细胞,并注射到小鼠囊胚腔内,将这些囊胚导入假孕母鼠子宫中,所产生的子代雄性嵌合鼠与正常雌鼠交配可获得生殖系携带该突变基因的纯合鼠。最后对纯合鼠的表型、基因型、基因表达及其产生等进行分析。 目前筛选真正发生了同源重组的ES细胞的方案有数种,如正负双向选择法(positive and negativeselection,PNS)、标记基因的特异位点表达法及PCR法,其中用得最多的方法首推PNS法。其基本原理是:构建含有一段与靶基因同源序列(10~15kb)的载体,该序列的一个外显子插有neor基因作为正选择的标志,在此序列3’端插有不含启动子的疱疹病毒胸苷激酶(HSV-tk)基因作为负选择,HSV-tk基因由邻近的neor基因启动子调节。用电转移(electroporation)法将重组体导入ES细胞,继续作体外培养,并以新霉素(G418)和致死核苷类似物(GANC)作双重筛选。因随机插入的DNA通常以从头至尾整合入受体细胞DNA中,HSV-tk+基因产物可使GANC转变成一种有毒物质使细胞死亡。如果发生同源重组,由于tk基因在同源区之外不能整合,neor基因在同源区之内得以保留,这样受体细胞抗G418有正选择作用,对GANC无转变功能而有负选择作用,因此认为存活的细胞是与导入基因发生同源重组的(图23-3)。Plump等(1992)用基因剔除技术已培育出缺ApoE基因的TGM模型,并利用这一AS小鼠模型研究了饮食和遗传因素对AS的影响。
图 23-3 正负双向选择法示意图 a:同源重组;b:随机整合;neor:新霉素抗性基因;HSV-tkc:疱 疹病毒胸苷激酶基因;GeneX:干细胞内源基因(与导入基因同源); G418:新霉素;GANC:抗致死的核苷类似物GANC;GANC:核苷类似 物参与合成,细胞致死。 近几来,随着对基因失活方面研究的深入,引发了基因剔除技术的一大飞跃,产生了条件性基因剔除(conditional gene knockout)。条件性基因剔除是指某一特定细胞类型或细胞发育的特定阶段剔除某一特定基因的技术。目前多采用Cre-loxP重组系统(Cre-loxP-mediated genereplacement ,Cre-loxP recombination system)。其中Cre重组酶来源于侵染大肠杆菌P1噬菌体。分子量38000,无论在大肠杆菌体内或体外,它都能启动DNA分子间或分子内的联合与重组,重组发生在一个被称为loxP的特异位点(loxp site),且不需要其他的蛋白质因子。在Cre酶存在时,两个loxP位点可以同源重组,切除其中间的部分,留下一个loxP位点。其原理如图23-4所示。研究发现,在哺乳动物细胞中Cre重组酶也同样能引起DNA联合和位点特异性重组。
图23-4 Cre酶作用原理 1Cre基因转译成Cre酶;2Cre酶作用于基因组上loxP位点;3Cre酶使两个loxP位点联合;4两个loxP位点发生同源重组切除X基因及一个loxP位点而仅留下一个loxP位点。 Cu等(1994)在鼠的ES细胞中利用Cre-loxP重组系统进行条件性基因剔除的程序如下:①用常规性基因剔除方法将一段新构建的DNA序列整合至内源基因组,这段新构建的DNA序列由新的(突变的)基因片段,选择性标记基因HSV-tk及neor、一个将被取代的正常基因片段等几部分组成。在此新构建的NDA序列中,在可选择性标记基因和正常基因片段的两侧都连有loxP位点;②经过基因剔除的ES细胞被一个编码Cre重组酶载体迅速传染,因此处于两个loxP位点之间的HSV-tk、neor及正常的野生型基因均在Cre酶的作用下而被切除,只在原来的位置上留下了突变的基因和其3’端带有一个loxP位点,其Cre-loxP重组系统进行条件性基因剔除程序如图23-5所示。 条件性基因剔除系统的建立,使得转基因的目的更加明确,效果也进一步精确可靠,是基因剔除方法上的一个重大突破,将给动脉粥样硬化的研究增加更便利的条件。
图23-5 CreloxP重组系统进行条件性基因剔除程序 1有待于被剔除的基因组上某野生型基因片段;2将一个loxP位点插在野生型基因片段的3’端;3将新构建的DNA序列整合到基因组上;4在Cre酶的作用下切除HSV-tk、neor野生型基因及一个loxP位点;5经过Cre-loxP重组系统作用后所形成的DNA序列。 第三节 转基因小鼠模型与动脉粥样硬化随着分子生物学的发展和脂代谢相关蛋白基因的克隆,序列测定及表达调控组件研究的深入,为探讨载脂蛋白及其他脂代谢相关蛋白和AS的关系,以期建立As TGM模型奠定了基础。现已对ApoAⅠ、AⅡ、AⅣ、B、CⅠ、CⅢ、E和Apo(a),以及LDL-R、CETP、LRP及LPL等进行了转基因动物研究,先后建立了各种TGM模型。为深入了解脂蛋白运输基因如何调控以及高表达与低表达在调控脂蛋白代谢中的主要作用和为研究脂蛋白代谢紊乱及AS等提供更好的实验动物模型。临床资料表明,脂蛋白代谢等紊乱与AS的敏感性密切相关,特别是各种Apo基因异常表达引起的高脂血症和AS以及各种Apo TGM在此领域的研究已是极其活跃与有价值。 Rubin等将人ApoA-Ⅰ基因导入,C57BL/6这一鼠采用以评价转基因对饮食所致AS的影响时发现,表达人ApoA-Ⅰ的TGM其血浆所含人ApoA-Ⅰ和HDL浓度高于非转基因C57BL/6小鼠,人ApoA-Ⅰ基因表达可减少动脉窦泡沫细胞损害区域,这表明ApoA-Ⅰ基因表达伴随着HDL-C水平的提高可抑制AS的产生。因此,可应用ApoA-ⅠTGM探索高胆固醇饮食或Probucol等降血脂药物引起的HDL-C和ApoA-Ⅰ水平改变的机制。Williamson等发现ApoA-Ⅰ基因剔除鼠ApoA-Ⅰ水平低下并伴有HDL-C低下,而表达人ApoA-Ⅱ的TGM,其HDL-C并不增加,小鼠原有的ApoA-Ⅰ和A-Ⅱ也不减少。这也是临床上所见到血浆Apo量与HDL-C之间无相关性的证据之一。研究TGM可发现ApoA-Ⅱ与影响HDL量的ApoA-Ⅰ不同,它主要影响HDL的质。Schultz等将分别表达人ApoA-Ⅰ和A-Ⅱ的TGM杂交后发现,同时表达ApoA-Ⅰ、A-Ⅱ基因的TGM抑制AS形成的能力弱。同时也说明并非所有HDL颗粒都有抗AS作用。 已有报道P1噬菌体文库中分离出含有5’端(19kb)和3’端(14kb)侧翼序列在内的整个ApoB100基因(约43kb)的人ApoB克隆。将其导入小体内发现这种TGM血浆中人ApoB100水平显著增加。另外人ApoB100基因转录在小鼠体内能被有效地剪辑。分析ApoBTGM脂蛋白谱发现与人相似,含有高水平LDL-C。这一模型有助于高胆固醇血症与低β脂蛋白血症等发病机理的研究。 研究ApoC-ⅢTGM发现小鼠血浆甘油三酯(TG)水平随ApoC-Ⅲ转基因的表达增加而增高,通常TG含量比正常小鼠高二倍以上。因此ApoC-ⅢTGM是第一个人为原发性高TG的动物模型。有推测认为高TG血症的形成,一是因为VLDL在体内滞留时间延长而非残余颗粒累积所致,二是由于改变了Apo表面组成或/和游离脂肪酸升高所引起。这些研究提示ApoC-Ⅲ基因的表达能调节人体TG水平,人ApoC-Ⅲ基因过量表达促进AS的形成。 Shimano等通过把大鼠ApoE基因与金属硫蛋白启动子一起导入小鼠体内,所制备的TGM血浆ApoE水平是正常对照组的4倍,并可观察到VLDL和LDL-C的急剧下降。此外,这种TGM对饮食所致高胆固醇血症具有耐受性。ApoE结构基因位点存在多态性。在若干变异型易形成Ⅲ型高脂血症(HLP),故这一模型期望能用于Ⅲ型HLP发病机理的研究。近年运用基因打靶与基因剔除技术已成功地制备出一类新的ApoETGM模型。Plump等发现缺失ApoE基因的TGM血浆LDL和VLDL水平均显著高于正常对照组,HDL水平则低于正常小鼠。Paszty等研究发现,表达人ApoA-Ⅰ且HDL含量高的ApoE基因剔除小鼠比不表达人ApoA-Ⅰ且HDL含量低的ApoE基因剔除小鼠难以形成AS。 Chiesa等通过把鼠转铁蛋白启动子与Apo(a)cDNA相连接,导入小鼠体内制成Apo(a)TGM。转基因最初在肝脏表达,并在脑、睾丸、心脏和肾脏中可检出少量Apo(a)mRNA和蛋白质。Apo(a)TGM动脉窒亦可见明显损害,这提示Apo(a)本身就可致AS,其作用待探讨。Callow等将过度表达ApoB的TGM与表达Apo(a)的TGM进行杂交,制备出能同时表达人ApoB与Apo(a)的TGM。这种TGM能有效地装配出与人血浆Lp(a)颗粒非常相似的Lp(a)分子。Liu等研究ApoA-Ⅰ与Apo(a)转基因表达间的相互关系时发现,仅表达Apo(a)的TGM与对照组小鼠脂蛋白谱相似,而其对饮食诱导所致的AS敏感性显著增加。同时表达Apo(a)与ApoA-Ⅰ的TGM其HDL浓度是仅表达Apo(a)的TGM的2倍,而其形成早期AS斑块的可能性仅为前者的1/20。由于Lp(a)是AS发病的独立危险因子,而Apo(a)与纤溶酶原(PLG)具有高度同源性,故Apo(a)TGM是研究Lp(a)发病关联方面非常有意义的动物模型。 糖尿病、肾病等疾病与心血管疾病并发症密切相关。近年来有关这些疾病的转基因动物模型也相继建立。Allison等曾以大鼠的胰岛素启动子调节小鼠第一类组织相溶性抗原复合物(MHC-1)基因,在TGM的胰岛β细胞表达,引起胰岛异常,胰岛素分泌降低从而建立了胰岛素依赖型糖尿病(IDDM)TGM模型。Marban等将8.8kb的胰岛素基因注射到小鼠受精卵原核,培育出高胰岛素血症TGM模型。Mackey等报道用SV40早期区基因进行转基因动物研究,建立了肾小球硬化和肾囊肿TGM模型。Doi等通过生长激素和生长激素释放因子的TGM研究,建立了进行性肾小球硬化TGM模型等。随着转基因技术的不断完善,人类疾病的的转基因动物模型不断涌现,为攻克心血管疾病提供了可选择性的动物模型与研究手段。 展望虽然转基因动物(尤其是TGm)这一生命科学研究的新体系引入到心血管疾病研究领域只有短短十年时间,但已取得了惊人的成果。转基因动物模型在脂代谢障碍与AS病因和发病机理中的研究应用仍然方兴未艾。例如:运用日益成熟的各种转基因技术建立更多的与脂代谢相关的TGM系动物模型;由仅研究含一种与脂代谢紊乱有关的基因的TGM转向研究含有几种基因的TGM研究;运用基因打靶与基因剔除技术研究缺失基因对AS生理功能的影响;运用成熟的TGM研究各种基因的表达调控;如何将转基因技术(如基因剔除)运用于心血管疾病的基因治疗;利用目前成熟的转基因技术,建立我国自已的转基因和缺基因动物系列,并使用这些这动物心血管疾病发病机理等方面都有待进一步研究探讨。 利用转基因方法建立人类疾病动物模型和用其他方法相比具有许多优点。诸如遗传背景清楚,遗传物质改变简单,建立的模型更自然和更接近病人症状;建立过程操作简便,周期短,而且建立的转基因动物模型不需要特殊的饲养条件即可保持疾病症状,按照孟德尔规律代代相传,维持费相对较代等,但是由于转基因方法和技术上的原因,目前转基因动物模型仍存在一定的问题。譬如有时转基因动物模型缺乏典型的像病人那样的症状;外源基因插入宿主基因组而引起插入突变,破坏宿主基因组基因而产生异常,甚至导致转基因动物的不育和死亡;外源基因在宿主动物染色体上整合的拷贝数不等,单位拷贝的外源基因表达水平不均一,给外源基因的表达控制带来困难;症状严重的还易早死;外源基因在宿主染色体上的部分整合导致外源基因的不表达,不出现预期的严重的还易早死;外源基因在宿主染色体上的部分整合导致外源基因不表达,不出现预期的症状或与预期的结果不符合;有时还会出现整合的外源基因遗传丢失而导致转基因动物模型症状的不稳定遗传等。 分子生物学的迅速发展,导致转基因技术的出现和转基因动物的形成,从而建立了一类新的动物模型,可用于各个领域,各种目的的研究。尽管人类疾病转基因动物模型仍然存在一些问题,但随着转基因技术的不断完善,理想的转基因动物模型必将明显增多。动脉粥样硬化是一复杂多因素引发的疾病,涉及到环境、遗传等因素的作用,也是人类死亡的主要原因之一。转基因动物作为一种新的研究工具与实验手段,在现代生理学、遗传学,药物学、生物化学与分子生物学等学科研究的配合下,必将更有助于人们找出早期诊断心血管疾病的方法,寻找新的治疗途径与对策。 (鄢盛恺) (转基因动物在动脉粥样硬化研究中的应用)参考文献1.HonganB,Costantini F,Lacy L,et al.Manipulating the mouse embryo-A Lab Manual ColdSping Harbor NY:Cold Spring Harbor Lab,1986,332-340 2.琦祖和,转基因动物技术,中华病理学杂志,1993,22:375 3.GordonJW ,Scangos GA,Plotdin DJ,et al Genetic transformation of mouse embryos byonicroinjection of purified DNA,Proc Natl Acad Sci USA,1980,77:7380 4.鄢盛恺,载鬲蛋白转基因小鼠的研究进展,国外医学临床生化化学家与检验分册,1996 5.BreslowJL,Transgenic mouse models of lipoprotein metabolism and atherosclerosis ProcNatl Acad Sci USA,1993,90:8314 6.BreslowJL,Insight into liporotein metabolism from studies in transgenic mince .Ann RevPhysid ,1994,56:797 7.何泉,王芳菲,陈兰英,心血管疾病转基因动物模型的建立,高血压杂志,1996,4:76 8.BrinsterRL,Chen HY ,Trwmbaaer ME,et al Factors affecting the efficency of introducingforeign DNA into mice by microinjecting eggs Proc Natl Aead SciUSA,1985,82:4438 9.EngerP,Haasch D,Pinkert CA,et al A strain-specific modifier on morse chromosome4controls the methyla tion of independent transgene loci,Cell,1991,65:9393 10.EricksonRP,Why isnt a mouse more like a man?Trends Gen ,1989,5:1 11.PalmeterRD,Brinster RL,Hammer RE,et al Dramatic growth of mice that develop from eggsmicrojected with metallothinonein-growth lwrmone fusion germets ,Nature,1982,1300:611 12.胡以平,转基因小鼠一生命科学研究的新体系,自然杂志,1990,13:28 13.PiedrahitaJA,Zhang SH,Hagaman JR et al Generation of mice corrging a mutantapolipoprotein E gene inacfivated by gene targeting in embryonic cells ProcNatl Acad Sci USA,1992,13:28 14.陈保生,载脂蛋白基因异常表达引起的高脂血症和动脉粥硬化及转基因技术在研究心血管疾病中的意义,中国循环杂志,1995,10:65 15.刘德培,方福德,梁植权,基因剔除,生理科学进展,1995,26:88 16.MansourSL,Thomas KR,Capecchi MR,Dsiruption of the proto oncogene int 2 in mouse embryoderived stem cells a general strategty for targeting mutations tonon-selectable genes ,Narure ,1988,336:348 17.PlumpSA,Smith JD,Hayek T,et al Severe hypercholesterolemia and atherosclerosis inapolipoprotein E-deficient mice created by homologous recombination in ES cellscell,1992,71:343 18.SauerB,Henderson N,Site specific DNA reambinaton in mammalian cells by the Crerecombinsae of bacteriophage P1,Proc Natl Acad Sci USA,1988,85:5166 19.CuH,Marth JD,Orban PC,et al.Deletion of a DNA polymerase βgene segment in Tcellsusing cell type specific gene targeting Scince,1994,265:103 20.RubinE,M,Kraurs R,M,Spangler E,A et al Inhibition of carly atherogenesis intransgenic mice by human apolipoprotein A I ,Nature ,1991,353:265 21.HayekT,Ito Y,Azrolan N,et al Dietray fat increases high denritylipoprotein(HDL)levels both by increasing the rtansport rates and decreasingthe fractional catabolic rates of HDL cholesterol ester and apolipoprotein(Apo)A I presentation of a new animal model and mechanistic studies in humanApoA I transgenic and control mice .J Clin Invest ,1993,91:1665 22.HayekT,C hajek-Shaul T,Walsh A,et al Probucol decreases allipoprotein A I tranrportrate and incresaes high density lipoprotein cholesteryl ester fractionalcatabolic rate in control and human apolipoprotein A I transgenic mice,Arterioscler Thromb,1991,11:1295 23.WilliamosnR,Lee D,Hegaman,Jet al Marked reduction of high denrity lipoprotein cholesterolin mice genetically modofice to lack apolipoprotein A I Proc Natl Acad SciUSA,1992,89:7234 24.ShultzJR ,Gong EL,McCall MR,et al.Expression of human apolipoprotein A-Ⅱand its effect on high density kliporoteins in tranrgenic mice ,JBiol Chem,1992,267:21630 25.SchultzJ,R,Verstryft J,Gong E L,et al Protein compositoin determines theanti-atherogenic properties of high densicty lipoproteins in transgenic miceNature ,1993,365:761 26.LintonMF ,Farese RV Jr,Chiesa G,et al.Transgenic mice ezpressing high plarmaconcentrations of human apolipoprotein B and lipoprotein(a),JclinInvest,1993,92:3029 27.CallowMJ,Stoltzfus LJ,Lawn RM,et al Expression of human apolipoprotein B and assemblyof lipoprotein (a)in transgenic mice Proc Natl Acad Sci USA,1994,92:21130 28.ItoY,Azrolan N,O Connell A,et al ,Hypertriglyceridermia as a result of humanapolipoprotein C-Ⅲgeneexpression in transgenic mice ,Science,1990,249:790 29,AaltSetala K,Fisher EA,Chen X,et al Mechanism of hypertriglycerdemia in humanapolipoprotein (Apo)CⅢ transgenicmice dimished very low density lipoprotein frctional catalbolic rate associatedwith increased ApocⅢ and reducedApoe on the partides J clin Invest,1992,90:1889 30.ShimanoH,Yamada N,Katsuki M,et al .Plasma lipoprotein metabolism in transgenic miceoverczpressing apolipoprotein E accelerated clearace of lipoproteins containingapolipoprotein B J Clin Invest,1992,90:2084 31.PasztyC,Macda N,Verstuylt,J,et al.Apolipoprotein A-i transgene corrects apolipoprteinE defieiency-induced atherosclerosis in nice ,j Clin Invest,1994,93:3301 32.ChiesaC,Hobbs HH,Koschinsky ML,et al Reconstitution of lipoprotein(a)by infusion ofhuman low density lipoprotein into transgeinc mice expressing humanapolipoprotein(a),J Biol Chem,1992,267:24369 33.LiuAC .Lawn RM,Verstugft JC,et al Human apolipoprotein A-I preventsatherosclerosis associated with apolipoprotein (a) in transgenic mice ,J LipidRes,1994,35:2263 34.AllisonJ,Campbell IL,Morahan Get al Diabetes in transgenic mice resulting fromnover-expression of classl histocompatibility molecules in pancreatinβcells,Nature ,1988,333:529 35.MarbanSL,Deloia JA,Gearhart JD,et la.Hyperinsulinemia in transgenic mice carryingmutiple copies of the human insuline gene,Dev Genet,1989 36.MackayK,Stnkert JL,Pinkert CA,et al.Glomeralosclerosis and renal cysts in micetransgenic for the early region of SV,Kidney Int ,1987,32:827 37.DoiT,Striker LJ,Quife C,et al Progressive glomeruloscleroxis develops inrtansgenic mice chronically ezpressing growth hormone and growth hormonereleasing factor but not in those expressing insulintide growth factor-1,Am J 第二十四章 DNA的克隆与序列测定近20年来分子克隆技术的发展突飞猛进,重组DNA操作技术包括的范围不断扩大,DNA克隆的方法亦多种多样,特别是PCR技术的应用,以及RFLP、SSCP等技术的开展,使得DNA克隆技术的应用日益广泛。 DNA克隆技术在动脉粥样硬化等疾病的病因及诊疗研究中也有重要的作用。例如在研究脂蛋白酯酶基因发生的特异突变时,可以设计合成扩增引物,进行模板DNA的PCR扩增,所得的PCR产物较小,仅有300多bp,且纯度不足以进测序。为了对此突变序列进行测序分析,就可以采用DNA克隆的方法,将此PCR产物连接到细菌质粒上,再进一步纯化后测序,以便鉴定脂蛋白酯酶的突变序列。 下面简要介绍DNA克隆和测序的常用方法。 第一节 DNA的克隆以质粒或噬菌体作载体进行DNA克隆,在理论上是很简捷的,即用一种限制酶切割质粒DNA,然后在体外与外源,DNA(如干扰素基因,生长激素基因)相连接,再用所得到的重组质粒转化细菌如大肠杆菌,以鉴定重组DNA。 通常所用的质粒载体有pBR322、pUC18、pUC19等,噬菌载体有M13噬菌体载体等。
图24-1 质粒载体的定向克隆 一、质粒或噬菌体载体与外源DNA的连接反应外源DNA片段末端的性质,以及质粒载体和外源DNA上限制酶切位点的性质决定了质粒或噬菌体与外源DNA连接反应的不同策略。 (一)外源DNA带有非互补突出端的片段 用两种不同的限制酶分别消化质粒等载体和外源DNA,可以产生带非互补突出端的片段,这是最容易连接的片段,如图24-1所示。 将已经连接外源DNA的细菌质粒载体转化感受态的大肠杆菌,然后在含有AP等抗生素的平板上鉴定阳性重组体菌落,具体方法有:①检查α互补能力的丧失情况;②对小量制备的质粒DNA进行限制酶切的分析;③核酸杂交。 (二)外源DNA带有相同末端(平端或粘端)的片段 带有相同末端(平端或粘端)的外源DNA片段必须克隆到具有匹配末端的线状质粒或噬菌体载体中,在连接反应中,质粒或噬菌体载体可能发生自身环化,也可能形成串联寡聚物。因而,常常使用碱性磷酸酶去除5’磷酸基团以抑制质粒DNA的自身连接和环化。用细菌碱性磷酸酶(BAP)或牛小肠碱性磷酸酶(CIP)去除线状DNA两端的5’磷酸可以最大限度地减少质粒DNA的自身环化。而具有5’末端磷酸的外源DNA片段可有效地与去磷酸化质粒DNA相连接,产生一个含有两个切口的开环分子。因为环化DNA(即使只带切口的环状DNA)的转化效率比线状DNA高得多,所以大多数转化体都含有重组质粒,如图24-2所示。
图24-2 利用磷酸酶防止载体DNA的重新环化 (三)外源DNA带有平端的片段 外源DNA片段带有平端的片段,平端的连接效率比带有互补末端的DNA要低得多。因此,涉及平端分子的连接反应所要求的T4噬菌体DNA连接酶的浓度和外源及质粒DNA或噬菌体DNA的浓度都要高得多。 (四)连接反应的体系 10×连接缓冲液1μl 10mMATp 1μl 质粒或噬菌体DNa200ng~1μg 外源DNa 200ng~1μg T4噬菌DNA连接酶0.5~2nuits 4-6℃温育8~24h 连接反应结束时,取1~5μl上述反应混合物转化200μl的大肠杆菌感受态细胞,即可将外源DNA与载体接连起来。 二、大肠杆菌感受态细胞的制备和转化细菌转化的方法多以Mendel和Higa(1970)的发现为基础,其基本方法是用冰预冷的CaCl2或多种2价阳离子等处理细菌,使之进入感受态得以转化。 用CaCl2制备新鲜或冷冻的大肠杆菌感受态细胞,常用于成批制备感受态细菌。本法适用于大多数大肠杆菌菌株,且迅速、重复性好。操作过程简述如下。 1.从37℃培养16~20h的新鲜平板中挑取一个单菌落(如大肠杆菌DH52),或1ml新鲜的16~20h过夜培养物,转到一个含有100mlLB培养基的1L或500ml烧瓶中。于37℃剧烈振摇培养约2~3h(旋转摇床200~300r/min),每隔20~30min测量OD600值≈0.4。 2.在无菌条件下将细菌转移到一个,用冰预冷的50ml聚丙烯离心管中,在冰上放置10~20min。 3.于4℃用SorvallGS2转头(或与其离心管相配的转头)以4000r/min离心10min,以回收细胞。 4.倒数培养液,将管倒置1min以使最后残留的痕量培养液流尽。 5.以10ml用冰预冷的0.1mMCaCl2重悬每份沉淀,放于冰上。 6.于4℃用SorvallGS3转头(或与其相应的转头)以4000r/min离心10min,以回收细胞。 7.倒出培养液,将管倒置1min以使最后残留的痕量培养液流尽。 8.每50ml初始培养物用2ml冰预冷的0.1M CaCl2重悬每份沉定,此时,可以迅速将细胞分装成小份,液氮中冰冻,-70℃贮存备用。 9.用冷却的无菌吸头从每种感受态细胞悬液中各取200μl转移到无菌的微量离心管中,每管加DNA或连接反应混合物(体积≤10μl,DNA≤50ng),轻轻旋转以混匀内容物,在冰中放置30min。 10.将离心管放到预加温到40℃的循环水浴中的试管架上,放置90s~2min,不要摇动试管。 11.快速将管转移到冰浴中,使细胞冷却1~2min。 12.每离心管加800μlSOC培养基,用水浴将培养基加温到37℃,然后将管转移到37℃摇床上,温育45min使细菌复苏,并且表达质粒编码的抗生素抗性标记基因。 13.将适当体积(每个90mm平板可达200μl)已转化的感受态细胞转移到含200mmol/l MgSO4和相应抗生素的SOB培养基上。 14.将平板置于室温至液体被吸收。 15.倒置平皿,于37℃培养,12~16h后可出现菌落。 三、用M13噬菌体转染感受态细胞1.感受态细胞的制备 (1)用JM101或TG1等菌的培养菌液在M9基本培养基平板上的划线培养,于37℃温育24~36h。 (2)批量制备冻存的感受态细胞的方法,同大肠杆菌感受态细胞的制备。 2.用M13噬菌体转染感受态细胞 (1)用2×YT或SOB培养液于37℃持续地振摇,将用于铺平板的细胞(JM101或TG1等)培养过夜。 (2)从-70℃以下冰箱中取出一份冻存的JM101或TGI感受态细菌,于室温慢慢融化,立即放在冰上10min。 (3)于各感受态细胞管中,加入连接反应液,应同时做两个对照,一个加5pgM13噬菌体双链环状DNA,另一个则完全没有DNA。轻弹管外壁使其混匀,冰浴30min。 (4)取数支无菌培养管,分别加入3ml熔化的2×YT或SOB顶层琼脂,置47℃以备步骤6使用。 (5)将装有感受态细胞和DNA的培养管放入42℃水浴,温育整整90s,立即将管放回冰浴之中,2min后各管加入1ml过夜培养的JM101或TG1等菌液,混匀。 (6)在步骤(4)准备的装有溶化的2×YT或SOB顶层琼脂的管内各加入40μlX-gal溶液(20mg/ml,溶于二甲基甲酰胺)和4μlIPTG溶液(200mg/ml)振荡混匀,分别取(5)中混合物各300μl加入各管,振荡混匀,立即将管内混合物倾入标记好的LB琼脂平板上,轻轻旋动平皿,以使细菌与顶层琼脂分布均匀。 (7)盖好平皿,于室温放置5min,使顶层琼脂凝固,将平板倒置于37℃培养。4个h后噬斑开始出现,8~12h后菌斑不再变化。野生型M13噬菌体形成的噬斑为深蓝色,重组噬菌体则可形成无色噬斑。 四、含重组质粒的细胞菌落的鉴定含重组质粒的细胞菌落常用的鉴定方法有:①小规模制备质粒DNA进行限制酶切分析;②α互补;③插入失活;④杂交筛选。下面简要介绍小规模制备质粒DNA进行限制性酶切分析。小规模制备质粒DNA可用天美等公司的Wizard Minipreps DNA试剂盒或采用下述方法: 1.挑取一些独立的转化菌落进行小规模培养,用无菌牙签或挑种环挑取单菌落于2ml含有相应抗生素的LB液体培养基中,于37℃剧烈振摇下培养过夜。 2.将1.5ml培养物倒入微量离心管中,用微量离心机于4℃以12000g离心30s,将剩余的培养物贮存于4℃。 3.吸取培养液,使细菌沉淀尽可能干燥。 4.将细菌沉淀重悬于200μl溶液Ⅰ中,剧烈振荡。 溶液Ⅰ 25mmol/L Tris·HCl(pH8.0) 10mmol/LEDTA(pH8.0) 溶液Ⅰ可成批配制,每瓶约100ml,高压下101bf/m2(6.895×104pa)蒸气灭菌15min,贮存于4℃。 5.加200μl新配制的溶液Ⅱ。 溶液Ⅱ 0.2mol/L NaOH 1% SDS 盖紧管口,快速颠倒离心管5次,以混合内容物。应确保离心管的整个表面均与溶液Ⅱ接触。不要振荡,将离心管放置于冰上。 6.加200μl溶液Ⅲ 溶液Ⅲ 5mol/l 乙酸甲 60ml 冰乙酸11.5ml 水28.5ml 盖紧管口,将管倒置,温和振荡10min,使溶液Ⅲ在粘稠的细菌裂解物中分散均匀,之后将管置于冰上3~5min。 7.用微量离心管于4℃以12000g离心5min,将上清转移另一离心管中。 8.加等量酚和氯仿,振荡混匀,用微量离心机于4℃以12000g离心2min,将上清转移到另一离心管中。 9.用2倍体积的乙醇于室温沉淀双链DNA,振荡混合,于室温放置2min。 10.用微量离心机于4℃以12000g离心5min。 11.小心吸去上清液,将离管倒置于一张纸巾上,以使所有液体流出。再将附于管壁的液滴除尽。 12.用1ml70%乙醇于4℃洗涤双链DNA沉淀,按步骤1所述方法去掉上清,在空气中使核酸沉淀,干燥10min。 13.用50μl含无DNA酶的胰RNA酶(20μl/ml)的TE重新溶解核酸,振荡,贮存于-20℃。 14.用适当限制性内切酶分析所得DNA。 五、M13噬菌体重组DNA分子导入大肠杆菌1.感受态细胞的制备 (1)将1ml过夜培养的细菌(如DH52、TG1、TM101)接种于100ml2×YT培养于500ml烧瓶。于37℃刷烈振荡,通常≥200rpm培养的细菌密度约OD550=0.2~0.5(5×107cells/ml),需2~4h。 (2)将培养物放于冰上致冷10min,于4℃离心细菌培养物,10000rpm离心10min。 (3)弃除上清,将细菌悬浮于原始培养体积的一半(约50ml)的50mMCaCl2和10mmTris·HCl(pH8.0)无菌冷冻液体中。 (4)将细菌悬浮放在冰上约5min,然后将悬浮物于4℃10000/rpm离心10min。 (5)弃上清,悬浮细菌于原始培养体积的1/15的50mMCaCl和10mMTris·HCl(pH8.0)无菌冷冻中。此时的细胞是感受态细胞,即可用于转化。200μl分装于无菌的1.5ml微量离心管中,贮存于-80℃冰箱中。 2.转化程序 (1)取出200μl感受态细胞慢慢使其溶化,并立即放于冰上,加入DNA或连接反应混合物,DNA量通常≤50mg。用手指弹打试管10次,使之混匀,然后放在冰上40~45min。 (2)将管放于42℃水浴中2min。 (3)然后每管直接加入1.0ml2×YT培养基,倒置混匀,并于37℃培养8~12h,干浴或水浴,不需振摇。此期间使细菌生长并开始表达抗菌素。 (4)每200μl转化混合物分别于6个2×YT琼脂培养板上补充相应抗生素,并含有X-gal(20mg/ml)、IPTG(200mg/ml)。 (5)铺板使细菌混合物干后,倒转平板放于30~37℃培养箱中18~22h。克隆在此期间应该出现,否则转化不成功。 第二节 DNA的序列测定核酸的序列分析,即核酸一级结构的测定,是现代分子生物学中一项重要技术。目前应用的两种快速序列测定技术是Sanger等(1977年)提出的双脱氧链终止法及Maxam和Gilbert(1977年)提出的化学降解法,其中双脱氧链终止法是目前应用最多,最好的技术。 一、Sanger双脱氧链终止法原理 通常DNA的复制需要:DNA聚合酶,单链DNA模板,带有3-OH末端的单链寡核苷酸引物,4种dNTP(dATP、dGTP、dTTP和dCTP)。聚合酶用模板作指导,不断地将dNTP加到引物的3-OH末端,使引物延伸,合成出新的互补DNA链。如果加入一种特殊核苷酸,双 脱氧核苷三磷酸(ddNTP),因为它与普通dNTP不同,在脱氧核糖的3’位置缺少一个羟基,故不能同后续的dNTP形成磷酸二酯键。例如,存在ddCTP、dCTP和三种其他的dNTP(其中一种为α-32P标记)的情况下,将引物、模板和DNA聚合酶一起保温,即可形成一种全部具有相同的5-引物端和以ddC残基为3’端结尾的一系列长短不一片段的混合物。经变性聚丙烯酰胺凝胶电泳分离制得的放射性自显影区带图谱将为新合成的不同长度的DNA链中C的分布提供准确信息,从而将全部C的位置确定下来。采用类似的方法,在ddATP、ddGTP和ddTTP存在的条件下,可同时制得分别以ddA、ddG和ddT残基为3端结尾的三组长短不一的片段。将制得的四组混合物全部平行地点加在变性聚丙烯酸受凝胶电泳板上进行电泳,每组制品中的各个组分将按其链长的不同得到分离,从而制得相应的放射性自显影图谱。从所得图谱即可直接读得DNA的碱基序列,见图24-3所示。
图24-3 双脱氧链末端终止法测序基本原理示意图 二、双脱氧链止终法测定战略 由于DNA一般都由几千个单核苷组成。而目前测定DNA序列的最好方法,一次也只能测约600个核苷酸,因此进行DNA顺序测定前,需要用不同限制酶消化等测DNA,使其降成小片段,分别克隆到pUC1,18pUCl18,pUC19,M13mp18,M13mp19等载体中,分别测定各小片段的顺序,由于不同限制酶产生的片段之间有交错重叠顺序,根据片段间和末端重叠序列,用计算机软件如Mac Vector TM5.0分析DNA,Assemblylign TM排列出各片段的位置,进而排出DNA的全序列。 三、双脱氧链终止法测定方法 以M13噬菌体为载体的双氧链终止法的实施步骤为例: 1.M13噬菌体复制型双链DNA(RFDNA)的制备。 为了将待测双链DNA进行克隆,必须制备M13mp18或M13 mp19复制型(闭环双链)DNA,从M9培养基中,挑起单个克隆大肠杆菌,JM101到50ml2×YT培养基中,37℃振荡过夜。稀释1ml培养物到50ml2×YT培养中,于37℃振摇6h,转移2ml培养物于微量离心管中,12000g,离心5min细菌沉淀保留用于分离复制型RFDNA,上清用于分离噬菌体单链DNA。 细菌沉淀用于分离复制型DNA,可以采用标准的碱解方法或采用天美公司的Wizard Miniperps DNA试剂盒制备。(方法同分离质粒DNA方法)。 2.重组噬菌体制备 采用多克隆位点上的限制性内加酶切割待测DNA,并采用相同内切酶切割M13噬菌体RFDNA(采用Biol 101gene clean Ⅱ试剂盒分别纯化内切酶切割后的DNA片段),然后将待测外源DNA片段与M13复制型载体DNA连接过夜,连接反应物转染JM101感受态细菌,将连接物10μl与200μl感受态细菌混匀,放置冰上40~50min,再放在42℃水浴2min,然后加入1ml新鲜的静止相JM101培养物混匀,然后分别以300μl于含有IPIG(200mg/ml)和X-gal200mg/ml的2×YT培养基上,于37℃培养8h即可出现蓝色和白色噬斑,白色或称无菌噬斑,即为阳性重组噬菌体。 3.单链噬菌体DNA(模板DNA)的制备 上述平板的每个白色噬菌斑是由一种重组M13DNA分子转染细菌后产生的,如果取一个白色噬菌斑进行培养便可得到一种单链形式的DNA。为此,挑取一个白色噬菌斑转接到一个新鲜制备的OD600=0.1的大肠杆菌JM101培养物中,于37℃振摇5h左右,12000g离心10min,上清转移到另一新微量离心管中用于分离单链DNA,按1ml上清液中加入含20%聚乙二醇PEG-6000的2.5m NaCl 200μl沉淀噬菌体,再用饱和酚抽提除去噬菌体蛋白,最后用1/10体积的3m NaAc和乙醇沉淀单链DNA,浓度调至0.1~0.5μg/μl,也可采用天美公司的Wizard TM M13DNA纯化试剂盒分离纯化M13单链DNA。 4.引物制备 可以购买通用引物或实验室合成15bp~26bp长度的引物,通常以2μg/ml的浓度贮存于-20℃备用。 5.微量滴板 进行大批量的模板测序时,常在密闭的微量离心管中进行与引物的退火反应,然后在微量滴板中进行链延伸-链终止反应。 6.变性聚丙烯酰胺凝胶 测序凝胶装置的大小形状均不相同,其主要参数有:①长度通常为40~50cm;②宽度通常为20cm;③厚度通常为0.3~0.4mm;④横截面形状为楔形或锥形,即顶部薄,底部厚,或者是将底部凝胶缓冲液的浓度提高;⑤加样槽;⑥整块凝胶上的温度应均一。 7.电泳后将凝胶干燥,放射自显影。 8.凝胶上读取DNA序列。 此时读取的是目的DNA的互补链3~5的序列。 第三节 基因序列的突变分析目前对于基因序列的突变分析国内外多采用直接测序方法,直观又准确。例如,1996年Sakai等报道了对高α脂蛋白血症患者CETP基因内含子10和内含子14片段序列的突变分析。其方法为:采取患者全血根据Kunkel等方法准备基因DNA;CETP基因内含子10的splice donor位点的PCR扩增引物为:5-CCCTGCGAATTCTTCTTCTGAGGAGTGGAC-3’和5-ATAATTGCATCCATTGGTGGTGTTSTTGGC-3’,内含子14的splice donor位点的PCR扩增引物为:5’-CTTCTGTGCTCCAGGGAGGACTCACCATGG-3’和5’-GGCACCCAGTTTCCCCTCCAGCCCACACAT-3’其中分别含有用于克隆的EcorI和BamHI酶切后,亚克隆人BluescriptllKS(一)中;最后根据Sanger双脱氧核苷酸终点法测定DNA序列。 (章晓联) (DNA的克隆与序列测定)参考文献1.(美)J萨拇布鲁克,EF弗里奇,T曼尼阿蒂斯着,金科雁,黎孟枫等译,分子克隆实验指南,第二版,北京:科学出版社。1992 2.ThKohler ,D Labner,AK Rost ,et al.Quantiattion of mRNA by Polymerase ChainReaction (Nonradioactive PCRMethods ),Springer Lab Manual,1995 3.NaohikoSakai,Silvia Santamarina-fojo Shiauya Yamashita,et al.Exon 10 skipping causedby intron 10 splice donor site mutation in cholesteryl ester transfer proteingene results in abnormal dowstream splice site selection.Journal of LipidResearch,1996 Vol137:2065-2070 4.王林芳,潘华珍主编,分子生物学基本技术,北京,北京生理科学会,1991 5.LawrenceAkaplan ,Amadeo Jpesce,Clinical Chemistry.Theory anslysis and correlation(ThirdEditim)Mosby,1996 附录一 参考值血脂参考值
载脂蛋白参考值*
注:*刘秉文.脂类代谢Ⅱ.见:顾天爵主编,冯宗忱副主编生物化学.第四版.北京人民卫生出版社,1995,179~182 **周新主编.医学检验项目与临床意义.武汉:湖北科学技术出版社,1996 ***周子秋主编.实用临床检查.台北:广思医学开发精研中心,1993 ****叶应妩 李健斋 王玉琛,主编.临床实验论断学(上).北京:人民卫生出版社,1985 相关阅读点评内容我要报错 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


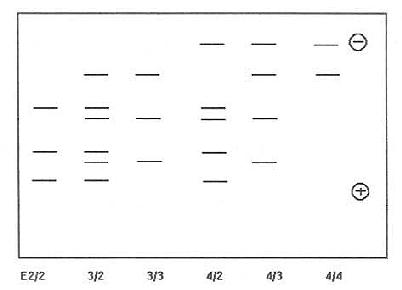
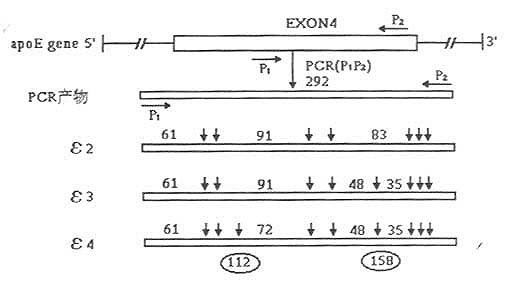
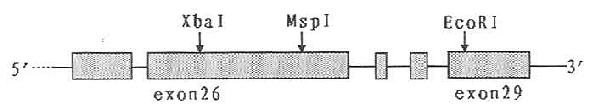
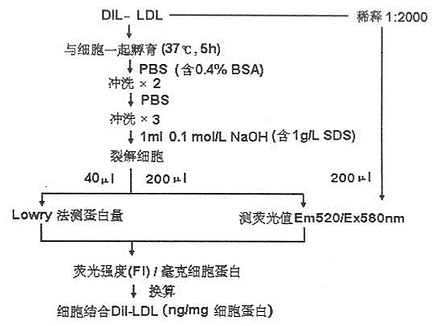
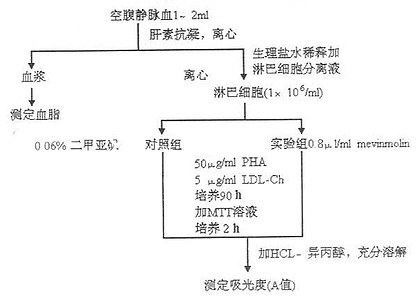
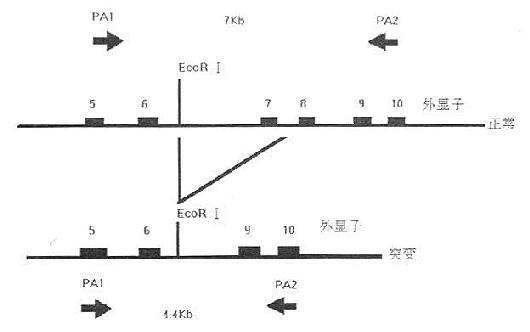


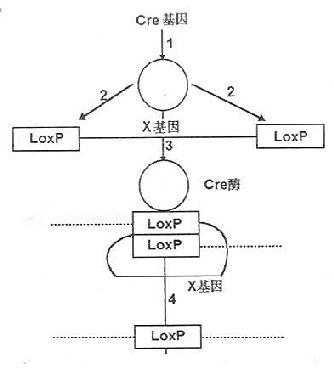
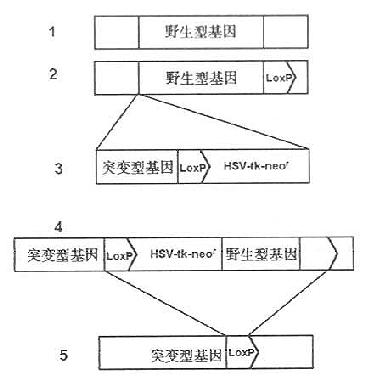

 在线咨询
在线咨询